Química Introductoria – 1a Edición Canadiense
Objetivos de aprendizaje
- Definir la presión de vapor de los líquidos.
- Explicar el origen de la tensión superficial y de la acción capilar.
Hay algunas propiedades que todos los líquidos. El líquido con el que estamos más familiarizados es probablemente agua, y tiene estas propiedades. Otros líquidos también los tienen, lo cual es algo a tener en cuenta.
Todos los líquidos tienen una cierta porción de sus partículas que tienen suficiente energía para entrar en la fase gaseosa, y si estas partículas están en la superficie del líquido, lo hacen (Figura 10.6 «Evaporación»). La formación de un gas a partir de un líquido a temperaturas por debajo del punto de ebullición se denomina evaporación. A estas temperaturas, el material en la fase gaseosa se llama vapor, en lugar de gas; el término gas se reserva para cuando la fase gaseosa es la fase estable.
Figura 10.6 Evaporación

Algunas partículas de un líquido tienen suficiente energía para escapar de la fase líquida y convertirse en vapor.
Si el volumen disponible es lo suficientemente grande, eventualmente todo el líquido se convertirá en vapor. Pero si el volumen disponible no es suficiente, eventualmente algunas de las partículas de vapor volverán a entrar en la fase líquida (Figura 10.7 «Equilibrio»). En algún momento, el número de partículas que entran en la fase de vapor será igual al número de partículas que salen de la fase de vapor, por lo que no hay un cambio neto en la cantidad de vapor en el sistema. Decimos que el sistema está en equilibrio. La presión parcial del vapor en equilibrio se denomina presión de vapor del líquido.
Figura 10.7 Equilibrio

En algún momento, el número de partículas que entran en la fase de vapor se equilibrará con el número de partículas que regresan al líquido. Este punto se llama equilibrio.
Comprenda que el líquido no ha dejado de evaporarse. El proceso inverso, la condensación, se produce tan rápido como la evaporación, por lo que no hay un cambio neto en la cantidad de vapor en el sistema. El término equilibrio dinámico representa una situación en la que todavía ocurre un proceso, pero el proceso opuesto también ocurre a la misma velocidad, de modo que no hay un cambio neto en el sistema.
La presión de vapor de una sustancia depende de la temperatura de la sustancia; a medida que aumenta la temperatura, también lo hace la presión de vapor. Gráfico 108 «Gráficas de Presión de Vapor versus Temperatura para Varios Líquidos» es una gráfica de presión de vapor versus temperatura para varios líquidos. Una vez definida la presión de vapor, también podemos redefinir el punto de ebullición de un líquido: la temperatura a la que la presión de vapor de un líquido es igual a la presión ambiental circundante. La presión de vapor normal, entonces, es la temperatura a la que la presión de vapor es de 760 torr, o exactamente 1 atm. Por lo tanto, los puntos de ebullición varían con la presión circundante, un hecho que puede tener grandes implicaciones en la cocción de alimentos a elevaciones más bajas o más altas de lo normal. La presión atmosférica varía significativamente con la altitud.
Figura 10.8 Gráficas de Presión de vapor versus Temperatura para Varios Líquidos
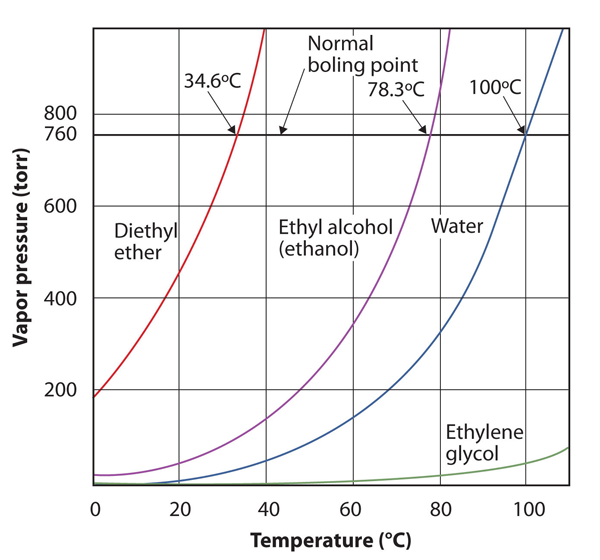
La presión de vapor de un líquido depende de la identidad del líquido y de la temperatura, como muestra esta gráfica.
Ejemplo 4
Use la Figura 10.8 «Gráficas de Presión de Vapor versus Temperatura para Varios Líquidos» para estimar el punto de ebullición del agua a 500 torr, que es la presión atmosférica aproximada en la parte superior del Monte Everest.
Solución
Vea la figura adjunta. Quinientos torr están entre 400 y 600, por lo que extendemos una línea desde ese punto en el eje y hasta la curva para el agua y luego la dejamos caer hasta el eje x para leer la temperatura asociada. Parece que el punto de la curva de presión de vapor de agua corresponde a una temperatura de aproximadamente 90 ° C, por lo que concluimos que el punto de ebullición del agua a 500 torr es de 90°C.
Figura 10.9 Utilizando la Figura 10.8 «Gráficas de Presión de vapor versus Temperatura para Varios Líquidos» para responder al Ejemplo 4
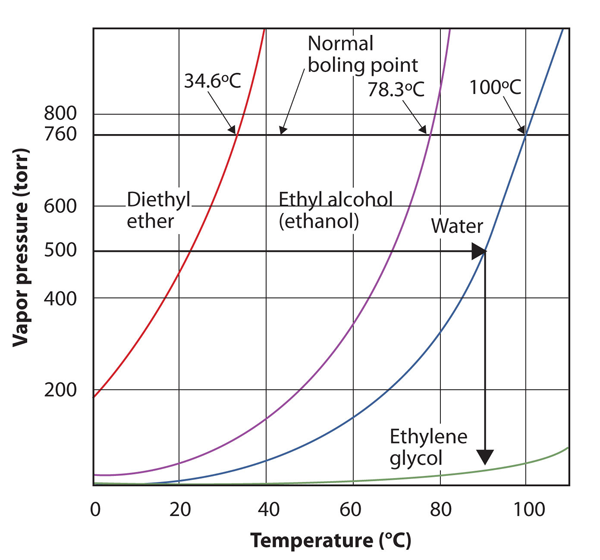
Leyendo el gráfico correctamente, puede estimar el punto de ebullición de un líquido a diferentes temperaturas.
Pruébese a Sí mismo
Use la Figura 10.8 «Gráficas de Presión de Vapor versus Temperatura para Varios Líquidos» para estimar el punto de ebullición del etanol a 400 torr.
Respuesta
aproximadamente 65°C
La curva de presión de vapor para el agua no es exactamente cero en el punto de fusión—0°C. Incluso el hielo tiene una presión de vapor; es por eso que se sublima con el tiempo. Sin embargo, las presiones de vapor de los sólidos suelen ser mucho más bajas que las de los líquidos. A -1°C, la presión de vapor del hielo es de 4,2 torr. A una temperatura de congelación de 0 ° F (-17°C), la presión de vapor del hielo es de solo 1,0 torr; los denominados congeladores profundos pueden bajar a -23°C, donde la presión de vapor del hielo es de solo 0,6 torr.
Diagramas de fase
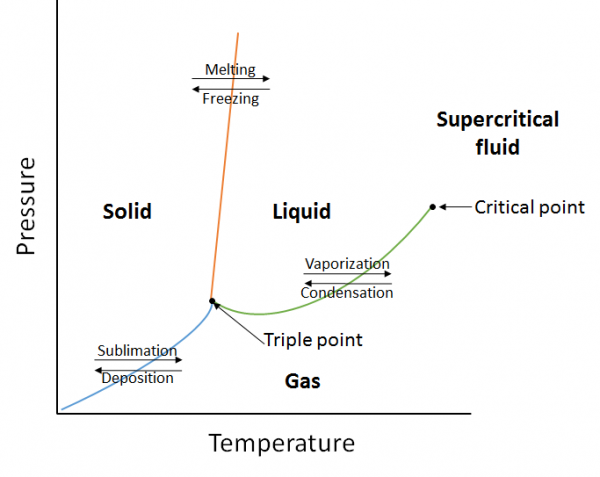
Un diagrama de fase es una representación gráfica de las relaciones de equilibrio que existen entre las fases de una sustancia bajo presiones y temperaturas especificadas (Figura 10.10). El diagrama de fases es una combinación de tres curvas: la curva de presión de vapor, la curva de fusión y la curva de sublimación. Hemos visto anteriormente que las curvas de presión de vapor representan el equilibrio entre la fase líquida y gaseosa, y el punto en el que la presión es igual a 1 atm es el punto de ebullición normal. Una característica adicional de esta curva en el diagrama de fases (verde), es que termina en el punto crítico. El punto crítico es el punto a la temperatura y presión más altas en el que los líquidos y los gases permanecen distinguibles. A temperaturas y presión más allá de este punto, la materia existe en una fase con propiedades de líquidos y gases conocida como fluido supercrítico.
La curva de fusión (naranja) representa el equilibrio entre sólido y líquido, y el punto en el que la presión es igual a 1 atm es el punto de fusión normal. La curva de sublimación (azul) representa el equilibrio que existe entre sólido y gas. Finalmente, el punto donde las tres curvas se encuentran se conoce como el punto triple. En este punto, tres fases (sólida, líquida y gaseosa) existen en equilibrio.
Ejemplo:
Utilizando el siguiente diagrama de fases, determine qué pasaría si:
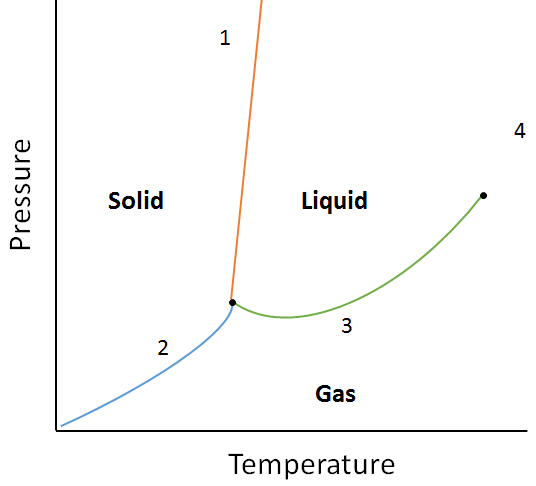
a. La temperatura se incrementa para la materia en el punto 1.
b. La presión aumenta para la materia en el punto 3.
Solución:
a. La materia en el punto 1 se fundirá (cambia de fase de sólida a líquida) si se aumenta la temperatura.
b. La materia en el punto 3 se condensará (fase de cambio de gas a líquido) si se aumenta la temperatura.
Tensión Superficial y Acción Capilar
Todos los líquidos también comparten algunas otras propiedades. La tensión superficial es un efecto causado por un desequilibrio de fuerzas en los átomos en la superficie de un líquido, como se muestra en la Figura 10.11 «Tensión superficial». La partícula azul en la mayor parte del líquido experimenta fuerzas intermoleculares de todo alrededor, como lo ilustran las flechas. Sin embargo, la partícula amarilla en la superficie no experimenta ninguna fuerza por encima de ella porque no hay partículas por encima de ella. Esto conduce a un desequilibrio de fuerzas que llamamos tensión superficial.
Figura 10.11 Tensión superficial

La tensión superficial proviene del hecho de que las partículas en la superficie de un líquido no experimentan interacciones desde todas las direcciones, lo que conduce a un desequilibrio de fuerzas en la superficie.
Figura 10.12 Efectos de la tensión superficial
