Química para No Mayores
¿Cómo cambia la energía de este trabajador a medida que sube y baja por la escalera?
Subir una escalera requiere energía. A cada paso, te estás empujando contra la gravedad y acumulando energía potencial. Volver a bajar libera esa energía potencial a medida que desciendes paso a paso. Si no tienes cuidado, puedes liberar esa energía potencial de una sola vez cuando te caes de la escalera (nunca es una buena idea). Además, se sube o baja por escalones. No hay una posición» intermedia » en la escalera: su pie golpea un peldaño o golpea un espacio vacío y está en problemas hasta que encuentre un peldaño para pararse.

Tras los descubrimientos de espectros de emisión de hidrógeno y el efecto fotoeléctrico, el físico danés Niels Bohr (1885-1962) propuso un nuevo modelo del átomo en 1915. Bohr propuso que los electrones no irradian energía a medida que orbitan el núcleo, sino que existen en estados de energía constante que llamó estados estacionarios. Esto significa que los electrones orbitan a distancias fijas del núcleo (ver la Figura a continuación). El trabajo de Bohr se basó principalmente en los espectros de emisión del hidrógeno. Esto también se conoce como el modelo planetario del átomo. Explicaba el funcionamiento interno del átomo de hidrógeno. Bohr fue galardonado con el Premio Nobel de física en 1922 por su trabajo.
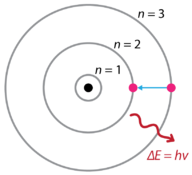
Figura 1. Espectros de emisión de hidrógeno del modelo atómico de Bohr.
Bohr explicó que los electrones se pueden mover a diferentes órbitas con la adición de energía. Cuando se elimina la energía, los electrones regresan a su estado fundamental, emitiendo una cantidad correspondiente de energía, un cuántico de luz o fotón. Esta fue la base de lo que más tarde se conoció como teoría cuántica . Esta es una teoría basada en el principio de que la materia y la energía tienen las propiedades de partículas y ondas. Da cuenta de una amplia gama de fenómenos físicos, incluida la existencia de paquetes discretos de energía y materia, el principio de incertidumbre y el principio de exclusión.
De acuerdo con el modelo de Bohr, a menudo denominado modelo planetario, los electrones rodean el núcleo del átomo en trayectorias permitidas específicas llamadas órbitas. Cuando el electrón está en una de estas órbitas, su energía es fija. El estado fundamental del átomo de hidrógeno, donde su energía es más baja, es cuando el electrón está en la órbita más cercana al núcleo. Las órbitas que están más lejos del núcleo son todas de energía sucesivamente mayor. El electrón no puede ocupar ninguno de los espacios entre las órbitas. Una analogía cotidiana con el modelo de Bohr son los peldaños de una escalera. A medida que subes o bajas una escalera, solo puedes ocupar peldaños específicos y no puedes estar en los espacios entre peldaños. Subir por la escalera aumenta tu energía potencial, mientras que bajar por la escalera disminuye tu energía.
El trabajo de Bohr tuvo una fuerte influencia en nuestra comprensión moderna del funcionamiento interno del átomo. Sin embargo, su modelo funcionó bien para una explicación de las emisiones del átomo de hidrógeno, pero fue seriamente limitado cuando se aplicó a otros átomos. Poco después de que Bohr publicara su modelo planetario del átomo, se hicieron varios descubrimientos nuevos, que dieron como resultado, una vez más, una visión revisada del átomo.
Resumen
- El modelo de Bohr postula que los electrones orbitan el núcleo a niveles de energía fijos.
- Las órbitas más alejadas del núcleo existen a niveles de energía más altos.
- Cuando los electrones regresan a un nivel de energía más bajo, emiten energía en forma de luz.
Práctica
Use el enlace de abajo para responder a las siguientes preguntas:
- ¿Cómo un electrón cambio órbitas?
- ¿En qué se basó el modelo de Bohr?
- ¿Qué creía Bohr de las órbitas?
- ¿Funciona el modelo de Bohr para todos los átomos?
Revisión
- Cuando hizo Bohr propone su modelo del átomo?
- ¿Qué es un estado estacionario?
- ¿Cuál es el estado fundamental?
- ¿Puede el electrón ocupar algún espacio entre las órbitas?
Glosario
- modelo planetario: Una forma de describir el modelo del átomo de Bohr.
- teoría cuántica: La materia y la energía tienen las propiedades de partículas y ondas.
- estado estacionario: Los electrones orbitan a una distancia fija del núcleo.