Retrasos AV y VV
1. Conceptos básicos
- Conceptos básicos: Optimización del retardo AV y del retardo VV
- Optimización del retardo AV
- Optimización del retardo VV
- ¿Estimulación biventricular o solo con ventrículo izquierdo ?
- Algoritmo AdaptivCRT
La resincronización biventricular proporciona un beneficio clínico significativo, una remodelación inversa con reducción del volumen cardíaco y una disminución de la morbilidad y mortalidad en pacientes con insuficiencia cardíaca con QRS amplio. La principal limitación de esta terapia es que todos los estudios encontraron un porcentaje significativo de pacientes que no responden favorablemente a la terapia de resincronización. Se han propuesto diferentes enfoques para reducir el porcentaje de pacientes que no responden. Una vez implantado el paciente, un ajuste subóptimo del dispositivo de TRC puede contribuir a alterar la calidad de la respuesta. El principio de la TRC es cambiar la secuencia de activación en un paciente con trastorno de conducción eléctrica ajustando los retrasos de activación entre una derivación auricular derecha, una derivación ventricular derecha y una derivación ventricular izquierda. En este contexto, se puede acceder a dos parámetros programables: 1) el retraso AV que determina el tiempo de activación entre la aurícula derecha y el ventrículo derecho, con programación independiente de un retraso AV detectado (después de la detección de una aurícula espontánea (COMO ciclo-VB)) y un retraso AV de ritmo tras un ritmo auricular (AP-ciclo VB). Es posible programar un retardo AV variable con una reducción lineal del retardo AV paralela al aumento de la frecuencia cardíaca; 2) El retardo VV regula el retardo de activación entre el ventrículo derecho y el ventrículo izquierdo; la activación simultánea (retardo VV a 0), una preactivación derecha (RV à LV, X ms) o una preactivación izquierda (LV à RV, X ms) son programables; no es posible programar un retardo VV variable con diferentes valores en reposo y durante el ejercicio. Los estudios hemodinámicos agudos han demostrado claramente un beneficio significativo proporcionado por la optimización del retraso AV y / o VV. La demostración clínica de este beneficio es mucho menos convincente.
OPTIMIZACIÓN DEL RETRASO AV
La contracción auricular contribuye al 20-30% del gasto cardíaco en reposo en pacientes con insuficiencia cardíaca con disfunción sistólica, contribución que aumenta durante el ejercicio. Los pacientes con insuficiencia cardíaca con trastorno de la conducción eléctrica a menudo muestran asincronía auriculoventricular con un acortamiento del tiempo de llenado, una fusión de las ondas E y A y regurgitación mitral diastólica.En pacientes resincronizados, la programación de un retardo AV corto permite anticipar la onda E, una disociación de las ondas E y A y la prolongación del tiempo de llenado. El retraso AV no debe ser demasiado corto, ya que esto provocaría la amputación de la onda A mediante cierre mitral. Se recomienda ajustar el retraso AV después del implante de un marcapasos o desfibrilador TRC, incluso si el nivel de evidencia clínica es modesto.Existen grandes variaciones interindividuales en la conducción intrauricular y los trastornos intraventriculares que generan marcadas diferencias en términos de retraso AV óptimo que justifican teóricamente un enfoque personalizado para cada paciente. Los retrasos AV detectados y de ritmo son programables de forma independiente y también deben optimizarse de forma independiente. Una limitación de la optimización del retraso AV es que generalmente se realiza en reposo en posición supina y para una frecuencia cardíaca determinada. Estas condiciones difieren significativamente de las observadas en la vida cotidiana. Durante el ejercicio, a diferencia de los pacientes con corazón sano, donde el retraso AV óptimo se acorta con el aumento de la frecuencia cardíaca, parece que la respuesta de los pacientes resincrónicos al estrés no es estereotipada. En algunos pacientes, el retraso AV óptimo durante el ejercicio es más largo que en reposo, en otros es más corto. El uso sistemático del algoritmo automático de retardo AV probablemente asegura la captura continua durante el ejercicio, pero no se asocia necesariamente con un beneficio hemodinámico adicional. Por lo tanto, se debe discutir su programación para cada paciente. La resincronización biventricular permite una remodelación inversa con una reducción progresiva en el tiempo de las presiones de arena del volumen telesistólico y diastólico final. Por lo tanto, lo ideal es que la optimización del retraso AV se repita periódicamente.El retraso AV óptimo permite una contribución máxima de la contracción auricular izquierda al llenado ventricular izquierdo, prolonga el tiempo de llenado, mejora el gasto cardíaco en ausencia de regurgitación mitral diastólica.Si el retraso AV es demasiado largo, la contracción auricular se produce demasiado pronto en la diástole, limitando la contribución auricular al llenado ventricular. La contracción auricular se superpone con la fase diastólica inicial. La ecocardiografía cardíaca encuentra una fusión entre la onda E y la onda A y un tiempo de llenado corto con regurgitación mitral diastólica persistente.Si el retraso AV es demasiado corto, la contracción ventricular ocurre demasiado pronto, lo que resulta en un cierre mitral prematuro que interrumpe el llenado actual y limita la contribución auricular al llenado ventricular. La ecocardiografía encuentra una onda E prematura, un tiempo de llenado largo y ondas E y A divididas con una onda A truncada por el cierre mitral. La disminución de la presión diastólica final y la disminución de la precarga conducen a una reducción de la dP / dt max y del gasto cardíaco.Antes de iniciar la optimización de retardo AV, se deben conocer algunos elementos. En pacientes con bloqueo auriculoventricular completo y bloqueo AV de alto grado o con un intervalo PR muy largo, los cambios en el retraso AV no tendrán un efecto directo en el grado de captura y fusión ventricular. Por el contrario, en pacientes con conducción auriculoventricular conservada, prolongar el retraso AV provocará una fusión progresiva con activación espontánea. El ajuste del retraso AV debe realizarse bajo control electrocardiográfico integrando la idea de que en el grupo de pacientes sin bloqueo AV completo, que representa a la mayoría de los pacientes, el ajuste del retraso AV variará el retraso entre la sístole auricular y la sístole ventricular, pero también interferirá directamente con la secuencia de activación ventricular y el grado de fusión ventricular. Para superar esta dificultad, el retraso AV a menudo se programa sistemáticamente corto (entre 90 y 120 ms después de una actividad auricular detectada y entre 130 y 150 ms después de la estimulación auricular).
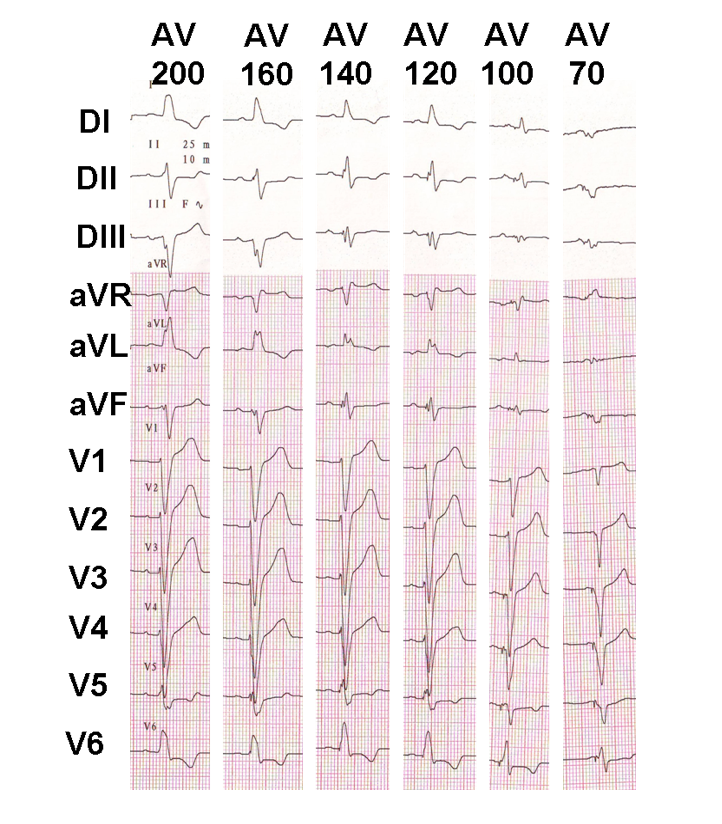
Ejemplo de ajuste progresivo del retraso AV en un paciente resincronizado con conducción AV conservada; aparece la fusión progresiva con la prolongación del retraso AV.Se han propuesto varias técnicas para optimizar el retraso AV:
- Ecocardiografía
Se han propuesto diferentes métodos ecocardiográficos para optimizar el retraso AV: el método de Ritter (que no ha sido validado en una población de pacientes con insuficiencia cardíaca), la búsqueda de una IVP aórtica o mitral máxima, una dP / dt máxima y el método iterativo. Este último es ampliamente utilizado en la práctica clínica, con el objetivo de obtener el mayor tiempo de llenado sin amputación de la onda A basada en el análisis de flujo transmitral. - Otros métodos
Se pueden utilizar varias estimaciones de la contractilidad cardíaca o del gasto cardíaco: pulso de onda, presión arterial, dP / dt max, apariencia electrocardiográfica … La aplicabilidad clínica en la práctica diaria es a menudo limitada. - Algoritmo de optimización automática integrado en el dispositivo
Si son necesarias optimizaciones repetidas de retardo AV y se deben realizar en varias condiciones de pre carga, la solución ideal sería que el marcapasos lo realice él mismo. La función AdpativCRT está disponible en la última generación de desfibriladores Medtronic; los principios operativos de este nuevo algoritmo se discutirán al final del presente capítulo.
OPTIMIZACIÓN DEL RETARDO VV
Algunos pacientes no responden a la TRC y continúan presentando una disincronía ventricular mecánica significativa después del implante. El ajuste del retraso de la VV da lugar a una estimulación biventricular secuencial y tiene un impacto directo en la secuencia de activación ventricular. Se puede proponer la modificación del retraso VV para reducir la asincronía persistente en pacientes que no responden. Este parámetro parece interesante en teoría en pacientes con una posición subóptima de la derivación del VI, o una latencia y un tiempo de conducción prolongado en el sitio de estimulación. Si la optimización del retraso de la VV permite un beneficio hemodinámico agudo significativo, la cuestión de la relevancia clínica de este parámetro sigue siendo debatida y no confirmada por estudios clínicos. En cuanto al ajuste del retardo AV, es probable que el proceso de remodelación afecte directamente la optimización del retardo VV y que la optimización de este parámetro deba repetirse a lo largo del tiempo y en diversas condiciones de precarga.
Se pueden utilizar las mismas herramientas para optimizar el retardo AV y VV. La ecocardiografía cardíaca se utiliza a menudo en la práctica clínica. Se utilizan principalmente la IVP aórtica que refleja el gasto cardíaco, la dP/dt max que refleja la contractilidad cardíaca o la medición del grado de asincronía ventricular. Una vez más, la función AdaptivCRT también propone optimizar automáticamente el retardo VV. A la luz de los límites prácticos de la optimización VV, el ajuste automático repetido de este parámetro por el propio dispositivo parece prometedor. Sin embargo, todavía es necesario demostrar su relevancia clínica.
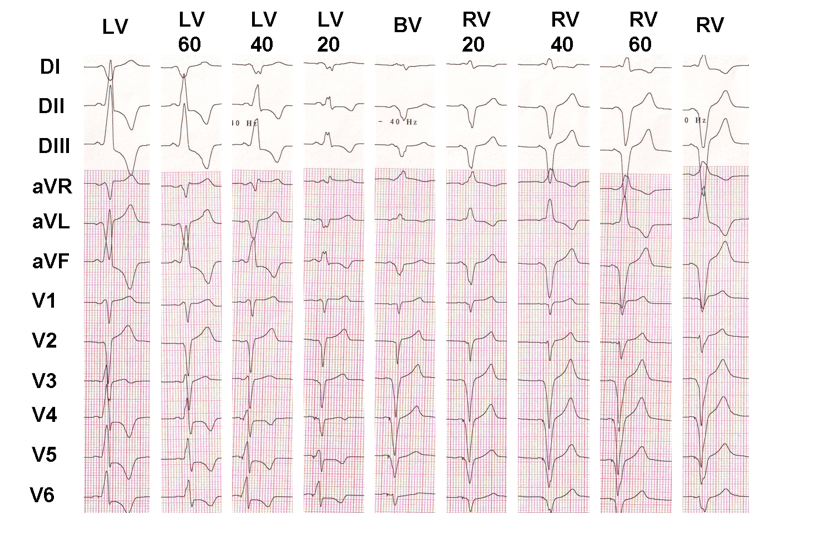
Este ejemplo muestra el efecto del retardo VV en la activación eléctrica ventricular; si es fácil demostrar que el aspecto electrocardiográfico es realmente diferente de una configuración a otra, es mucho más difícil determinar qué configuración proporcionará la mejor respuesta clínica.
¿ESTIMULACIÓN DEL VI SOLA O ESTIMULACIÓN BIVENTRICULAR?
Uno de los principios operativos del algoritmo AdaptivCRT consiste en elegir entre el ventrículo izquierdo con fusión y la estimulación biventricular.Ningún estudio ha demostrado nunca la superioridad de la estimulación biventricular sobre una estimulación ventricular izquierda pura. En contraste, los estudios hemodinámicos agudos han encontrado consistentemente un beneficio significativo con la estimulación ventricular izquierda aislada. De manera similar, los estudios clínicos encontraron un beneficio más o menos idéntico en términos de clase de la NYHA, capacidad de ejercicio y remodelación ventricular a los observados con la estimulación biventricular. Sin embargo, los grandes estudios que demostraron los beneficios de la resincronización se realizaron con estimulación biventricular y no con estimulación ventricular izquierda.
En la configuración de estimulación del VI, la resincronización de los dos ventrículos se puede obtener mediante la fusión entre la activación del ritmo ventricular izquierdo y la activación intrínseca del ventrículo derecho. Si parece que el beneficio hemodinámico agudo óptimo se puede obtener con un cierto grado de fusión (datos limitados en un número muy limitado de pacientes), este grado óptimo de fusión es difícil de definir y mantener durante el ejercicio (cambios en la frecuencia cardíaca y el intervalo PR).La estimulación ventricular izquierda aislada es una opción atractiva, especialmente si el dispositivo implantado es un marcapasos TRC. De hecho, se puede realizar utilizando un marcapasos bicameral convencional sin implante de plomo ventricular derecho, lo que aumenta la relación coste / eficacia y reduce el riesgo de complicaciones. Sin embargo, en pacientes dependientes de marcapasos con bloqueo AV, la implantación de solo un electrodo ventricular izquierdo parece arriesgada, dado el mayor porcentaje de desprendimiento de electrodo y el elevado umbral de estimulación. En los pacientes a los que se les ha implantado un desfibrilador TRC, la implantación de un cable ventricular derecho es esencial. Sin embargo, la programación del dispositivo en una configuración de «solo estimulación del VI» evita el consumo asociado a la estimulación ventricular derecha.
ALGORITMO ADAPTIV-CRT
Como se ha visto anteriormente, lo ideal para optimizaciones repetidas de la configuración de estimulación sería que el propio dispositivo lo realice automáticamente. Este procedimiento de optimización no tiene costos adicionales, y es «sin esfuerzo» para el médico y los diferentes departamentos clínicos (ecocardiografía, electrofisiología)…). Además, la mayoría de las mediciones realizadas por el dispositivo son reproducibles. El algoritmo de optimización AdaptivCRT fue desarrollado con este objetivo. Sin embargo, la demostración de su impacto clínico favorable en pacientes resincronizados sigue sin probarse.
Principios operativos
El algoritmo AdaptivCRT solo está disponible en modo DDD o DDDR y se puede programar seleccionando cualquiera de los dos: 1) el ajuste» Adaptive Bi-V «- el dispositivo optimiza automáticamente los parámetros de estimulación (retrasos AV y VV) – o 2) el ajuste» Adaptive Bi-V y LV » – el dispositivo elegirá entre una configuración de estimulación biventricular pura con fusión y una estimulación biventricular regular con optimización de los retrasos AV y VV. Este algoritmo también se puede desactivar programando 3) «CRT no adaptativa».
Este algoritmo nunca conduce al uso de valores extremos de retrasos AV o VV. Para la función AdaptivCRT, los posibles retrasos AV detectados oscilan entre 80 y 140 ms. Los posibles retrasos AV de ritmo oscilan entre 100 ms y 180 ms. El intervalo de tiempo para los retrasos VV intraventriculares varía de 0 ms a 40 ms (preexcitación izquierda o derecha).
La función operativa de AdaptivCRT se basa en la evaluación regular de 1) el tiempo de conducción auriculoventricular, que corresponde al retraso entre el EGM registrado por la derivación auricular derecha y el EGM registrado por la derivación ventricular derecha; 2) la amplitud de la onda P, que corresponde a la demora entre la aurícula EGM registrados en el bipolar canal de la aurícula derecha plomo y el final de la aurícula EGM registrados por el choque de canales; 3) el ancho del complejo QRS que corresponde a la demora entre el EGM detectado por el ventrículo derecho bipole y el final de la REUNIÓN de expertos se registran en el choque de canal.
El algoritmo evalúa la conducción auriculoventricular intrínseca del paciente cada minuto y determina si el intervalo AV del paciente es normal o prolongado. La medición del intervalo AV se realiza extendiendo el retardo AV detectado y pautado a 300 ms para permitir la conducción intrínseca. En ausencia de evento ventricular espontáneo durante más de 3 ciclos consecutivos, se diagnostica una conducción AV prolongada y se duplica el intervalo de tiempo entre mediciones del intervalo AV (por ejemplo, 2 min, 4 min, 8 min and y así sucesivamente hasta alcanzar un máximo de 16 horas).
Las mediciones de ancho de onda P y QRS se programan cada 16 horas. Este intervalo justifica una toma de muestras a diferentes horas del día. Durante la medición, el dispositivo cambiará el canal de grabación EGM 1 a bobina RV (HVA)/ bobina SVC (HVB) (o ánodo HVA/auricular en ausencia de bobina SVC). Después de 5 latidos, se mide el retraso entre el EGMs auricular y ventricular, el ancho de la onda P y el ancho del QRS.
La primera medición de la onda P y el ancho del QRS está programada 30 minutos después del implante. Después de la implantación, la onda P y el ancho del QRS se pueden medir en cualquier momento programando el parámetro AdaptivCRT.
Si el parámetro AdaptivCRT se establece en «Adaptive Bi-V and LV», puede cambiar automáticamente entre el modo BIV automático y el modo LV. El paciente será estimulado en modo VI puro, si se respetan las siguientes condiciones: 1) la frecuencia cardíaca del paciente debe ser menor o igual a 100 lpm; 2) el retraso de conducción entre la EGM atrial espontánea y la EGM ventricular espontánea debe ser menor o igual a 200 ms; 3) el retraso de conducción entre la EGM atrial a ritmo acelerado y la EGM ventricular espontánea debe ser menor o igual a 250 ms. Si no se encuentra uno de estos criterios, se estimula al paciente en modo biventricular.
Detalles de la función operativa del algoritmo
El funcionamiento exacto de este algoritmo es relativamente confidencial.
En un primer paso, el dispositivo evalúa la conducción intrínseca para determinar si el intervalo AV de un paciente es normal o prolongado. Los intervalos AV normales se definen como menos de 200 ms para los intervalos de detección auricular y menos de 250 ms para los intervalos de ritmo auricular.
En presencia de un tiempo de conducción AV normal y si la frecuencia cardíaca del paciente está por debajo de 100 bpm, el dispositivo utilizará el modo de estimulación adaptativa VI (solo ritmo VI). La sincronización del ritmo del VI se ajusta automáticamente en función de la medición intrínseca del intervalo AV que se produce cada minuto.
Si el tiempo de conducción AV del paciente supera los 133,3 ms, la estimulación del VI se produce en aproximadamente el 70% del intervalo AV intrínseco.
Si el tiempo de conducción AV es inferior a 133,3 ms, la estimulación VI se realizará 40 ms antes del QRS intrínseco (retraso AV calculado – 40 ms).
Cuando los intervalos AV intrínsecos se prolongan, o cuando la frecuencia cardíaca del paciente está por encima de 100 lpm, o si se confirma una pérdida de captura del VI mediante el manejo de captura del VI (CMVI), funcionará el modo BiV adaptativo.
El retraso AV se calculará de la siguiente manera:
- Después de un evento auricular detectado, el retraso AV se ajusta a un ritmo de 40 ms después del final de la onda P (medida en el canal de choque) pero al menos 50 ms antes del inicio del QRS intrínseco.
- Después de un evento auricular con ritmo, el retraso AV se ajusta a un ritmo de 30 ms después del final de la onda P (medida en el canal de choque), pero al menos 50 ms antes del inicio del QRS intrínseco durante la estimulación auricular (tiempo entre el estímulo auricular y la EGM bipolar del ventrículo derecho).
Durante la estimulación BiV adaptativa, el retardo VV óptimo se deducirá del ancho del QRS.
Si la duración del QRS (temporización entre el EGM bipolar del RV y el final del EGM del QRS en el canal de choque) está incluida entre 50 ms y 150 ms, el LV estará preexcitado. Si se incluye el ancho del QRS entre 150 y 180 ms, se establece una preexcitación ventricular derecha. Si el ancho del QRS no está incluido entre 50 y 180 ms, se utilizará una preexcitación de LV o RV de 10 ms.Los tiempos de conducción AV y el ancho de onda P también se utilizarán para optimizar el retardo VV. Si el tiempo de conducción AV durante el ritmo auricular espontáneo es más largo que el ancho de la onda P, el retardo VV se ajustará a 0 ms.