Enthalpie et Réactions chimiques
7.3 Enthalpie et Réactions chimiques
Objectifs d’apprentissage
- Définir l’enthalpie.
- Exprimer correctement le changement d’enthalpie des réactions chimiques.
- Expliquez comment les changements d’enthalpie sont mesurés expérimentalement.
Maintenant que nous avons montré comment l’énergie, le travail et la chaleur sont liés, nous sommes prêts à considérer les changements énergétiques dans les réactions chimiques. Un concept fondamental est que chaque réaction chimique se produit avec un changement simultané d’énergie. Maintenant, nous devons apprendre à exprimer correctement ces changements d’énergie.
Notre étude des gaz dans le chapitre 6 « Gaz » et notre définition du travail dans la section 7.2 « Travail et chaleur » indiquent que des conditions telles que la pression, le volume et la température affectent le contenu énergétique d’un système. Ce dont nous avons besoin, c’est d’une définition de l’énergie qui tient lorsque certaines de ces conditions sont spécifiées (quelque peu similaire à notre définition de la température et de la pression standard dans notre étude des gaz). Nous définissons le changement d’enthalpiela chaleur d’un processus à pression constante; noté ΔH. (ΔH) comme chaleur d’un processus lorsque la pression est maintenue constante:
ΔH≡qat pression constante
La lettre H signifie « enthalpie », une sorte d’énergie, tandis que le Δ implique un changement de la quantité. Nous serons toujours intéressés par le changement de H, plutôt que par la valeur absolue de H elle-même.
Lorsqu’une réaction chimique se produit, il y a un changement caractéristique de l’enthalpie. Le changement d’enthalpie pour une réaction s’écrit généralement après une équation chimique équilibrée et sur la même droite. Par exemple, lorsque deux moles d’hydrogène réagissent avec une mole d’oxygène pour former deux moles d’eau, le changement d’enthalpie caractéristique est de 570 kJ. Nous écrivons l’équation comme
2H2(g) + O2 (g) → 2H2O (ℓ) ΔH =-570 kJ
Une équation chimique qui inclut un changement d’enthalpie est appelée équation thermochimiqueune équation chimique qui inclut un changement d’enthalpie.. Une équation thermochimique est supposée se référer à l’équation en quantités molaires, ce qui signifie qu’elle doit être interprétée en termes de moles, et non de molécules individuelles.
Exemple 5
Écrire l’équation thermochimique pour la réaction de PCl3(g) avec Cl2(g) pour obtenir PCl5(g), qui a un changement d’enthalpie de -88 kJ.
Solution
L’équation thermochimique est
PCl3(g) + Cl2(g) →PCl5(g) ΔH =-88 kJ
Testez-vous
Écrivez l’équation thermochimique pour la réaction de N2(g) avec O2(g) pour obtenir 2NO(g), qui a un changement d’enthalpie de 181 kJ.
Réponse
N2(g) + O2(g) → 2NO(g) ΔH = 181 kJ
Vous avez peut-être remarqué que le ΔH pour une réaction chimique peut être positif ou négatif. Le nombre est supposé positif s’il n’a pas de signe; un signe + peut être ajouté explicitement pour éviter toute confusion. Une réaction chimique qui a un ΔH positif est dite endothermiqueune réaction chimique qui a un changement positif d’enthalpie., alors qu’une réaction chimique qui a un ΔH négatif est dite réaction chimique exothermique qui a un changement d’enthalpie négatif..
Qu’est-ce que cela signifie si le ΔH d’un processus est positif ? Cela signifie que le système dans lequel se produit la réaction chimique gagne de l’énergie. Si l’on considère l’énergie d’un système comme étant représentée comme une hauteur sur un diagramme d’énergie vertical, le changement d’enthalpie qui accompagne la réaction peut être schématisé comme dans la partie (a) de la Figure 7.3 « Énergie de réaction »: l’énergie des réactifs a une certaine énergie, et le système augmente son énergie au fur et à mesure qu’elle va aux produits. Les produits sont plus élevés sur l’échelle verticale que les réactifs. L’endothermie implique donc que le système gagne ou absorbe de l’énergie.
Une situation inverse existe pour un processus exothermique, comme le montre la partie (b) de la Figure 7.3 « Énergie de réaction ». Si le changement d’enthalpie d’une réaction est négatif, le système perd de l’énergie, de sorte que les produits ont moins d’énergie que les réactifs et que les produits sont plus bas sur l’échelle d’énergie verticale que les réactifs. L’exothermie implique donc que le système perd ou dégage de l’énergie.
Figure 7.3 Énergie de réaction
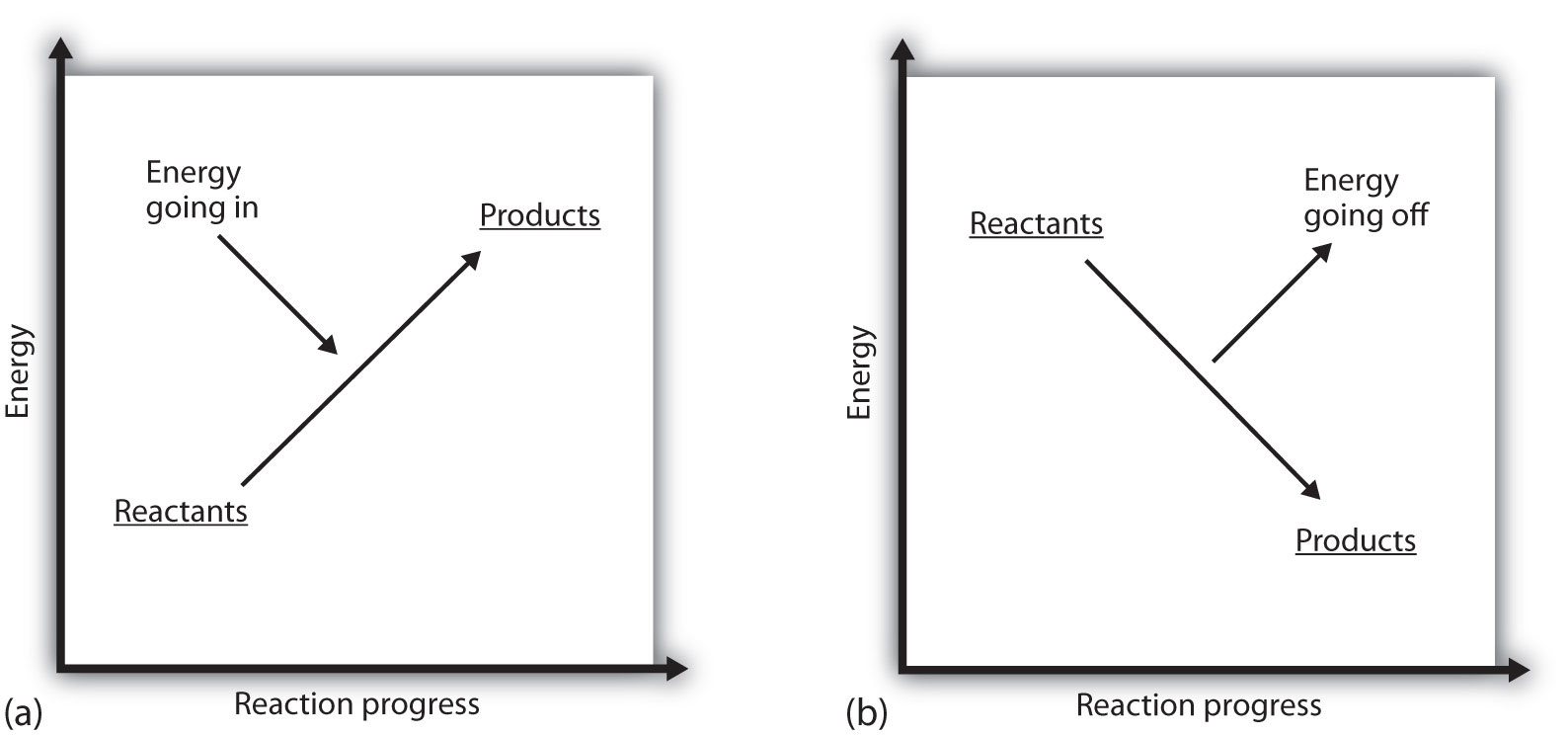
(a)Dans une réaction endothermique, l’énergie du système augmente (c’est-à-dire se déplace plus haut sur l’échelle verticale de l’énergie). (b) Dans une réaction exothermique, l’énergie du système diminue (c’est-à-dire se déplace plus bas sur l’échelle verticale de l’énergie).
Exemple 6
Considérons cette équation thermochimique.
2CO(g) + O2(g) → 2CO2(g) ΔH =-565 kJ
Est-ce exothermique ou endothermique? Quelle quantité d’énergie est dégagée ou absorbée?
Solution
Par définition, une réaction chimique qui a un ΔH négatif est exothermique, ce qui signifie que cette quantité d’énergie — dans ce cas, 565 kJ — est dégagée par la réaction.
Testez-vous
Considérez cette équation thermochimique.
CO2(g) + H2(g) → CO(g) + H2O(g) ΔH = 42 kJ
Est-ce exothermique ou endothermique? Quelle quantité d’énergie est dégagée ou absorbée?
Réponse
Endothermique ; 42 kJ sont absorbés.
Comment les valeurs de ΔH sont-elles mesurées expérimentalement ? En fait, ΔH n’est pas mesuré ; q est mesuré. Mais les mesures sont effectuées dans des conditions de pression constante, donc ΔH est égal au q mesuré.
Expérimentalement, q est mesuré en tirant parti de l’équation
q=mcΔT
Nous mesurons la masse des produits chimiques dans un système. Ensuite, nous laissons la réaction chimique se produire et mesurons le changement de température (ΔT) du système. Si nous connaissons la chaleur spécifique des matériaux dans le système (typiquement, nous le faisons), nous pouvons calculer q. Cette valeur de q est numériquement égale au ΔH du processus, que nous pouvons mettre à l’échelle jusqu’à une échelle molaire. Le conteneur dans lequel se trouve le système est généralement isolé, de sorte que tout changement d’énergie entre dans la modification de la température du système, plutôt que d’être échappé du système. Le récipient est appelé récipient de calorimètre utilisé pour mesurer la chaleur d’une réaction chimique. et le processus de mesure des changements d’enthalpie est appelé calorimétrele processus de mesure des changements d’enthalpie pour les réactions chimiques..
Figure 7.4 Calorimètres
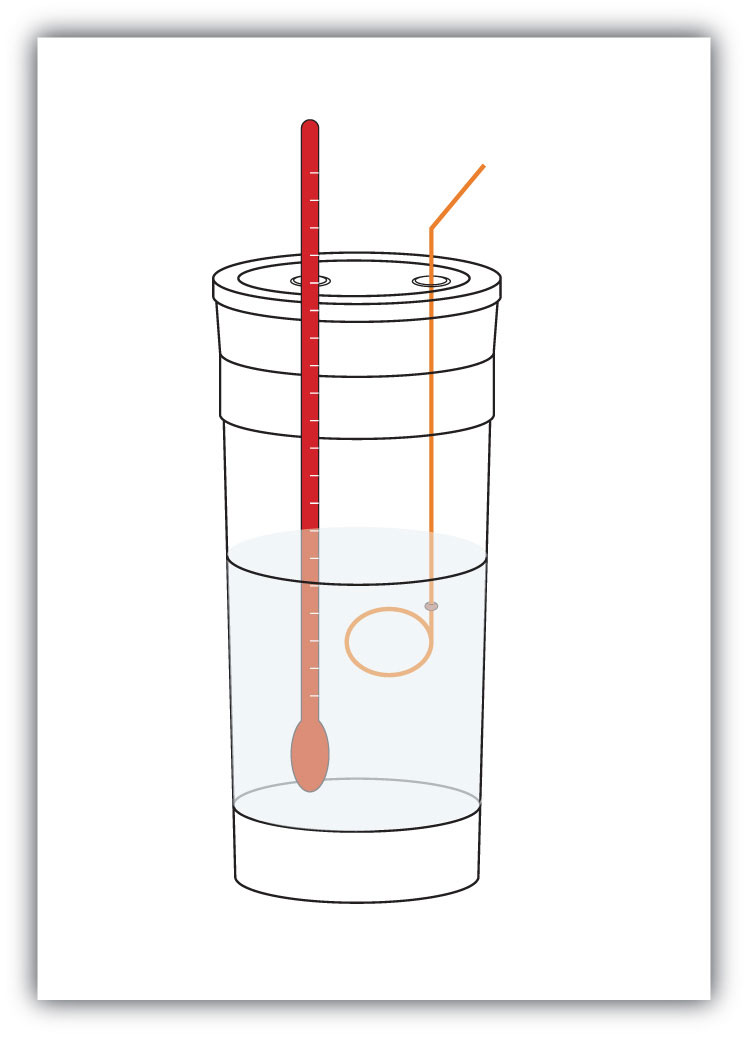
Un calorimètre simple peut être construit à partir de tasses à café en mousse imbriquées, d’un couvercle, d’un thermomètre et d’un agitateur.
Par example, supposons que 4,0 g de NaOH, soit 0,10 mole de NaOH, soient dissous pour former 100,0 mL de solution aqueuse, tandis que 3,65 g de HCl, soit 0,10 mole de HCl, soient dissous pour former 100,0 mL supplémentaires de solution aqueuse. Les deux solutions sont mélangées dans un calorimètre isolé, un thermomètre est inséré et le calorimètre est recouvert (voir Figure 7.4 « Calorimètres » pour un exemple de configuration). Le thermomètre mesure le changement de température lorsque la réaction chimique suivante se produit:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (ℓ)
Un observateur note que la température augmente de 22,4 ° C à 29,1 ° C. En supposant que les capacités thermiques et les densités des solutions sont les mêmes que celles de l’eau pure, nous avons maintenant les informations dont nous avons besoin pour déterminer le changement d’enthalpie de la réaction chimique. La quantité totale de solution est de 200,0 mL, et avec une densité de 1,00 g / mL, on a donc 200,0 g de solution. En utilisant l’équation pour q, on substitue à nos mesures expérimentales et à la chaleur spécifique de l’eau (Tableau 7.1 « Chaleurs spécifiques de Diverses Substances ») :
q = (200,0 g) (4,184 J g⋅°C) (6,7 °C)
En résolvant pour q, on obtient
q= 5 600 J≡ΔH pour la réaction
La chaleur q est égale au ΔH pour la réaction car la réaction chimique se produit à pression constante. Cependant, la réaction dégage cette quantité d’énergie, de sorte que le signe réel sur ΔH est négatif:
ΔH =-5 600 J pour la réaction
Ainsi, nous avons l’équation thermochimique suivante pour la réaction chimique qui s’est produite dans le calorimètre:
110 NaOH (aq) + 110 HCl (aq) → 110 NaCl (aq) + 110 H2O (ℓ) ΔH =-5 600 J
Les coefficients 1/10 sont présents pour nous rappeler que nous avons commencé avec un dixième de mole de chaque réactif, donc nous avons faites un dixième d’une mole de chaque produit. En règle générale, cependant, nous rapportons des équations thermochimiques en termes de moles, et non un dixième de mole. Pour passer à des quantités molaires, il faut multiplier les coefficients par 10. Cependant, lorsque nous faisons cela, nous obtenons 10 fois plus d’énergie. Ainsi, nous avons
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O (ℓ) ΔH =-56 000 J
Le ΔH peut être converti en unités kJ, donc notre équation thermochimique finale est
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH =-56 kJ
Nous venons de prendre nos données expérimentales à partir de la calorimétrie et de déterminer changement d’enthalpie d’une réaction chimique. Des mesures similaires sur d’autres réactions chimiques peuvent déterminer les valeurs de ΔH de toute réaction chimique que vous souhaitez étudier.
Exemple 7
Une solution de 100 mL de 0.25 moles de Ca2+ (aq) ont été mélangées à 0,50 mole d’ions F− (aq), et CaF2 a été précipité :
Ca2+ (aq) + 2F−(aq) → CaF2(s)
La température de la solution a augmenté de 10,5°C. Quel était le changement d’enthalpie pour la réaction chimique ? Quel a été le changement d’enthalpie pour la production de 1 mole de CaF2? Supposons que la solution ait la même densité et la même chaleur spécifique que l’eau.
Solution
Comme on nous donne ΔT directement, on peut déterminer la chaleur de la réaction, qui est égale à ΔH :
q = (100 g) (4,184 J g⋅°C) (10.5°C)
En résolvant pour q, on obtient
q = 4400 J
Par conséquent, ΔH =-4400 J.
Selon la stoechiométrie de la réaction, exactement 0,25 mole de CaF2 se formera, donc cette quantité de chaleur est pour 0,25 mole. Pour 1 mole de CaF2, il faut augmenter la chaleur d’un facteur quatre :
q= 4 400 J × 4 = 17 600 J pour 1 mole de CaF2
Sur une base molaire, le changement d’enthalpie est
ΔH =-17 600 J =-17,6 kJ
Testez-vous
Dans un calorimètre à pression constante, 0,10 mole de CH4 (g) et 0,20 on fait réagir des moles de O 2(g).
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ)
La réaction chauffe 750.0 g de H2O à 28,4°C. Quel est ΔH pour la réaction à l’échelle molaire ?
Réponse
-891 kJ
Points à retenir
- Chaque réaction chimique se produit avec un changement simultané d’énergie.
- Le changement d’enthalpie est égal à la chaleur à pression constante.
- Les changements d’enthalpie peuvent être exprimés en utilisant des équations thermochimiques.
- Les changements d’enthalpie sont mesurés par calorimétrie.
Exercices
-
Dans quelles circonstances q et ΔH sont-ils identiques?
-
Dans quelles circonstances q et ΔH sont-ils différents ?
-
L’hydrogène gazeux et le chlore gazeux réagissent pour produire du chlorure d’hydrogène gazeux avec un changement d’enthalpie d’accompagnement de -184 kJ. Écrivez une équation thermochimique correctement équilibrée pour ce processus.
-
Le propane (C3H8) réagit avec l’oxygène gazeux élémentaire pour produire du dioxyde de carbone et de l’eau liquide avec un changement d’enthalpie associé de -2 220 kJ. Écrivez une équation thermochimique correctement équilibrée pour ce processus.
-
L’azote gazeux réagit avec l’oxygène gazeux pour produire du NO (g) tout en absorbant 180 kJ. Écrivez une équation thermochimique correctement équilibrée pour ce processus.
-
Le sodium solide réagit avec le chlore gazeux pour produire du chlorure de sodium solide tout en dégageant 772 kJ. Écrivez une équation thermochimique correctement équilibrée pour ce processus.
-
L’hydrogène gazeux et le chlore gazeux réagissent pour produire du chlorure d’hydrogène gazeux avec un changement d’enthalpie d’accompagnement de -184 kJ. Ce processus est-il endothermique ou exothermique?
-
Le propane (C3H8) réagit avec l’oxygène gazeux élémentaire pour produire du dioxyde de carbone tout en dégageant 2 220 kJ d’énergie. Ce processus est-il endothermique ou exothermique?
-
L’azote gazeux réagit avec l’oxygène gazeux pour produire du NO (g) tout en absorbant 180 kJ. Ce processus est-il exothermique ou endothermique?
-
Le métal sodique peut réagir avec l’azote pour former de l’azoture de sodium (NaN3) avec un ΔH de 21,72 kJ. Ce processus est-il exothermique ou endothermique?
-
Dessinez un diagramme de niveau d’énergie pour la réaction chimique de l’exercice 8. (Voir la figure 7.3 « Énergie de réaction » pour un exemple.)
-
Dessinez un diagramme de niveau d’énergie pour la réaction chimique de l’exercice 9. (Voir la figure 7.3 « Énergie de réaction » pour un exemple.)
-
Dans une solution de 250 mL, on combine 0,25 mole de KOH (aq) et 0,25 mole de HNO3 (aq). La température de la solution passe de 22,5 ° C à 35,9 ° C. Supposons que la solution ait la même densité et la même capacité calorifique que l’eau. Quelle est la chaleur de la réaction et quel est le ΔH de la réaction sur une base molaire?
-
Dans une solution de 600 ml, 0.50 moles de Ca(OH)2 (aq) et 0,50 mole de H2SO4 (aq) sont combinées. La température de la solution augmente de 22,3°C. Quelle est la chaleur de la réaction et quel est le ΔH de la réaction sur une base molaire ? Supposons que la solution ait la même densité et la même capacité calorifique que l’eau.
-
Pour réchauffer 400,0 g de H2O, on brûle 0,050 mole d’éthanol (C2H5OH). L’eau se réchauffe de 24,6°C à 65,6°C. Quelle est la chaleur de la réaction et quel est le ΔH de la réaction sur une base molaire ?
-
Pour réchauffer 100,0 g de H2O, on brûle 0,066 mole de cire d’abeille. L’eau se réchauffe de 21,4°C à 25,5°C. Quelle est la chaleur de la réaction et quel est le ΔH de la réaction sur une base molaire ?
Réponses
-
dans des conditions de pression constante
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
exothermique
-
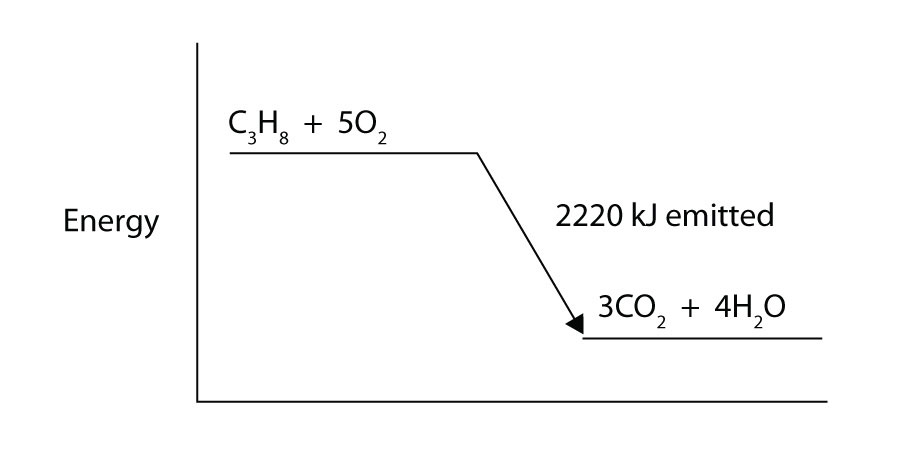
-
chaleur de réaction = -14,0 kJ; ΔH =-56,0 kJ/mol de réactifs
-
chaleur de réaction = -68,6 kJ; ΔH = -1 370 kJ/mole d’éthanol
endothermique