シェル内の電子
![]()
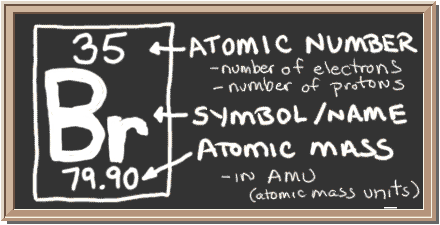
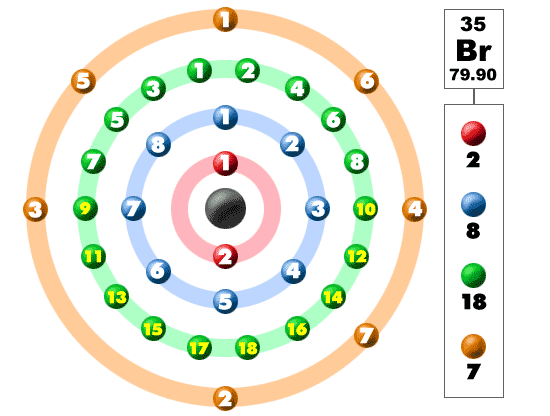
黒板をチェックしてください。 左側のボックスには、1つの要素について知る必要があるすべての情報があります。 それはあなたに1つの原子の質量、内部に何個あるのか、そして周期表のどこに置くべきかを示します。
今、私たちは、要素のテーブル内の第四の期間/行で作業しています。 中性原子内の電子の数を知る簡単な方法があるかもしれませんが、それらの電子の配置はもう少し複雑になります。 周期4の基本的な要素(表の左右)の電子の配置と、遷移要素のより複雑な配置(行の中央)を見てみましょう。 これはあなたの頭の上に少しだと思う場合は、戻って、もう少し単純な組織を持っている要素1-18を見てください。
下の写真を見てください。 これらの色のボールのそれぞれは電子です。 原子では、電子は中心の周りを回転し、核とも呼ばれます。 電子は別々の殻/軌道にあるのが好きです。 あなたは原子構造についての詳細を学ぶように、あなたは電子が核の周りの定義された領域に滞在していないことを学びます。 それらは球およびダンベルのような形を含んでいる異なった形を持つことができる雲にあります。 あなたが私たちの内訳を見るとき、ここに示されているように、電子は常にきれいな順序ではないことを覚えておいてください。
臭素は、元素のハロゲンファミリーのメンバーです。 その仲間には、フッ素、塩素、ヨウ素が含まれます。 他のハロゲンと同様に、臭素はその外殻に7つの電子を持ち、非常に反応性があります。 アルカリ金属を含む多くの塩化合物に臭素があります。 臭化ナトリウムは海水中に見出される化合物である。 すべての反応性元素と同様に、臭素は自然界では決して単独では見られません。 それは常に他の要素を持つ化合物の一部です。