2.1: Evolusjon Av Atomteori
Atomteori etter Det Nittende Århundre
hvis saken var sammensatt av atomer, hva var atomer sammensatt av? Var de de minste partiklene, eller var det noe mindre? På slutten av 1800-tallet undersøkte en rekke forskere interessert i spørsmål som disse de elektriske utladningene som kunne produseres i lavtrykksgasser, med den mest betydningsfulle oppdagelsen gjort av engelsk fysiker Jj Thomson ved hjelp av et katodestrålerør. Dette apparatet besto av et forseglet glassrør hvorfra nesten all luft var fjernet; røret inneholdt to metallelektroder. Når høy spenning ble påført over elektrodene, oppstod en synlig stråle kalt en katodestråle mellom dem. Denne strålen ble avbøyet mot positiv ladning og bort fra negativ ladning, og ble produsert på samme måte med identiske egenskaper når forskjellige metaller ble brukt til elektrodene. I lignende eksperimenter ble strålen samtidig avbøyet av et påført magnetfelt, og målinger av omfanget av avbøyning og magnetfeltstyrken tillot Thomson å beregne forholdet mellom ladning og masse for katodestrålepartiklene. Resultatene av disse målingene indikerte at disse partiklene var mye lettere enn atomer(Figur \(\PageIndex{1}\)).
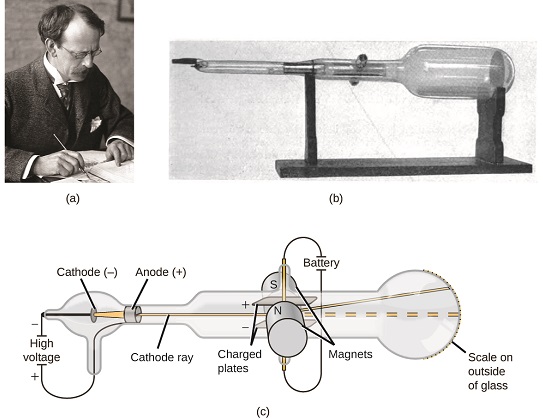
Figur \(\PageIndex{5}\): (a) Jj Thomson produserte en synlig stråle i et katodestrålerør. (B) dette er et tidlig katodestrålerør, oppfunnet I 1897 Av Ferdinand Braun. (c) i katodestrålen kommer strålen (vist i gul) fra katoden og akselereres forbi anoden mot en fluorescerende skala på enden av røret. Samtidige avbøyninger av anvendte elektriske og magnetiske felt tillot Thomson å beregne masse-til-ladningsforholdet mellom partiklene som komponerer katodestrålen. (kreditt a: modifikasjon Av Arbeid Av Nobelstiftelsen; kreditt b: modifikasjon av arbeid av Eugen Nesper; kreditt c: modifikasjon av arbeid av «Kurzon» /Wikimedia Commons).
Basert på hans observasjoner, her er Hva Thomson foreslått og hvorfor: partiklene er tiltrukket av positive (+) kostnader og frastøtt av negative (−) kostnader, så de må være negativt ladet (som kostnader frastøte og i motsetning til kostnader tiltrekke); de er mindre massive enn atomer og utvisket, uavhengig av kildematerialet, så de må være grunnleggende, subatomære bestanddeler av alle atomer. Selv om det var kontroversielt på den tiden, Ble Thomsons ide gradvis akseptert, og hans katodestrålepartikkel er det vi nå kaller et elektron, en negativt ladet, subatomær partikkel med en masse mer enn tusen ganger mindre enn et atom. Begrepet «elektron» ble laget i 1891 Av Irsk fysiker George Stoney, fra » electric ion.»
i 1909 ble mer informasjon om elektronen avdekket av Amerikansk fysiker Robert A. Millikan via hans» oljedråpe » eksperimenter. Millikan skapte mikroskopiske oljedråper, som kunne bli elektrisk ladet av friksjon som de dannet eller Ved Hjelp Av Røntgenstråler. Disse dråpene falt først på grunn av tyngdekraften, men deres nedadgående fremgang kunne bli redusert eller til og med reversert av et elektrisk felt lavere i apparatet. Ved å justere den elektriske feltstyrken og gjøre forsiktige målinger og hensiktsmessige beregninger, Kunne Millikan bestemme ladningen på individuelle dråper (Figur \(\PageIndex{2}\)).
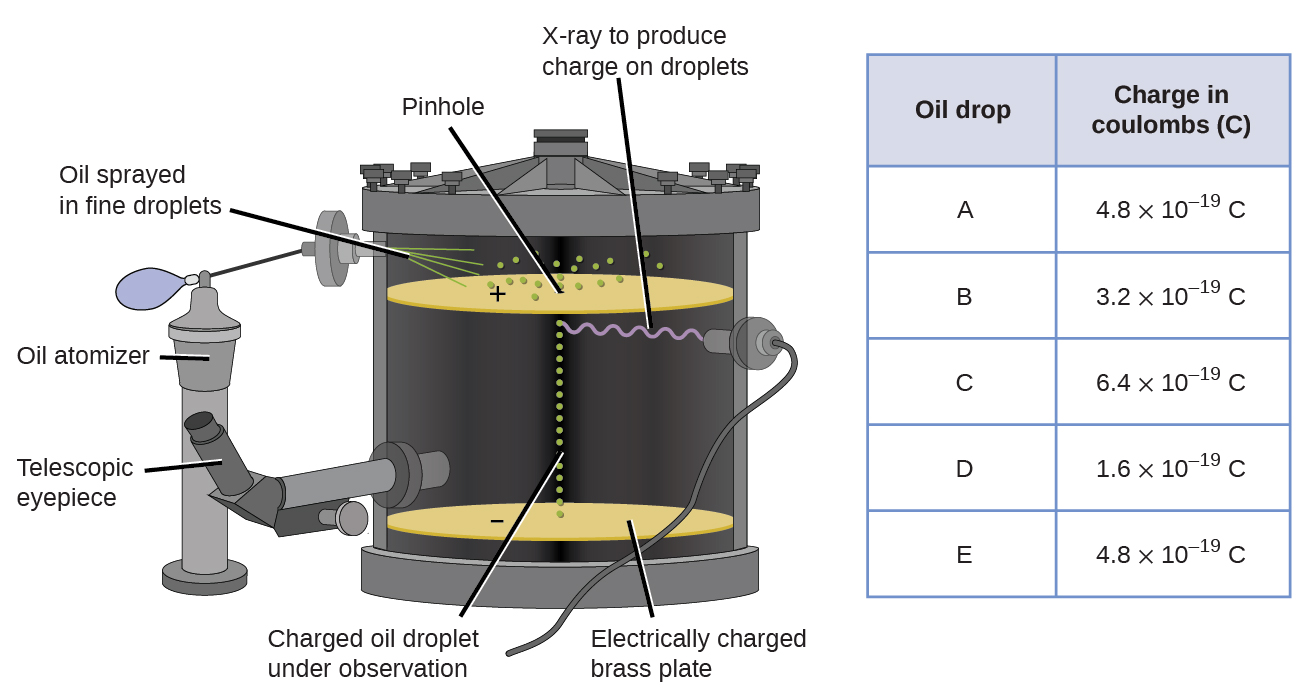
Figur \(\PageIndex{6}\): Millikans eksperiment målte ladningen av individuelle oljedråper. Tabelldataene er eksempler på noen få mulige verdier.
Ser Du på ladningsdataene Som Millikan samlet, kan du ha innsett at ladningen av en oljedråpe alltid er et multiplum av en bestemt ladning, 1.6 \(\times\) 10-19 C. Millikan konkluderte med at denne verdien derfor må være en grunnleggende ladning-ladningen til en enkelt elektron – med sine målte ladninger på grunn av et overskudd av en elektron (1 ganger 1.6 \(\ganger\) 10-19 C), to elektroner (2 ganger 1.6 \(\ganger\) 10-19 C), tre elektroner (3 ganger 1.6 \(\ganger\) 10-19 C), og så videre, på en gitt oljedråpe. Siden ladningen av et elektron nå var kjent på Grunn Av Millikans forskning, og forholdet mellom ladning og masse var allerede kjent på Grunn Av Thomsons forskning (1.759 \ (\times\) 1011 C / kg), krevde det bare en enkel beregning for å bestemme massen av elektronen også.
\
Forskere hadde nå fastslått at atomet ikke var udelelig som Dalton hadde trodd, og På grunn Av Thomson, Millikan og andre, var ladningen og massen av de negative, subatomære partiklene—elektronene—kjent. Imidlertid var den positivt ladede delen av et atom ennå ikke godt forstått. I 1904 foreslo Thomson» plum pudding » – modellen av atomer, som beskrev en positivt ladet masse med like mye negativ ladning i form av elektroner innebygd i den, siden alle atomer er elektrisk nøytrale. En konkurrerende modell hadde blitt foreslått i 1903 Av Hantaro Nagaoka, som postulerte Et Saturn-lignende atom, bestående av en positivt ladet sfære omgitt Av en halo av elektroner(Figur \ (\PageIndex{3}\)).
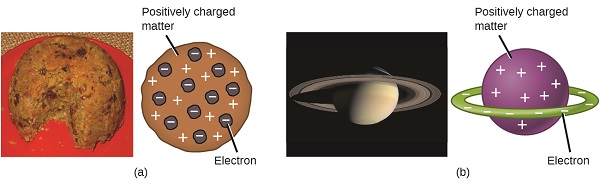
Figur \(\PageIndex{7}\): (a) Thomson foreslo at atomer lignet plommepudding, en engelsk dessert bestående av fuktig kake med innebygde rosiner («plommer»). (B) Nagaoka foreslo at atomer lignet planeten Saturn, med en ring av elektroner rundt en positiv » planet.(kreditt a: modifikasjon av arbeid av «Man vyi» / Wikimedia Commons; kreditt b: modifikasjon av arbeid av «NASA» /Wikimedia Commons).
Den neste store utviklingen i forståelsen av atomet kom fra Ernest Rutherford, en fysiker Fra New Zealand som i stor grad tilbrakte sin vitenskapelige karriere I Canada og England. Han utførte en rekke eksperimenter ved hjelp av en stråle av høyhastighets, positivt ladede alfa partikler (α partikler) som ble produsert ved radioaktiv nedbrytning av radium; α partikler består av to protoner og to nøytroner (du vil lære mer om radioaktiv nedbrytning i kapitlet om kjernefysisk kjemi). Rutherford Og hans kolleger Hans Geiger (senere kjent For Geiger-telleren) og Ernest Marsden rettet mot en stråle av α partikler, hvor kilden var innebygd i en blyblokk for å absorbere det meste av strålingen, ved et veldig tynt stykke gullfolie og undersøkte den resulterende spredning av de α partiklene ved hjelp av en lysende skjerm som glødet kort der rammet av en α partikkel.
hva oppdaget de? De fleste partikler passerte rett gjennom folien uten å bli avbøyet i det hele tatt. Noen ble imidlertid viderekoblet litt, og et svært lite antall ble avbøyet nesten rett tilbake mot kilden(Figur \(\PageIndex{4}\)). Rutherford beskrev å finne disse resultatene: «Det var ganske den mest utrolige hendelsen som noen gang har skjedd med meg i mitt liv . Det var nesten like utrolig som om du sparket et 15-tommers skall på et stykke vevpapir og det kom tilbake og slo deg»1 (s. 68).
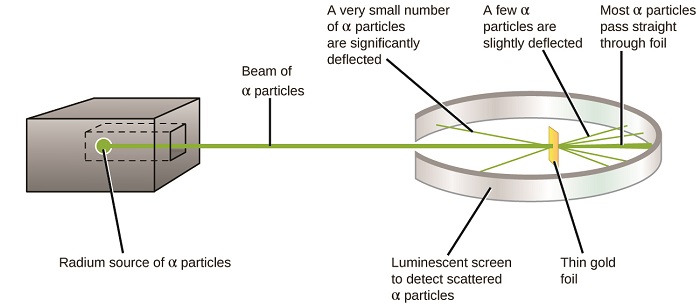
Figur \(\PageIndex{8}\): Geiger og Rutherford avfyrte α partikler på et stykke gullfolie og oppdaget hvor disse partiklene gikk, som vist i dette skjematiske diagrammet av eksperimentet. De fleste partiklene passerte rett gjennom folien, men noen få ble avbøyet litt og et svært lite antall ble signifikant avbøyet.
Her er Hva Rutherford utledet: fordi de fleste av de raske α partiklene passerte gjennom gullatomene ubevektede, må de ha reist gjennom i hovedsak tomt rom inne i atomet. Alfa partikler er positivt ladet, så avbøyninger oppstod da de opplevde en annen positiv ladning (som ladninger avstøter hverandre). Siden lignende ladninger avstøter hverandre, må de få positivt ladede partiklene som forandret baner plutselig ha rammet, eller nærmet seg, en annen kropp som også hadde en svært konsentrert, positiv ladning. Siden avbøyningene skjedde en liten brøkdel av tiden, okkuperte denne ladningen bare en liten del av plassen i gullfolien. Ved å analysere en rekke slike eksperimenter i detalj, trakk Rutherford to konklusjoner:
- volumet okkupert av et atom må bestå av en stor mengde tomt rom.
- en liten, relativt tung, positivt ladet kropp, kjernen, må være i midten av hvert atom.
denne analysen førte Rutherford til å foreslå en modell der et atom består av en veldig liten, positivt ladet kjerne, hvor det meste av atomets masse er konsentrert, omgitt av de negativt ladede elektronene, slik at atomet er elektrisk nøytralt (Figur \(\PageIndex{5}\)).
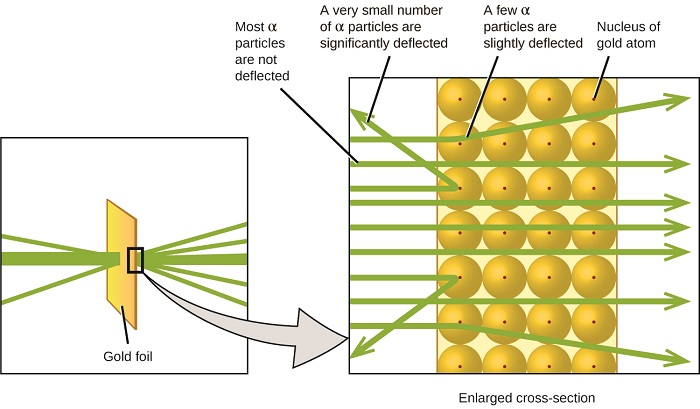
Figur \(\PageIndex{9}\): de α partiklene avbøyes bare når de kolliderer med eller passerer nær den mye tyngre, positivt ladede gullkjernen. Fordi kjernen er svært liten i forhold til størrelsen på et atom, blir svært få α partikler avbøyet. De fleste passerer gjennom den relativt store regionen okkupert av elektroner, som er for lette til å avlede de raskt bevegelige partiklene.Etter mange flere eksperimenter oppdaget Rutherford også at kjernene til andre elementer inneholder hydrogenkjernen som en «byggestein», og han kalte denne mer grunnleggende partikkelen protonen, den positivt ladede, subatomære partikkelen som finnes i kjernen. Med ett tillegg, som du vil lære neste, er denne atommodellen av atomet, foreslått over et århundre siden, fortsatt brukt i dag.
Et annet viktig funn var oppdagelsen av isotoper. På begynnelsen av 1900-tallet identifiserte forskere flere stoffer som syntes å være nye elementer, isolere dem fra radioaktive malm. For eksempel ble et «nytt element» produsert av radioaktivt henfall av thorium opprinnelig gitt navnet mesothorium. Imidlertid viste en mer detaljert analyse at mesothorium var kjemisk identisk med radium (et annet forfallsprodukt), til tross for at det hadde en annen atommasse. Dette resultatet, sammen med lignende funn for andre elementer, førte den engelske kjemikeren Frederick Soddy til å innse at et element kunne ha typer atomer med forskjellige masser som var kjemisk uutslettelige. Disse forskjellige typene kalles isotoper-atomer av samme element som varierer i masse. Soddy ble tildelt Nobelprisen I Kjemi i 1921 for denne oppdagelsen.
ett puslespill ble igjen: kjernen var kjent for å inneholde nesten all massen av et atom, med antall protoner som bare gir halvparten eller mindre av den massen. Ulike forslag ble gjort for å forklare hva som utgjorde gjenværende masse, inkludert eksistensen av nøytrale partikler i kjernen. Som du kanskje forventer, er det svært utfordrende å oppdage uladede partikler, Og Det Var ikke Før 1932 At James Chadwick fant bevis på nøytroner, uladede, subatomære partikler med en masse omtrent det samme som protoner. Eksistensen av nøytronet forklarte også isotoper: de varierer i masse fordi de har forskjellige antall nøytroner, men de er kjemisk identiske fordi de har samme antall protoner. Dette vil bli forklart mer detaljert senere i denne enheten.