5.3: Lewis Diagrammer
Lewis brukte enkle diagrammer (nå Kalt Lewis diagrammer) for å holde oversikt over hvor mange elektroner som var tilstede i det ytre, eller valens, skallet av et gitt atom. Kjernen til atomet, dvs. kjernen sammen med de indre elektronene, representeres av det kjemiske symbolet, og bare valenselektronene trekkes som prikker rundt det kjemiske symbolet. Dermed kan de tre atomer vist i Figur 1 Fra Elektroner og Valens representeres av Følgende Lewis-diagrammer:
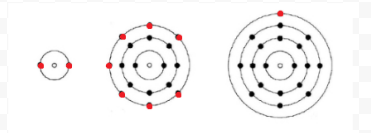

hvis atomet er et edelt gassatom, er to alternative prosedyrer mulige. Enten kan vi vurdere atomet å ha null valenselektroner, eller vi kan betrakte det ytre fylte skallet som valensskallet. De tre første edelgassene kan således skrives som:
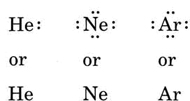
Eksempel \(\PageIndex{1}\): Lewis Strukturer
Tegn Lewis-diagrammer For et atom av hvert av følgende elementer: Li, N, F, Na
Løsning
vi finner fra det periodiske bordet inne i frontdekselet At Li har et atomnummer på 3. Den inneholder dermed tre elektroner, en mer Enn edelgassen Han. Dette betyr at det ytre eller valensskallet bare inneholder ett elektron, Og Lewis-diagrammet er
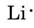
Etter samme resonnement Har N syv elektroner, fem mer Enn Han, Mens F har ni elektroner, syv mer Enn Han, og gir
![]()
Na Har ni flere elektroner Enn Han, men åtte av dem er i kjernen, som tilsvarer de åtte elektronene i Det ytre skallet Av Ne. Siden Na Bare har 1 mer elektron Enn Ne, Er Lewis-diagrammet
![]()
Legg merke til Fra det foregående eksempel At Lewis diagrammer av alkalimetallene er identiske med unntak av deres kjemiske symboler. Dette stemmer fint med den svært liknende kjemiske oppførselen til alkalimetallene. På Samme måte Ser Lewis-diagrammer for alle elementer i andre grupper, for eksempel alkaliske jordarter eller halogener, det samme ut.
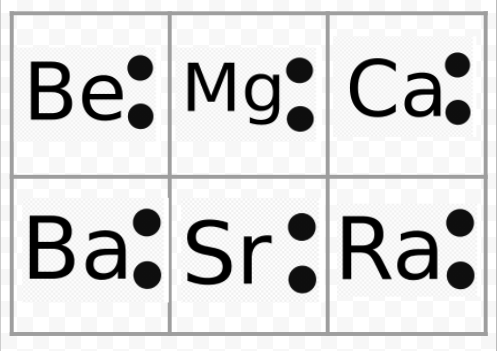
Lewis-diagrammene kan også brukes til å forutsi valensene til elementene. Lewis foreslo at antall valenser av et atom var lik antall elektroner i valensskallet eller til antall elektroner som måtte legges til valensskallet for å oppnå den elektroniske skallstrukturen til neste edelgass. Som et eksempel På denne ideen, vurdere elementene Være Og O. Deres Lewis diagrammer og de av edelgassene Han og Ne er

Sammenligning Med Han ser vi at den tidligere har to elektroner og derfor bør ha en valens på 2. Elementet O kan forventes å ha en valens på 6 eller en valens på 2 siden den har seks valenselektroner-to mindre Enn Ne. Ved hjelp av valensregler utviklet på denne måten, Var Lewis i stand til å redegjøre for den vanlige økningen og reduksjonen i abonnementene av forbindelsene i tabellen som finnes I Valensavsnittet, og gjengitt her. I tillegg var han i stand til å utgjøre mer enn 50 prosent av formlene i tabellen. (De som er enige med hans ideer er skyggelagt i fargen i tabellen. Du kan ønske å referere til den tabellen nå og verifisere at Noen av de angitte formlene følger Lewis ‘ regler. Lewis ‘ suksess i denne forbindelse ga en klar indikasjon på at elektroner var den viktigste faktoren for å holde atomer sammen når molekyler dannes.Til tross for disse suksessene er Det også vanskeligheter Å finne I Lewis ‘ teorier, spesielt for elementer utover kalsium i periodisk tabell. Elementet Br (Z = 35) har for eksempel 17 flere elektroner enn edelgassen Ar (Z = 18). Dette fører oss til å konkludere med At Br har 17 valenselektroner, noe som gjør det vanskelig å forklare hvorfor Br ligner Cl Og F så tett, selv om disse to atomene bare har syv valenselektroner.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Han er en av de eldste i Verden, Og er en av de mest kjente i Verden.