Entalpi og Kjemiske Reaksjoner
7,3 Entalpi og Kjemiske Reaksjoner
Læringsmål
- Definer entalpi.
- uttrykker riktig entalpiendringen av kjemiske reaksjoner.
- Forklar hvordan entalpiendringer måles eksperimentelt.
Nå som vi har vist hvordan energi, arbeid og varme er relatert, er vi klare til å vurdere energiendringer i kjemiske reaksjoner. Et grunnleggende konsept er at hver kjemisk reaksjon skjer med en samtidig endring i energi. Nå må vi lære å riktig uttrykke disse energiendringene.vår studie av gasser I Kapittel 6 «Gasser» og vår definisjon av arbeid I Avsnitt 7.2 «Arbeid og Varme» indikerer at forhold som trykk, volum og temperatur påvirker energiinnholdet i et system. Det vi trenger er en definisjon av energi som holder når noen av disse forholdene er spesifisert (noe som ligner vår definisjon av standard temperatur og trykk i vår studie av gasser). Vi definerer entalpi endringvarmen av en prosess ved konstant trykk; betegnet Δ. (Δ) som varmen i en prosess når trykket holdes konstant:
ΔH≡qat konstant trykk
bokstaven H står for «entalpi», en slags energi, mens Δ innebærer en endring i mengden. Vi vil alltid være interessert I endringen I H, i stedet for absoluttverdien Av H selv.
når en kjemisk reaksjon oppstår, er det en karakteristisk forandring i entalpi. Entalpiendringen for en reaksjon skrives vanligvis etter en balansert kjemisk ligning og på samme linje. For eksempel, når to mol hydrogen reagerer med en mol oksygen for å lage to mol vann, er den karakteristiske entalpyendringen 570 kJ. Vi skriver ligningen som
2h2 (g) + O2 (g) → 2h2o (ℓ) Δ = -570 kJ
en kjemisk ligning som inkluderer en entalpi endring kalles en termokjemisk equationen kjemisk ligning som inkluderer en entalpi endring.. En termokjemisk ligning antas å referere til ligningen i molare mengder, noe som betyr at den må tolkes i form av mol, ikke individuelle molekyler.
Eksempel 5
Skriv den termokjemiske ligningen for Reaksjonen Av PCl3(g) Med Cl2(g) for å lage PCl5 (g), som har en entalpi endring på -88 kJ.
Løsning
den termokjemiske ligningen er
PCl3(g) + Cl2(g) → PCl5(g) Δ = -88 kJ
Test Deg selv
Skriv den termokjemiske ligningen for reaksjonen Av N2(g) Med O2(g) for Å gjøre 2NO(g), som har en entalpi endring på 181 kJ.
Svar
N2 (g) + O2 (g) → 2no (g) Δ = 181 kJ
DU har kanskje lagt merke til AT Δ for en kjemisk reaksjon kan være positiv eller negativ. Tallet antas å være positivt hvis det ikke har noe tegn; et + tegn kan legges eksplisitt for å unngå forvirring. En kjemisk reaksjon som har en positiv Δ sies å være endoterm en kjemisk reaksjon som har en positiv endring i entalpi., mens en kjemisk reaksjon som har en negativ Δ sies å være eksoterm kjemisk reaksjon som har en negativ endring i entalpi..
Hva betyr det hvis EN PROSESS ER POSITIV? Det betyr at systemet der den kjemiske reaksjonen oppstår, får energi. Hvis man vurderer energien til et system som representert som en høyde på et vertikalt energiplot, kan entalpi-endringen som følger med reaksjonen diagrammeres som i del (a) I Figur 7.3 «Reaksjonsenergi»: energien til reaktantene har litt energi, og systemet øker sin energi når det går til produkter. Produktene er høyere på vertikal skala enn reaktantene. Endoterm innebærer da at systemet får eller absorberer energi.En motsatt situasjon eksisterer for en eksoterm prosess, som vist i del (b) I Figur 7.3 «Reaksjonsenergi». Hvis entalpiendringen av en reaksjon er negativ, mister systemet energi, slik at produktene har mindre energi enn reaktantene, og produktene er lavere på vertikal energiskala enn reaktantene er. Eksoterm betyr at systemet mister eller avgir energi.
Figur 7.3 Reaksjonsenergi
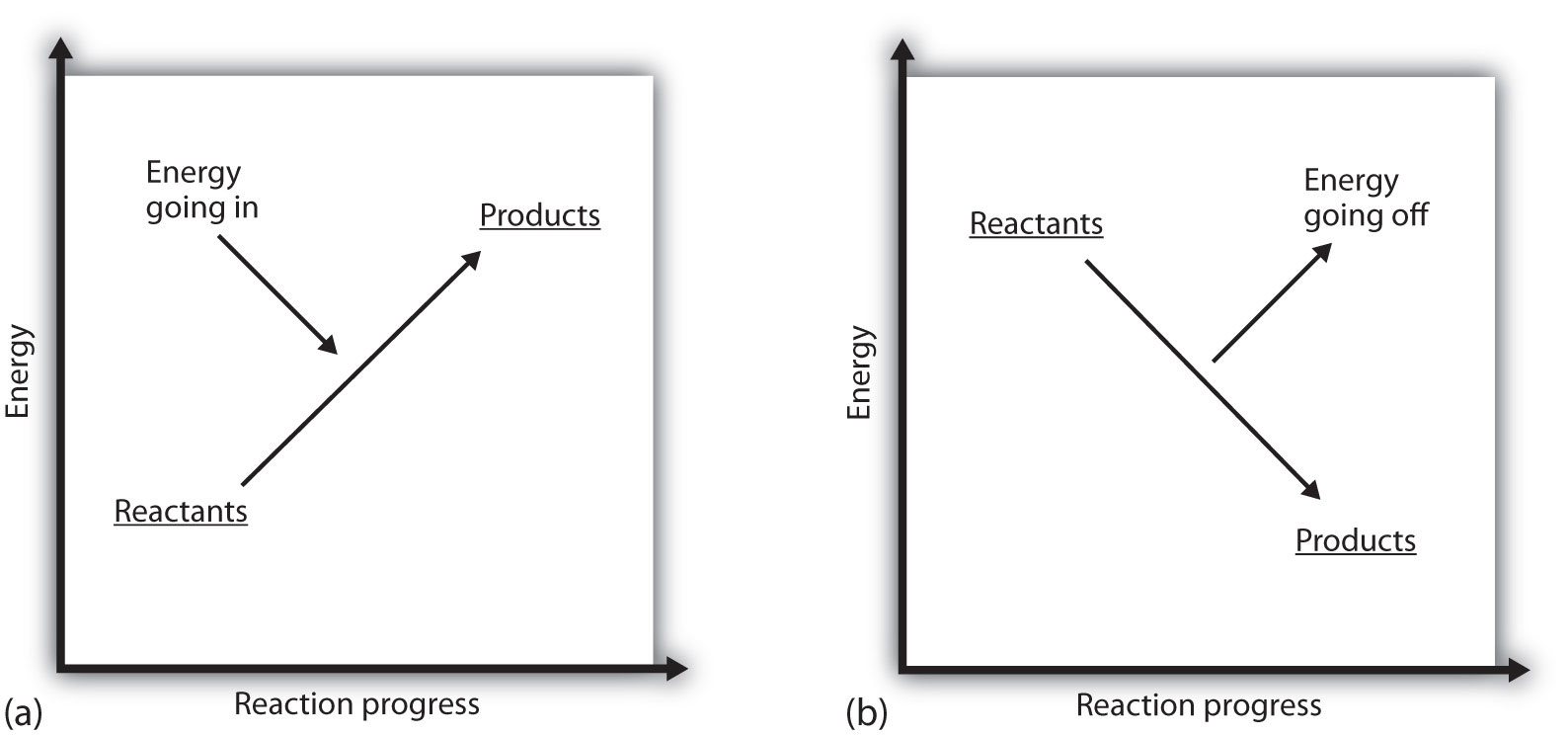
(a) i en endoterm reaksjon øker energien i systemet (dvs. beveger seg høyere på den vertikale skalaen av energi). (b) i en eksoterm reaksjon reduseres energien til systemet (dvs. beveger seg lavere på den vertikale skalaen av energi).
Eksempel 6
Vurder denne termokjemiske ligningen.
2co(g) + O2(g) → 2co2 (g) Δ = -565 kJ
er det eksoterm eller endoterm? Hvor mye energi er gitt av eller absorbert?
Løsning
per definisjon er en kjemisk reaksjon som har en negativ Δ eksoterm, noe som betyr at så mye energi—i dette tilfellet 565 kJ—avgis av reaksjonen.
Test deg selv
Vurder denne termokjemiske ligningen.
CO2 (g) + H2 (g) → CO (g) + H2O ( g) Δ = 42 kJ
er det eksoterm eller endoterm? Hvor mye energi er gitt av eller absorbert?
Svar
Endoterm; 42 kJ absorberes.
hvordan måles Δ verdier eksperimentelt? I VIRKELIGHETEN måles IKKE HRYVH; q måles. Men målingene utføres under forhold med konstant trykk, så Δ er lik q målt.
Eksperimentelt måles q ved å utnytte ligningen
q = mcδ
vi måler massen av kjemikaliene i et system. Deretter lar vi den kjemiske reaksjonen oppstå og måler temperaturendringen (Δ) i systemet. Hvis vi kjenner den spesifikke varmen til materialene i systemet (vanligvis gjør vi det), kan vi beregne q. Den verdien av q er numerisk lik PROSESSENS Δ, som vi kan skalere opp til en molar skala. Beholderen der systemet ligger, er vanligvis isolert, slik at enhver energiendring går inn i å endre temperaturen på systemet, i stedet for å bli lekket fra systemet. Beholderen refereres til som en kalorimetera-beholder som brukes til å måle varmen av en kjemisk reaksjon., og prosessen med å måle endringer i entalpi kalles kalorimetryprosessen med å måle entalpiendringer for kjemiske reaksjoner..
Figur 7.4 Kalorimeter
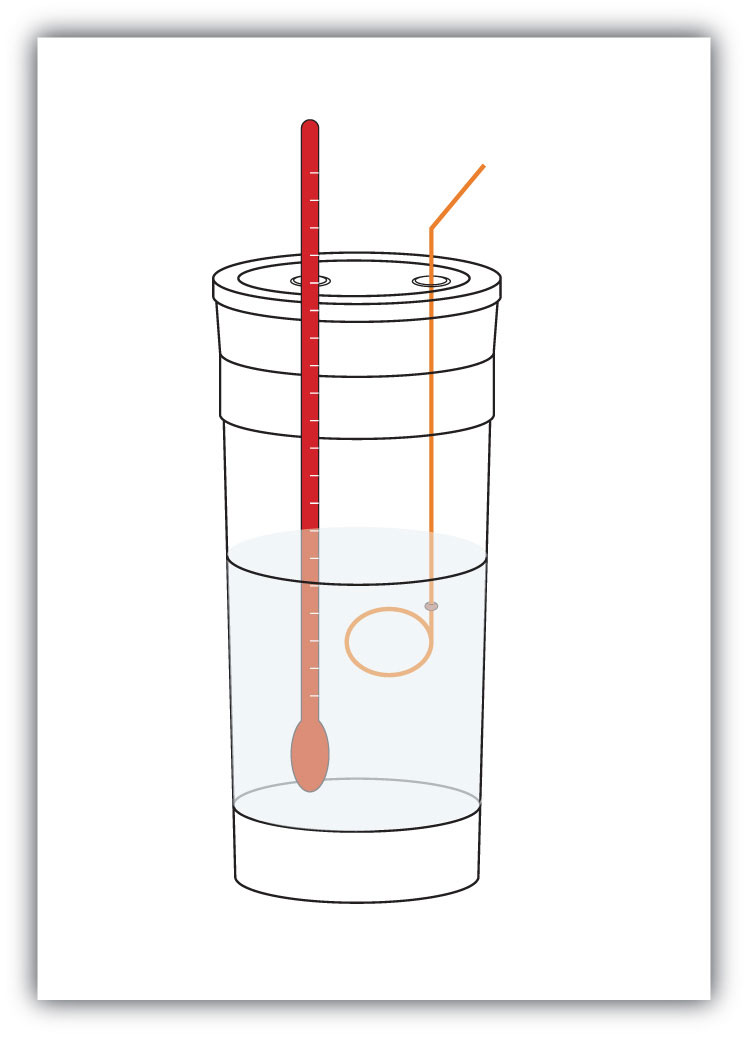
et enkelt kalorimeter kan bygges fra noen nestede skumkaffe kopper, et deksel, et termometer og en omrører.anta for eksempel at 4,0 g NaOH eller 0,10 mol NaOH oppløses for å lage 100,0 mL vandig løsning, mens 3,65 G HCl eller 0,10 mol HCl oppløses for å lage en annen 100,0 mL vandig løsning. De to løsningene blandes i et isolert kalorimeter, et termometer settes inn og kalorimeteret dekkes (Se Figur 7.4 «Kalorimetre» for et eksempeloppsett). Termometeret måler temperaturendringen ettersom følgende kjemiske reaksjon oppstår:
NaOH (aq) + HCl (aq) → nacl (aq) + H2O (ℓ)
en observatør bemerker at temperaturen øker fra 22,4°C til 29,1°C. Forutsatt at varmekapasiteten og tetthetene til løsningene er de samme som for rent vann, har vi nå informasjonen vi trenger for å bestemme entalpiendringen av den kjemiske reaksjonen. Den totale mengden løsning er 200,0 mL, og med en tetthet på 1,00 g/mL har vi dermed 200,0 g løsning. Ved å bruke ligningen for q, erstatter vi våre eksperimentelle målinger og den spesifikke varmen av vann(Tabell 7.1 «Spesifikke Varmer av Forskjellige Stoffer»):
q=(200.0 g) (4.184 J g ⋅ ° c) (6.7°C)
løsning for q, får vi
q=5,600 j ≡ Δ for reaksjonen
varmen Q er lik δ for reaksjonen fordi den kjemiske reaksjonen oppstår ved konstant trykk. Reaksjonen avgir imidlertid denne mengden energi, så det faktiske tegnet på Δ er negativt:
Δ = -5,600 J for reaksjonen
Vi har derfor følgende termokjemiske ligning for den kjemiske reaksjonen som skjedde i kalorimeteret:
110 NaOH(aq)+110 HCl(aq)→110 nacl(aq)+110 h2o(ℓ)Δ=-5,600 J
1/10 koeffisientene er til stede for å minne oss om at vi startet med en tiendedel av en mol av hver reaktant, så vi lager en TIENDEDEL AV EN MOL AV HVERT PRODUKT. Vanligvis rapporterer vi imidlertid termokjemiske ligninger når det gjelder mol, ikke en tiendedel av en mol. For å skalere opp til molare mengder må vi multiplisere koeffisientene med 10. Men når vi gjør dette, får vi 10 ganger så mye energi. Dermed har vi
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(står) ΔH = -56,000 J
Den ΔH kan bli konvertert til kJ enheter, så vår siste thermochemical ligningen
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(står) ΔH = negativ kontantstrøm på 56 kJ
Vi har bare tatt våre eksperimentelle data fra calorimetry og bestemt entalpi endring av en kjemisk reaksjon. Lignende målinger på andre kjemiske reaksjoner kan bestemme Δ-verdiene for enhver kjemisk reaksjon du vil studere.
Eksempel 7
En 100 mL oppløsning på 0.25 mol Ca2+(aq) ble blandet med 0,50 mol F – (aq) ioner, Og CaF2 ble utfelt:
Ca2 + (aq) + 2F – (aq) → CaF2 (s)
temperaturen på løsningen økte med 10,5°C. Hva var entalpiendringen for den kjemiske reaksjonen? Hva var entalpyendringen for produksjon av 1 mol Av CaF2? Anta at løsningen har samme tetthet og spesifikk varme som vann.
Løsning
Fordi vi får Δ direkte, kan vi bestemme reaksjonens varme, som er lik ΔH:
q=(100 g)(4.184 j g ⋅ ° c) (10.5°C)
Løsning for q, får vi
q = 4,400 J
DERFOR, Δ = -4,400 J.
I Henhold til reaksjonens støkiometri vil nøyaktig 0,25 mol CaF2 dannes, så denne mengden varme er for 0,25 mol. For 1 mol CaF2 må vi skalere opp varmen med en faktor på fire:
q = 4,400 J × 4 = 17,600 J for 1 mol CaF2
på molar basis er endringen i entalpi
ΔH = -17,600 J = -17,6 kJ
Test deg selv
i et kalorimeter ved konstant trykk, 0,10 mol CH4(g) og 0,20 mol av o2(g) er reagert.
CH4 (g) + 2o2(g) → CO2 (g) + 2H2O (ℓ)
reaksjonen varmer 750.0 g H2O ved 28.4°C. Hva er Δ for reaksjonen på en molar skala?
Svar
-891 kJ
Key Takeaways
- hver kjemisk reaksjon oppstår med en samtidig endring i energi.
- endringen i entalpi er lik varme ved konstant trykk.
- Entalpi endringer kan uttrykkes ved hjelp av termokjemiske ligninger.
- Entalpi endringer måles ved hjelp av kalorimetri.
Øvelser
-
under hvilke omstendigheter er Q og Δ det samme?
-
Under hvilke omstendigheter er Q og Δ forskjellige?
-
Hydrogengass og klorgass reagerer for å lage hydrogenkloridgass med en tilhørende entalpi-endring på -184 kJ. Skriv en riktig balansert termokjemisk ligning for denne prosessen.Propan (C3H8) reagerer med elementær oksygen gass for å produsere karbondioksid og flytende vann med en tilhørende entalpi endring av -2,220 kJ. Skriv en riktig balansert termokjemisk ligning for denne prosessen.
-
Nitrogengass reagerer MED oksygengass for å lage NO(g) mens den absorberer 180 kJ. Skriv en riktig balansert termokjemisk ligning for denne prosessen.
-
Fast natrium reagerer med klorgass for å lage fast natriumklorid mens det avgir 772 kJ. Skriv en riktig balansert termokjemisk ligning for denne prosessen.
-
Hydrogengass og klorgass reagerer for å lage hydrogenkloridgass med en tilhørende entalpi-endring på -184 kJ. Er denne prosessen endoterm eller eksoterm?
-
Propan (C3H8) reagerer med elementær oksygengass for å produsere karbondioksid mens den avgir 2220 kJ energi. Er denne prosessen endoterm eller eksoterm?
-
Nitrogengass reagerer MED oksygengass for å lage NO(g) mens den absorberer 180 kJ. Er denne prosessen eksoterm eller endoterm?
-
Natriummetall kan reagere med nitrogen for å lage natriumazid (NaN3) med EN Δ på 21,72 kJ. Er denne prosessen eksoterm eller endoterm?
-
Tegn et energinivådiagram for den kjemiske reaksjonen i Øvelse 8. (Se Figur 7.3 «Reaksjonsenergi» for et eksempel.)
-
Tegn et energinivådiagram for den kjemiske reaksjonen i Øvelse 9. (Se Figur 7.3 «Reaksjonsenergi» for et eksempel.)
-
i en 250 mL oppløsning kombineres 0,25 mol KOH(aq) og 0,25 mol HNO3(aq). Temperaturen på løsningen øker fra 22,5 hryvnias C til 35,9 hryvnias C. Anta at løsningen har samme tetthet og varmekapasitet av vann. Hva er reaksjonens varme, og hva er DEN Δ av reaksjonen på molar basis?
-
I en 600 mL oppløsning, 0.50 mol Av Ca (OH) 2 (aq) og 0,50 mol AV H2SO4 (aq) er kombinert. Løsningens temperatur øker med 22.3°C. hva er reaksjonens varme, og hva er REAKSJONENS Δ på molar basis? Anta at løsningen har samme tetthet og varmekapasitet av vann.
-
for å varme 400,0 g H2O blir 0,050 mol etanol (C2H5OH) brent. Vannet varmer fra 24.6°C til 65.6°C. hva er reaksjonens hete, og hva er REAKSJONEN PÅ molar basis?
-
for å varme 100,0 g H2O blir 0,066 mol bivoks brent. Vannet blir varmet fra 21.4°C til 25.5°C. hva er reaksjonens hete, og hva er REAKSJONEN PÅ molar basis?
Svar
under forhold med konstant trykk
H2(g) + Cl2(G) → 2hcl(g) Δ = -184 kJ
n2(g) + o2(g) → 2no(g) δ = 180 kj
eksoterm
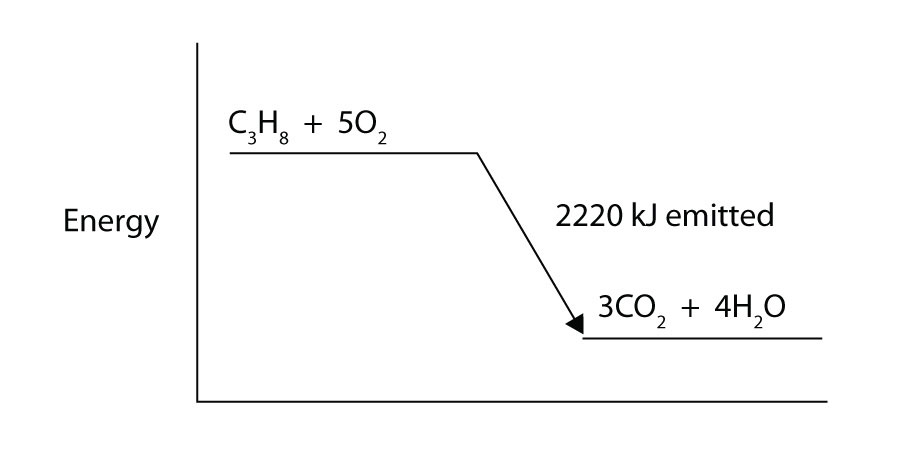 div>
div>
reaksjonens varme = -14,0 kj; Δ = -56,0 kJ/mol av reaktanter
reaksjonsvarmen = -68,6 kJ; Δ = -1,370 kJ / mol etanol