Innledende Kjemi-1. Kanadiske Utgave
Læringsmål
- Definer damptrykket av væsker.
- Forklar opprinnelsen til både overflatespenning og kapillærvirkning.
Det er noen egenskaper som alle væsker har. Væsken som vi er mest kjent med, er sannsynligvis vann, og det har disse egenskapene. Andre væsker har dem også, noe som er noe å huske på.
alle væsker har en viss del av partiklene som har nok energi til å gå inn i gassfasen, og hvis disse partiklene er på overflaten av væsken, gjør de det (Figur 10.6 «Fordampning»). Dannelsen av en gass fra en væske ved temperaturer under kokepunktet kalles fordampning. Ved disse temperaturene kalles materialet i gassfasen damp, i stedet for gass; begrepet gass er reservert for når gassfasen er den stabile fasen.
Figur 10.6 Fordampning

Noen partikler av en væske har nok energi til å unnslippe væskefasen til å bli en damp.
hvis tilgjengelig volum er stort nok, vil all væske til slutt bli til damp. Men hvis det tilgjengelige volumet ikke er nok, vil noen av damppartiklene til slutt komme inn i væskefasen (Figur 10.7 «Likevekt»). På et tidspunkt vil antall partikler som kommer inn i dampfasen være lik antall partikler som forlater dampfasen, så det er ingen nettoendring i mengden damp i systemet. Vi sier at systemet er i likevekt. Partialtrykket til dampen ved likevekt kalles damptrykket til væsken.
Figur 10.7 Likevekt

på et tidspunkt vil antall partikler som kommer inn i dampfasen balanseres av antall partikler som vender tilbake til væsken. Dette punktet kalles likevekt.
Forstå at væsken ikke har sluttet å fordampe. Den omvendte prosessen-kondensering-skjer så raskt som fordampning er, så det er ingen netto endring i mengden damp i systemet. Begrepet dynamisk likevekt representerer en situasjon der en prosess fortsatt oppstår, men den motsatte prosessen skjer også i samme takt slik at det ikke er noen nettoendring i systemet.
damptrykket for et stoff er avhengig av stoffets temperatur; når temperaturen øker, gjør det også damptrykket. Figur 10.8 «Plott Av Damptrykk mot Temperatur For Flere Væsker» er et plott av damptrykk mot temperatur for flere væsker. Etter å ha definert damptrykk, kan vi også omdefinere kokepunktet til en væske: temperaturen der damptrykket til en væske er lik det omgivende miljøtrykket. Det normale damptrykket er da temperaturen der damptrykket er 760 torr, eller nøyaktig 1 atm. Dermed varierer kokepunktene med omgivende trykk, et faktum som kan ha store implikasjoner på matlaging ved lavere eller høyere enn normale høyder. Atmosfærisk trykk varierer betydelig med høyde.
Figur 10.8 Plott Av Damptrykk versus Temperatur For Flere Væsker
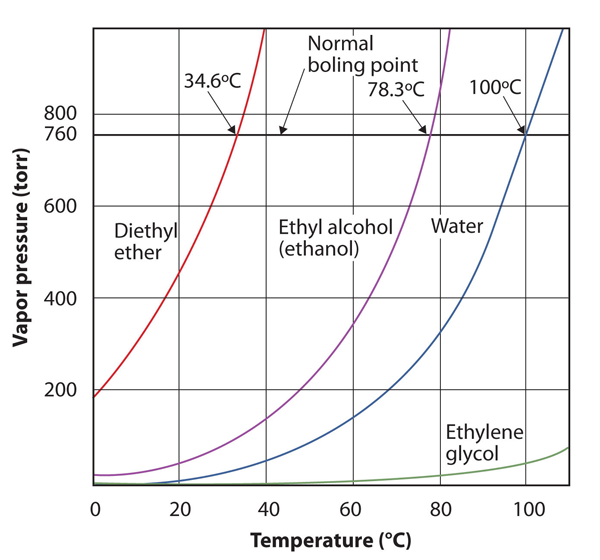
damptrykket til en væske avhenger av væskens identitet og temperaturen, som denne plottet viser.
Eksempel 4
Bruk Figur 10.8 «Plott Av Damptrykk versus Temperatur For Flere Væsker» for å estimere kokepunktet for vann ved 500 torr, som er omtrentlig atmosfærisk trykk på toppen Av Mount Everest.
Løsning
Se vedlagte figur. Fem hundre torr er mellom 400 og 600, så vi strekker en linje fra det punktet på y-aksen over til kurven for vann og deretter slippe den ned til x-aksen for å lese tilhørende temperatur. Det ser ut til at punktet på vanndamptrykkskurven tilsvarer en temperatur på ca. 90°C, så vi konkluderer med at kokepunktet for vann ved 500 torr er 90°C.
Figur 10.9 Ved Bruk Av Figur 10.8 «Plott Av Damptrykk versus Temperatur For Flere Væsker» For Å Svare Eksempel 4
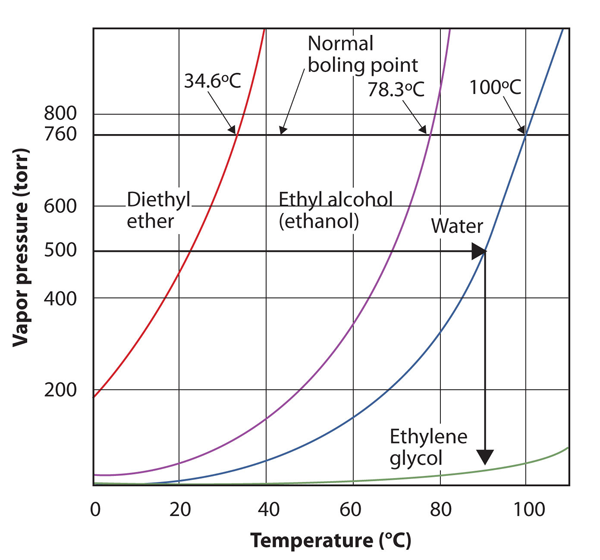
ved å lese grafen riktig kan du estimere kokepunktet til en væske ved forskjellige temperaturer.
Test deg selv
Bruk Figur 10.8 «Plott Av Damptrykk versus Temperatur For Flere Væsker» for å estimere kokepunktet for etanol ved 400 torr.
Svar
om 65°C
damptrykkskurven for vann er ikke nøyaktig null ved smeltepunktet-0°C. selv is har et damptrykk; det er derfor det sublimerer over tid. Imidlertid er damptrykket av faste stoffer vanligvis mye lavere enn for væsker. Ved -1°C er damptrykket til ice 4,2 torr. Ved en frysetemperatur på 0°F (-17°C) er damptrykket til ice bare 1,0 torr; såkalte dypfrysere kan komme ned til -23°C, hvor damptrykket til ice bare er 0,6 torr.
Fasediagrammer
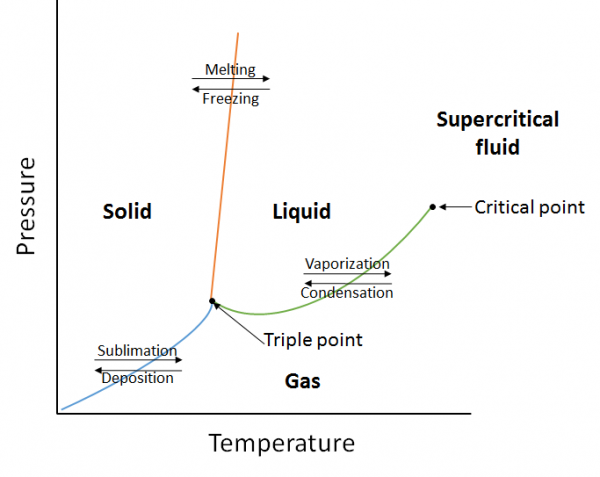
et fasediagram er en grafisk fremstilling av likevektsrelasjonene som eksisterer mellom fasene av et stoff under spesifiserte trykk og temperaturer (Figur 10.10). Fasediagrammet er en kombinasjon av tre kurver: damptrykkskurven, smeltekurven og sublimeringskurven. Vi har tidligere sett at damptrykkskurver representerer likevekten mellom væske-og gassfasen, og punktet der trykket tilsvarer 1 atm er det normale kokepunktet. En ekstra funksjon i denne kurven i fasediagrammet (grønn), er at den ender på kritisk punkt. Det kritiske punktet er punktet ved høyeste temperatur og trykk hvor væsker og gasser forblir skillebare. Ved temperaturer og trykk utover dette punktet eksisterer saken i en fase med egenskaper av både væsker og gasser kjent som superkritisk væske.
smeltekurven (oransje) representerer likevekten mellom fast og flytende, og punktet der trykket er lik 1 atm er det normale smeltepunktet. Sublimasjonskurven (blå) representerer likevekten som eksisterer mellom fast og gass. Endelig er punktet der alle tre kurvene møtes kjent som trippelpunktet. På dette punktet eksisterer tre faser (fast, flytende og gass) alle i likevekt.
Eksempel:
bruk følgende fasediagram, bestem hva som ville skje hvis:
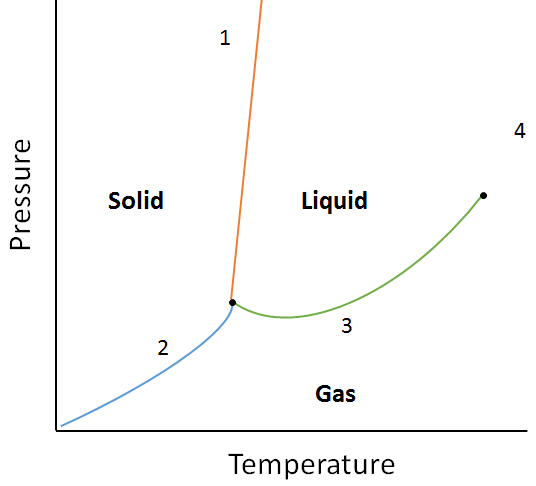
a. temperaturen økes for materie ved punkt 1.
b. trykket økes for materie ved punkt 3.
Løsning:
A. Materie ved punkt 1 vil smelte (endre fase fra fast til flytende) hvis temperaturen økes.
b. Matter ved punkt 3 vil kondensere (endre fase fra gass til væske) hvis temperaturen økes.
Overflatespenning og Kapillærvirkning
alle væsker deler også andre egenskaper. Overflatespenning er en effekt forårsaket av en ubalanse av krefter på atomene på overflaten av en væske, som vist I Figur 10.11 «Overflatespenning». Den blå partikkelen i hoveddelen av væsken opplever intermolekylære krefter fra hele, som illustrert av pilene. Den gule partikkelen på overflaten opplever imidlertid ingen krefter over den fordi det ikke er noen partikler over den. Dette fører til en ubalanse av krefter som vi kaller overflatespenning.
Figur 10.11 Overflatespenning

Overflatespenning kommer fra det faktum at partikler på overflaten av en væske ikke opplever interaksjoner fra alle retninger, noe som fører til en ubalanse av krefter på overflaten.
Figur 10.12 Effekter Av Overflatespenning

Kilde:» wet apple » av cristian ruberti er lisensiert under Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generisk.