Innledende Kjemi-1. Kanadiske Utgave
Læringsmål
- Definer buffer.
- Korrekt identifisere de To komponentene i en buffer.
som angitt I Avsnitt 12.4 «Sterke Og Svake Syrer Og Baser og Deres Salter», er svake syrer relativt vanlige, selv i maten vi spiser. Men vi møter noen ganger en sterk syre eller base, som magesyre, som har en sterkt sur pH på 1,7. Per definisjon kan sterke syrer og baser produsere en relativt stor mengde H + – ELLER OH-ioner og dermed ha merket kjemiske aktiviteter. I tillegg kan svært små mengder sterke syrer og baser endre pH i en løsning veldig raskt. Hvis 1 mL magesyre ble tilsatt i blodet og ingen korrigeringsmekanisme var tilstede, ville blodets pH reduseres fra ca. 7, 4 til ca. 4, 7-en pH som ikke bidrar til fortsatt levetid. Heldigvis har kroppen en mekanisme for å minimere slike dramatiske pH-endringer.
mekanismen innebærer en buffer, en løsning som motstår dramatiske endringer i pH. Buffere gjør det ved å være sammensatt av visse par oppløsninger: enten en svak syre pluss et salt avledet fra den svake syren eller en svak base pluss et salt av den svake basen. For eksempel kan en buffer bestå av oppløst HC2H3O2 (en svak syre) og NaC2H3O2 (saltet avledet fra den svake syren). Et annet eksempel på en buffer er EN løsning som inneholder NH3 (en svak base) Og NH4Cl (et salt avledet fra den svake basen).
La oss bruke EN HC2H3O2 / NaC2H3O2 buffer for å demonstrere hvordan buffere fungerer. Hvis en sterk base—EN KILDE TIL OH−(aq) ioner—legges til bufferløsningen, vil DISSE OH− ionene reagere MED HC2H3O2 i en syrebasereaksjon:
HC2H3O2(aq) + OH-(aq) → H2O(ℓ) + C2H3O2−(aq)
I Stedet for å endre pH dramatisk ved å gjøre løsningen grunnleggende, reagerer de tilsatte OH−ionene FOR Å gjøre H2O, slik at pH ikke endres mye.
hvis en sterk syre—En Kilde Til H+—ioner-tilsettes bufferoppløsningen, vil H+ – ionene reagere med anionen fra saltet. FORDI HC2H3O2 er en svak syre, er den ikke ionisert mye. Dette betyr at hvis mange H + – ioner og C2H3O2-ioner er til stede i samme løsning, vil DE komme sammen for Å lage HC2H3O2:
H + (aq) + C2H3O2 – (aq) → HC2H3O2 (aq)
I Stedet for å endre pH dramatisk og gjøre løsningen sur, reagerer de tilsatte h + – ionene for å lage molekyler av en svak syre. Figur 12.2″ Handlinger Av Buffere » illustrerer begge handlinger av en buffer.
Figur 12.2 Handlingene Til Buffere
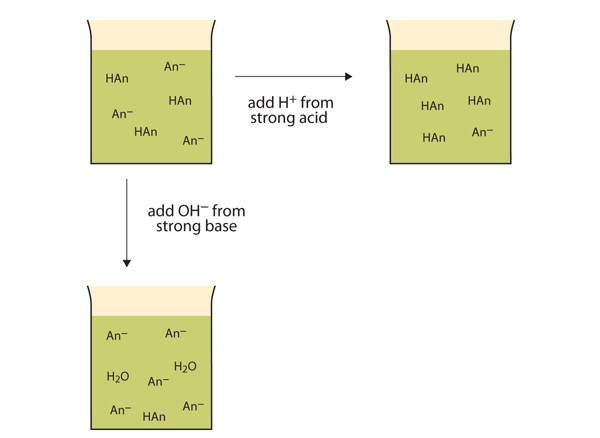
Buffere kan reagere med både sterke syrer (topp) og sterke baser (side) for å minimere store endringer i pH.
Buffere laget av svake baser og salter av svake baser virker på samme måte. FOR eksempel, i en buffer som inneholder NH3 og NH4Cl, KAN NH3− molekyler reagere med overskytende H+−ioner introdusert av sterke syrer:
NH3(aq) + h+(aq) → NH4+(aq)
MENS NH4+(aq) ion kan reagere med EVENTUELLE OH-ioner introdusert av sterke baser:
NH4+(aq) + OH – (aq) → NH3(aq) + H2O(ℓ)
eksempel 15
hvilke kombinasjoner av Forbindelser kan lage en bufferløsning?
- HCHO2 Og NaCHO2
- HCl Og Nacl
- CH3NH2 OG CH3NH3Cl
- NH3 OG NaOH
Løsning
- HCHO2 er maursyre, en svak syre, Mens NaCHO2 er saltet laget av anionen av den svake syren (formiat ion ). Kombinasjonen av disse to løsemiddelene ville gjøre en bufferløsning.
- HCl Er en sterk syre, ikke en svak syre, så kombinasjonen av disse to løsningsmidlene ville ikke gjøre en bufferløsning.
- CH3NH2 ER metylamin, som er SOM NH3 med et Av Dets h-atomer substituert MED EN CH3-gruppe. Fordi Det ikke er oppført I Tabell 12.2 «Sterke Syrer og Baser», kan vi anta at det er en svak base. Forbindelsen CH3NH3Cl er et salt laget av den svake basen, slik at kombinasjonen av disse to løsningsmidlene vil gjøre en bufferløsning.NH3 er en svak base, Men NaOH er en sterk base. Kombinasjonen av disse to løsemidler ville ikke gjøre en bufferløsning.
Test deg selv
Hvilke kombinasjoner av forbindelser kan lage en bufferløsning?
- NaHCO3 og NaCl
- H3PO4 Og NaH2PO4
- NH3 OG (NH4)3PO4
- NaOH og NaCl
Svar
Buffere arbeid godt bare for begrensede mengder tilsatt sterk syre Eller Base. Når enten løsemiddel er fullstendig reagert, løsningen er ikke lenger en buffer, og raske endringer i pH kan forekomme. Vi sier at en buffer har en viss kapasitet. Buffere som har mer løsemiddel oppløst i dem til å begynne med, har større kapasiteter, som det kan forventes.
Humant blod har et buffersystem for å minimere ekstreme endringer i pH. En buffer i blod er basert på tilstedeværelsen AV HCO3 – OG H2CO3 . Med denne bufferen tilstede, selv om noen magesyre skulle finne veien direkte inn i blodet, ville endringen i blodets pH være minimal. Inne i mange av kroppens celler er det et buffersystem basert på fosfationer.
Mat Og Drikke App: Syren som Lindrer Smerte
selv om medisiner ikke akkurat er «mat og drikke», inntar vi dem, så la oss ta en titt på en syre som trolig er den vanligste medisinen: acetylsalisylsyre, også kjent som aspirin. Aspirin er kjent som smertestillende og antipyretisk (feberreduserende).
strukturen av aspirin er vist i den medfølgende figuren. Syredelen er sirklet; Det Er h-atomet i den delen som kan doneres som aspirin virker Som En Brø-Lowry syre. Fordi det ikke er gitt I Tabell 12.2 «Sterke Syrer og Baser», er acetylsalisylsyre en svak syre. Imidlertid er det fortsatt en syre, og gitt at noen mennesker bruker relativt store mengder aspirin daglig, kan den sure naturen forårsake problemer i mageforingen, til tross for magenes forsvar mot sin egen magesyre.
Figur 12.3 Den Molekylære Strukturen Av Aspirin
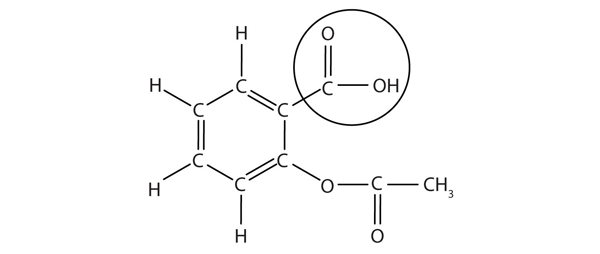
de sirklede atomer er den sure delen av molekylet.Fordi syreegenskapene til aspirin kan være problematiske, tilbyr mange aspirinmerker en» bufret aspirin » form av medisinen. I disse tilfellene inneholder aspirin også en buffer agent-vanligvis MgO – som regulerer surheten av aspirin for å minimere sine sure bivirkninger.så nyttig og vanlig som aspirin er, ble det formelt markedsført som et stoff som startet i 1899. US Food And Drug Administration (FDA), det statlige byrået som har ansvaret for å overvåke og godkjenne narkotika i Usa, ble ikke dannet før 1906. Noen har hevdet at HVIS FDA hadde blitt dannet før aspirin ble introdusert, kan aspirin aldri ha fått godkjenning på grunn av potensialet for bivirkninger—gastrointestinal blødning, ringing i ørene, Reyes syndrom (et leverproblem) og noen allergiske reaksjoner. Men nylig aspirin har vært spioneringen for dens effekter i minske hjerteinfarkt og slag, så det er sannsynlig at aspirin er her for å bli.
Key Takeaways
- en buffer er en løsning som motstår plutselige endringer i pH.
Øvelser
-
Definer buffer. Hvilke to relaterte kjemiske komponenter kreves for å lage en buffer?
-
Kan en buffer gjøres ved å kombinere en sterk syre med en sterk base? Hvorfor eller hvorfor ikke?
-
hvilke kombinasjoner av forbindelser kan lage en buffer? Anta vandige løsninger.
a) HCl og nacl
b) HNO2 Og NaNO2
c) NH4NO3 og HNO3
d) NH4NO3 og NH3
4. Hvilke kombinasjoner av forbindelser kan lage en buffer? Anta vandige løsninger.
a) H3PO4 og Na3PO4
b) NaHCO3 og Na2CO3
c) NaNO3 Og Ca(NO3)2
d) HN3 og NH3
5. For hver kombinasjon I Øvelse 3 som er en buffer, skriv de kjemiske ligningene for reaksjonene til bufferkomponentene når en sterk syre og en sterk base tilsettes.
6. For hver kombinasjon i Øvelse 4 som er en buffer, skriv de kjemiske ligningene for reaksjonene til bufferkomponentene når en sterk syre og en sterk base tilsettes.
7. Det komplette fosfatbuffersystemet er basert på fire stoffer: H3PO4, H2PO4, HPO42 OG PO43. Hvilke forskjellige bufferløsninger kan gjøres fra disse stoffene?
8. Forklar hvorfor NaBr ikke kan være en komponent i enten en sur eller en grunnleggende buffer.
9. To løsninger er laget som inneholder de samme konsentrasjonene av løsemidler. En løsning består AV H3PO4 Og Na3PO4, mens den andre består AV HCN og NaCN. Hvilken løsning bør ha størst kapasitet som buffer?
10. To løsninger er laget som inneholder de samme konsentrasjonene av løsemidler. EN løsning består AV NH3 OG NH4NO3, mens DEN andre består AV H2SO4 Og Na2SO4. Hvilken løsning bør ha størst kapasitet som buffer?
Svar
en buffer er kombinasjonen av en svak syre eller base og et salt av den svake syre eller base.
a) nei
b) ja
c) nei
d) ja
3b: sterk syre: NO2− + H+ → HNO2; sterk base: HNO2 + OH− → NO2− + H2O; 3d: sterk base: NH4 + + OH – → NH3 + H2O; sterk syre: NH3 + H + → NH4 + 7.
Buffere kan gjøres fra tre kombinasjoner: (1) H3PO4 OG H2PO4 -, (2) H2PO4 – OG HPO42-og (3) HPO42 – OG PO43 -. (Teknisk sett kan en buffer gjøres fra to komponenter.)
fosfatbufferen bør ha større kapasitet.