Kjemi For Ikke-Majors
Hvordan endrer denne arbeiderens energi når han klatrer opp og ned stigen?
Klatring en stige tar energi. Ved hvert trinn presser du deg opp mot tyngdekraften og samler potensiell energi. Kommer ned igjen frigjør den potensielle energien når du kommer ned trinnvis. Hvis du ikke er forsiktig, kan du frigjøre den potensielle energien på en gang når du faller av stigen (aldri en god ide). I tillegg tar du klatre eller nedstigning i trinn. Det er ingen «mellom» posisjon på stigen-foten din treffer enten et trinn eller det treffer tomt rom, og du er i trøbbel til du finner et trinn å stå på.

Etter funnene av hydrogenutslippsspektra og den fotoelektriske effekten foreslo den danske fysikeren Niels Bohr (1885-1962) en ny modell av atomet i 1915. Bohr foreslo at elektroner ikke utstråler energi når de går i bane rundt kjernen, men eksisterer i tilstander med konstant energi som han kalte stasjonære tilstander. Dette betyr at elektronene går i bane på faste avstander fra kjernen (Se Figur nedenfor). Bohrs arbeid var hovedsakelig basert på utslippsspektra av hydrogen. Dette er også referert til som planetenes modell av atomet. Det forklarte den indre driften av hydrogenatomet. Bohr ble tildelt Nobelprisen i fysikk i 1922 for sitt arbeid.
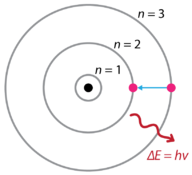
Figur 1. Bohrs atommodell hydrogen utslipp spektra.Bohr forklarte at elektroner kan flyttes inn i forskjellige baner med tilsetning av energi. Når energien er fjernet, går elektronene tilbake til grunntilstanden, og sender ut en tilsvarende mengde energi – et kvantum av lys eller foton. Dette var grunnlaget for det som senere ble kjent som kvanteteori . Dette er en teori basert på prinsippet om at materie og energi har egenskapene til både partikler og bølger. Det står for et bredt spekter av fysiske fenomener, inkludert eksistensen av diskrete pakker av energi og materie, usikkerhetsprinsippet og ekskluderingsprinsippet.
Ifølge Bohr-modellen, ofte referert til som en planetmodell, omgir elektronene atomkjernen i bestemte tillatte baner kalt baner. Når elektronen er i en av disse banene, er dens energi løst. Grunntilstanden til hydrogenatomet, hvor energien er lavest, er når elektronen er i bane som er nærmest kjernen. Banene som er lenger fra kjernen er alle suksessivt større energi. Elektronen har ikke lov til å okkupere noen av mellomromene mellom banene. En hverdagslig analogi Til Bohr-modellen er trinnene på en stige. Når du beveger deg opp eller ned en stige, kan du bare okkupere bestemte trinn og kan ikke være i mellomrommene mellom trinnene. Flytte opp stigen øker din potensielle energi, mens du flytter ned stigen reduserer din energi.Bohrs arbeid hadde en sterk innflytelse på vår moderne forståelse av atomets indre arbeid. Men hans modell fungerte bra for en forklaring på utslippene av hydrogenatomet, men var alvorlig begrenset når det ble brukt på andre atomer. Kort Tid Etter At Bohr publiserte sin planetariske modell av atomet, ble det gjort flere nye funn, noe som resulterte i, igjen, et revidert syn på atomet.
Sammendrag
- Bohr-modellen postulerer at elektroner går i bane rundt kjernen ved faste energinivåer.
- Baner lenger fra kjernen eksisterer ved høyere energinivåer.
- når elektroner går tilbake til et lavere energinivå, avgir de energi i form av lys.
Praksis
Bruk linken nedenfor for å svare på følgende spørsmål:
- Hvordan endrer et elektron baner?
- Hva Var Bohr-modellen basert på?
- Hva trodde Bohr om banene?
- Fungerer Bohrs modell for alle atomer?
Review
- Når foreslo Bohr sin modell av atomet?
- Hva er en stasjonær tilstand?
- Hva er grunntilstanden?
- kan elektronen okkupere noe mellomrom mellom banene?
Ordliste
- planetmodell: En måte å beskrive Bohrs modell av atomet.kvanteteori: Materie og energi har egenskapene til både partikler og bølger.
- stasjonær tilstand: Elektroner bane i fast avstand fra kjernen.