Ta en titt På De Siste artiklene
Abstract
Low-output heart failure (LoHF) Er en uvanlig form for hjertesvikt (HF), men en som signaliserer svært avansert HF. Det er forbundet med illevarslende prognose samt betydelig sykelighet og dødelighet. LoHF er imidlertid fortsatt stort sett underforsket. Den tradisjonelle beskrivelsen av HF fokuserte på kongestiv hjertesvikt (CHF) preget av lav hjerteutgang og ledsaget av lunge/perifer overbelastning. Dette fokuset bidro til underforståelse av LoHF-pasienter som har liten eller ingen tegn på overbelastning. Videre Har LoHF-pasienter ingen påvist behandling, og valg av egnet behandling avhenger av individuell patofysiologi og underliggende etiologi. LoHF pasienter har heterogen etiologi og patofysiologi fremhever viktigheten av inngående forståelse av sine kliniske funksjoner, diagnose og klinisk ledelse, som danner grunnlaget for den foreliggende gjennomgang.
Nøkkelord
hjertesyndrom med lav effekt, hjertesvikt med lav effekt, lav utgangsstatus
Introduksjon
til tross for bemerkelsesverdige fremskritt innen medisinsk og kirurgisk behandling, fortsetter effektiv behandling av hjertesvikt (HF) å utgjøre betydelige utfordringer for helsepersonell. Utfordringen er reflektert av høy forekomst AV HF-relaterte sykehus reinnleggelser sammen med økt dødelighet og sykelighet . En del av utfordringen er svært heterogen etiologi, patofysiologi og kliniske presentasjoner av ulike former FOR HF, hvor noen HF-former har en mangel på kliniske studiedata og dermed en begrenset forståelse. Spesielt har den tradisjonelle beskrivelsen AV HF vært nesten synonymt med kongestiv hjertesvikt (CHF), men begrepet CHF utelukker et mindretall AV HF-pasienter som har liten eller ingen påviselige symptomer på lunge-og/eller perifer overbelastning . Low-output Hf (LoHF) har også vært knyttet til en uheldig prognose og signalerer svært avansert HF. Videre støtter symptomatiske og patofysiologiske forskjeller I CHF og LoHF behovet for ulike kliniske ledelsesmetoder . Til tross for disse forskjellene har tradisjonelle HF-terapier blitt generalisert til alle former FOR HF, inkludert CHF og LoHF, noe som skaper et klinisk behov for å forstå patofysiologi, diagnose og klinisk behandling Av LoHF. I denne artikkelen samler vi publiserte bevis På LoHF når det gjelder epidemiologi, etiologi, patofysiologi, diagnose og klinisk ledelse. Hensikten er å fornye kunnskapen Om Lohfs kliniske status, samt forbedre den kliniske styringen av HF generelt.
Definisjon
Hjertesvikt Er et komplekst klinisk syndrom preget av strukturelle og / eller funksjonelle myokardfeil som fører til nedsatt ventrikulær fylling eller utstøting . Syndromets kompleksitet er tydelig i sine heterogene klassifikasjoner: høyre -, venstre-eller bi-ventrikulær basert på defektsted; akutt eller kronisk basert på starttidspunkt; bevart, borderline eller redusert ejeksjonsfraksjon basert på funksjonell status; lav-eller høy-output basert på minuttvolum (CO), og fremover eller bakover svikt basert på retningen av blodstrømmen. Hver av disse klassifikasjonene er signifikant for diagnose og behandling av HF . TIL tross for flere klassifikasjoner, begrepet CHF har tradisjonelt blitt brukt om hverandre MED HF, men som ikke tilstrekkelig beskrive LoHF på grunn av flere symptomatiske og patofysiologiske forskjeller.
LoHF, også kjent som lav CO ved akutt dekompensert hf, beskriver en høyfrekvent form FOR HF preget av redusert forover CO (hjerteindeks < 2.0 L/min/m2 og systolisk blodtrykk < 90 mmHg) og endorganhypoperfusjon med liten eller ingen tegn på lungetetthet . LoHF er forskjellig fra CHF, som beskriver HF karakterisert ved redusert CO som forårsaker pulmonal og perifer congestion som fører til henholdsvis dyspnø og perifert ødem . 2005 european Society Of Cardiology (ESC) retningslinjer for diagnose og behandling av HF foreslår et kontinuum fra low cardiac output syndrome (LCOS) Til LoHF til kardiogent sjokk. ESC-retningslinjene definerer kardiogent sjokk som bevis på vevsperfusjon indusert AV HF etter korreksjon av forbelastning preget av systolisk BP < 90 mmHg eller en dråpe gjennomsnittlig arterielt trykk > 30 mmHg; urinutgang < 0,5 ml/kg/t; pulsfrekvens > 60 slag per minutt (bpm) med eller uten tegn på overbelastning . LCOS er derimot vanlig hos postoperative HF-pasienter og definert som behovet for postoperativ intra-aorta ballongpumpe eller inotrop støtte i mer enn 30 minutter i en akuttbehandling .
Epidemiologi
den eksakte prevalensen og forekomsten Av LoHF i den generelle befolkningen er helt ukjent. Per i dag finnes det ingen populasjonsbaserte epidemiologiske data som er spesifikke for LoHF. De eneste tilgjengelige dataene er fra kliniske studier med enkeltsenter som undersøker en utvalgt populasjon AV HF-pasienter som har gjennomgått hjertekirurgi. I 1975, Parr et al. den seminal beskrivelsen av den kliniske enheten AV LCOS og rapporterte en forekomst på 25% hos barn som hadde gjennomgått hjertekirurgi basert på redusert CO definert som CI < 2,0 L/min/m2. To tiår senere, Wernovsky et al. viste samme forekomst av postoperative LCOER hos pasienter som hadde gjennomgått arteriell bryteroperasjon, og som forekom innen 6-18 timer etter operasjonen. Mye nyere kliniske studier rapporterer en stor variasjon i prevalens, fra 3,6% (menn) og 5,9% (kvinner) til 9,1% og til 41% og en forekomst på 14,7% . I en nylig langsiktig (tjueårig: 1990-2009) prospektiv klinisk studie med 25 176 påfølgende koronar bypass (CABG) kirurgi pasienter, Algarni et al. rapportert var forekomsten av postoperative LCOER signifikant redusert fra 9,1% (1990-1994) til 2,4% (2005-2009) .
Etiologi
etiologien Til LoHF er multifaktoriell. Vanligvis er det en konsekvens av venstre ventrikel (LV), høyre ventrikel (RV) eller systemisk ventrikel (enkelt ventrikelanatomi) dysfunksjon og kan omfatte enten eller både systolisk og/eller diastolisk dysfunksjon . Forstyrrelser i ventrikulær fylling eller utstøting fører Til LoHF, noe som er en hyppig komplikasjon hos pasienter som har gjennomgått hjertekirurgi eller er i kardiogent sjokk . Det kan oppstå som en akutt forverring hos pasienter med kronisk HF, eller det kan være forbigående og reversibel episode med oppløsning av den akutte utløseren. Det er et klinisk syndrom betraktet som den endelige vei for en rekke sykdommer som påvirker hjertefunksjonen. Det er ikke tilstrekkelig å stille Diagnose Av LoHF, den underliggende årsaken eller utløseren må også bestemmes og om mulig behandles . Tabell 1 gir et sammendrag av tilstander som forårsaker lav produksjonstilstand hos HF-pasienter.
Tabell 1. Etiologi av lav utgangsstatus ved patofysiologi
|
Mekanismer |
|
|
Tap av myokardial kontraktilitet td> |
koronarsykdom, kardiomyopati, myokarditt, dekompensert kronisk hf, post-hjertekirurgi, toksiner, ernæring (fedme)m infiltrative sykdommer, end stage nyresvikt, chagas sykdom eller hiv-infeksjon |
|
svekket ventrikulær fylling eller utstøting |
perikarditt, perikardeffusjon, hjertetamponade, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
Den nåværende forståelsen Av patofysiologien til LoHF er i stor grad avhengig av bevis fra kliniske studier på postoperative CABG-pasienter . Det patologiske kjennetegnet er overdrevet deprimert CO ledsaget av endorganhypoperfusjon. Fysiologisk fungerer hjertet som en pumpe for å distribuere oksygenert blod i tilstrekkelige mengder for å tilfredsstille metabolske behov i vev. Siden metabolske behov varierer under normale og stressende situasjoner, varierer CO også for å tilfredsstille denne dynamiske etterspørselen . Den diastoliske fasen av hjertesyklusen er kritisk hos LoHF-pasienter fordi det er under ventrikulær avslapping at koronar fylling oppstår for å gi myokardisk oksygenering . Hjertefrekvens (HR) er også signifikant i diastol fordi for rask HR forhindrer hjertet i å oppnå fullstendig myokardavslapping og perfusjon. Dermed oppstår hjertedysfunksjon fra strukturell (gjenværende hjerteanomali) eller funksjonell hjertesykdom(forstyrrelser i ventrikulær fylling eller tømming, eller økt systemisk vaskulær motstand ).
Patofysiologisk er CO avhengig AV HR og slagvolum (SV) (CO = HR * SV). Slagvolum er i sin tur nettoproduktet av tre interrelaterte sirkulasjonsvariabler: preload, afterload og contractility. Hvis en eller flere av disse komponentene er svekket, kan en lav hjerteutgangstilstand utvikles . Videre påvirker disse komponentene både systoliske og diastoliske faser av hjertesyklusen som forårsaker LV / RV systolisk dysfunksjon og / eller diastolisk dysfunksjon, også kjent SOM HF med bevart ejeksjonsfraksjon (Figur 1). Andre forhold som valvulær hjertesykdom, pulmonal hypertensjon (PH), mekanisk ventildysfunksjon og respiratorisk svikt kan utfelle eller forverre utviklingen Av LoHF .
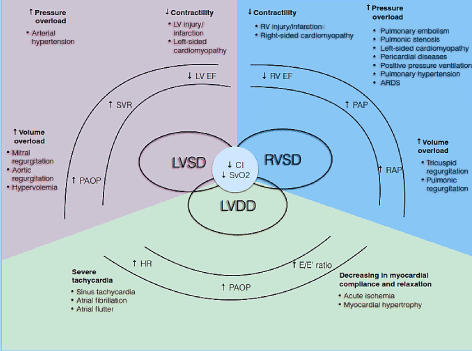
Figur 1. Patofysiologiske mekanismer for lav-output hjertesvikt
Vanlige årsaker og typiske; symptomer På LoHF er inkludert. De viktigste patofysiologiske mekanismene Til LoHF er ventrikulær dysfunksjon: LV systolisk og / eller diastolisk dysfunksjon og RV systolisk dysfunksjon, som alle deler vanlige patologiske trekk ved redusert hjerteindeks (CI) og redusert blandet venøs oksygenmetning (SvO2). LV og RV systolisk dysfunksjon skyldes økt trykkoverbelastning, økt volumoverbelastning og redusert kontraktilitet, MENS LV diastolisk dysfunksjon skyldes alvorlig takykardi og redusert myokardial compliance og avslapning. Tilpasset Fra Lomivorotov et al. 2017, s. 293
lv ystolisk dysfunksjon
venstre ventrikkel (Lv) systolisk dysfunksjon (eller deprimert lv ejeksjonsfraksjon ) er den vanligste patofysiologiske mekanismen sett hos LoHF-pasienter. Sirkulasjonsvariabler som påvirker LV systolisk funksjon er forspenning, etter belastning og kontraktilitet . VANLIGVIS er lv systolisk dysfunksjon en konsekvens av tap eller reduksjon av funksjonelle kardiomyocytter som følge av nekrose på grunn av nedsatt koronar sirkulasjon og iskemi, reperfusjonsskade eller det mindre forstått naturlige fenomenet kardiomyocytapoptose . Tapet av funksjonelle kardiomyocytter kan være forbigående sett under myokardinfarkt definert som et levedyktig myokardium reddet av koronar reperfusjon, som utviser langvarig post-iskemisk dysfunksjon etter reperfusjon . Tapet av funksjonell kardiomyocyt kan også være ildfast mot reversering under forhold som infeksjon; takykardi; valvulær sykdom; metabolske forstyrrelser som acidose, hypoglykemi, hypokalsemi; eksponering for miljøhjertetoksiner og kjemikalier; idiopatisk dilatert kardiomyopati (DCM); og genetiske lidelser som familiær DCM, hypertrofisk kardiomyopati og muskeldystrofier . Nedsatt hjerte respons på forspenning fører til en dramatisk reduksjon I CO og oksygen levering til andre viktige organer i kroppen, forhøyet atrial trykk, kapillær kile trykk, og kardiogent lungeødem. Selv om kompenserende ENDRINGER i LV tilpasser seg relativt høyt systemisk arterielt trykk, kan signifikant økning i afterload indusere LV systolisk dysfunksjon .
LV diastolisk dysfunksjon
Selv om Det er mindre vanlig, Kan LoHF utvikles hos pasienter med lv diastolisk dysfunksjon med bevart LVEF. Tilstanden skyldes manglende evne til det ventrikulære kammeret til å fylle med tilstrekkelig volum blod til tross for normal forspenning, som presenterer som diastolisk dysfunksjon . Underliggende forhold som alvorlig takykardi, redusert myokardial compliance eller unormal ventrikulær avslapping svekker avslapning og fylling AV LV under diastolfasen av hjertesyklusen. På kardiomyocyttnivå er disse tilstandene forbundet med kalsiumfjerning fra cytosol og kalsiumhomeostase, tilstrekkelighet av kryssbro løsrivelse og egen funksjonell cytoskeletal elementforstyrrelse . Kryssbroavløsning kan bidra til forsinket isovolumisk avslapningstid, noe som resulterer i redusert LV-slagvolum, spesielt ved høyere HR . LV avslapping avhenger også av sarkoplasmatisk retikulær kalsiumion reopptak og nitrogenoksid signalering, som også letter kryssbro løsgjøring. Siden prosessen med kryssbroavløsning er energikrevende, kan det føre til et underskudd i myokardenergi og dermed redusere LV-myokardavsla .til tross for at diastolisk dysfunksjon er et utbredt fenomen sett hos opptil 70% av postoperative hjertepasienter, er diastolisk dysfunksjon alene utilstrekkelig til å forklare utviklingen av akutt HF. Ved innstilling av andre kliniske tilstander som atrieflimmer( AF), nedsatt koronar sirkulasjon og arteriell hypertensjon, kan diastolisk dysfunksjon resultere i dekompensert tilstand, og antas dermed å være et tidlig tegn på myokardisk iskemi . Det dynamiske forholdet MELLOM LV diastolisk og systolisk funksjon bidrar også til diastolisk dysfunksjon Hos LoHF-pasienter. Stimulering av inotrop katekolamin påvirker både diastol og systol, og kan forbedre diastolisk dysfunksjon. Deprimert LVEF fører til en økning i slutt-systolisk volum og forlenger den diastoliske fasen av hjertesyklusen .
RV dysfunksjon
I LoHF, spesielt etter koronararterie kirurgi, prinsippet patofysiologiske mekanismer FOR RV dysfunksjon inkluderer økt forspenning, økt afterload, svekket høyre koronar perfusjon og redusert kontraktilitet . I motsetning til venstre koronararterie oppstår perfusjonen av høyre kranspulsår under både diastol og systol. Tilstedeværelsen AV PH forårsaker en økning I RV-trykk som fører til redusert høyre koronararterieperfusjon, noe som forklarer betydningen for å gi optimal venstre og høyre kransløpssirkulasjon . HOS pasienter som har gjennomgått kranspulsoperasjon, KAN RV dysfunksjon utvikles som følge av en kombinasjon av mekanismer. Perioperativ RV iskemi og infarkt er de viktigste årsakene til svekket RV kontraktilitet. Trikuspidal eller pulmonal regurgitasjon er vanlige årsaker til økt volumforspenning mens venstre sidet valvulær sykdom eller kardiomyopati, PH eller lungeemboli( PE), akutt respiratorisk nødsyndrom og høyt positivt trykkventilasjon er vanlige årsaker til trykkoverbelastning . SIDEN RV normalt tillater lavtrykksperfusjon av lungevaskulaturen, er den svært følsom selv til moderate økninger i lungearterietrykket (PAP). RV svikt kan utvikle seg i innstillingen AV PH eller nedsatt kontraktilitet assosiert med en rask progresjon AV RV dilatasjon fører til økt endediastolisk RV trykk . Disse fysiologiske endringene kan forårsake inter-ventrikulær septumforskyvning mot et ALLEREDE underfylt LV-kammer og dermed forårsake en reduksjon I LV-forspenning og en reduksjon I CO .
Risikofaktorer
Risikofaktorer for LoHF forblir et under-undersøkt område. Lite data tilgjengelig fra kliniske studier på HF og fra postoperative LCOS-pasienter gir imidlertid verdifull innsikt i risikofaktorer og prediktorer For LoHF. I analysen av 452 pasienter innlagt på sykehus med dekompensert HF og lav hjerteutgang, var signifikante risikofaktorer For LoHF Chagas sykdom (Relativ risiko : 3,66), deprimert ejeksjonsfraksjon (RR: 2,41), hyponatremi (RR: 1,62) og nedsatt nyrefunksjon (Rr: 1,92) . Risikofaktorer for postoperativ LoHF inkluderer nedsatt LV-funksjon (< 50%), CABG på pumpen, nød-eller kardiopulmonal bypass (CPB) kirurgi, ufullstendig revaskularisering ,alder > 65 år, og en kombinert forekomst av diabetes mellitus og preoperativ nyresvikt . I tillegg til pasient-og operasjonsrisikofaktorer er biokjemiske prediktorer For LoHF hos postoperative pasienter lave hemoglobinnivåer, totalt lymfocyttall < 2000 celler/µ, og preoperative nivåer av serum natriuretiske peptider . I løpet av de siste to tiårene har det vært endringer i trender i noen anerkjente risikofaktorer. Faktorer som hypertensjon, kvinnelig kjønn, trippelkar sykdom og venstre hovedsykdom er ikke lenger statistisk signifikante, mens risikoen forbundet med deprimert preoperativ ejeksjonsfraksjon er doblet .
Diagnose
Det er ingen konsensusretningslinjer eller påviste diagnostiske kriterier for LoHF-pasienter. I tillegg er kliniske tegn og symptomer ikke-spesifikke. I fravær av standardiserte retningslinjer, er diagnosen vanligvis avhengig av akseptert samling av hemodynamiske og fysiologiske avvik som er nyttige for å øke klinisk mistanke om LoHF . Diagnose Av LoHF alene er ofte ikke nok. Årsaken til lavutgangstilstanden må også etableres. I noen årsaker til lav utgang tilstand SOM PE eller MI, behandling av den underliggende årsaken er det viktigste hensynet, og dermed er det viktig å gjøre diagnosen. Siden LoHF-pasienter ofte er ustabile, er det også vanlig at klinisk evaluering, diagnose og behandling skjer samtidig mer i akutte omsorgsinnstillinger .
Tegn og symptomer
Lav minuttvolum da det presenterende trekk ved akutt dekompensert HF er mindre vanlig, og påvirker kun 8,9 til 9,6% av PASIENTER med HF på sykehus . LoHF kan dele mange kliniske trekk med CHF, men det er bemerkelsesverdige forskjeller som kan støtte eller veilede etterfølgende diagnostiske beslutninger. Overdreven tretthet og økt treningsintoleranse er viktige første tegn som Ble lagt merke Til Av LoHF-pasienter selv før diagnosen . I Tillegg Er LoHF-pasienter ofte til stede med agitasjon, forvirring og / eller redusert bevissthetsnivå, kalde / vasokonstrikterte periferier eller forsinket kapillær påfyllingstid, hypotensjon, takykardi eller bradykardi, thready puls, forhøyet jugulært venetrykk, åndenød og hypoksemi og oliguri / anuri . Disse tegnene og symptomene kan variere mellom lav perfusjon og overbelastning hos HF-pasienter (Tabell 2).
Tabell 2. Symptomer og tegn på lav perfusjon vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: ESC-retningslinjene for diagnostisering og behandling av HF 2016 legger vekt på viktigheten av å få detaljert pasienthistorie og fysisk undersøkelse på alle pasienter mistenkt FOR Å ha HF . Detaljert historie fra pasienten, eller slektning og venner hvis pasienten er for uvel, bør fokusere på å skaffe informasjon om symptomer, tidligere og nåværende hjerte-og ekstrakardiale forhold som kan utløse ELLER forverre HF, eksponering for risikofaktorer FOR HF eller lav utgang tilstand, og medisinering historie for tidligere og nåværende medisinske tilstander . I tillegg til pasientens anamnese anbefales fysisk undersøkelse til Alle LoHF-pasienter for å vurdere for kliniske indikatorer for hemodynamisk, perifer perfusjon, overbelastning, underliggende etiologi og valvulær patologi. Hemodynamiske parametere av interesse inkluderer blodtrykk, HR og hjerterytme, galopprytme, oksygenmetning og respiratorisk hastighet . Tester for perifer perfusjon bør inkludere bevissthetsnivåer,perifer hud / sentral temperatur, kapillær påfyllingstid og urinutgang. Tester for lunger omfatter forhøyet venetrykk i halsvenene, perifert / pulmonalt ødem, hepatomegali, ascites og pleural effusjon. Tester for underliggende etiologi bør inkludere kardiovaskulær undersøkelse, og hjerte lyd og bilyd. Endelig bør bevis for valvulær dysfunksjon inkludere perikardial rub og bevis på perikardial effusjon med eller uten hjerte tamponade .kombinasjonen av pasienthistorikk og fysisk undersøkelse har vist seg uvurderlig i vurderingen av hemodynamisk status og anerkjennelse Av LoHF . I 1976, Forrester et al. gjennomført fysisk undersøkelse av pasienter med akutt hjerteinfarkt og identifisert fire hemodynamiske profiler (A, B, L og C) som illustrert I Figur 2. Hemodynamiske profiler er basert på tilstedeværelse eller fravær av lungetetthet (lungekapillær kiletrykk > eller ≤ 18 mmHg) og adekvat perfusjon (CI > 2,2 L / min / m2). Profil A representerer ingen congestion / hypoperfusjon; profil b congestion uten hypoperfusjon; Profil C congestion uten congestion; Og Profil L congestion og hypoperfusjon . LoHF pasienter faller inn Under Profiler L og C (hypoperfusion ± overbelastning basert På Nohria et al. demonstrasjon At Profil L og C har en GJENNOMSNITTLIG KI på henholdsvis 1,6 L/min/m2 og 1,9 L/min/m2.
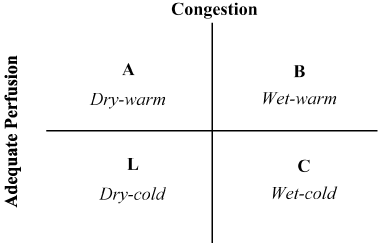
figur 2. Skjematisk fremstilling av den kliniske profilen for akutt dekompensert hjertesvikt
Congestion vurderes ved tilstedeværelse av orthopnoea, distensjon i vena jugularis, pulmonal rales, hepatojugulær refluks, ascites, perifert ødem, abdominal refluks og Valsalva kvadratbølge. Lav perfusjon ble vurdert ved tilstedeværelse av et smalt pulstrykk, pulsusendringer, kalde ekstremiteter, kanskje søvnige, synkende serumnatriumnivåer og forverret nyrefunksjon. Tilpasset Fra Nohria, et al.
Elektrokardiogram (EKG): BÅDE AHA-og ESC-retningslinjer for HF anbefaler at elektrokardiogram (EKG) utføres så tidlig som mulig hos alle pasienter som mistenkes FOR Å ha HF. EKG kan demonstrere en rekke abnormiteter og er svært lite sannsynlig å være normal hos HF-pasienter. Det kan også gi bevis for underliggende etiologi av hjertedysfunksjon, inkludert bradykardi, atrioventrikulær blokk, sinus takykardi, atrial eller ventrikulær takyarytmi, iskemi, lv hypertrofi og lavspenningskomplekser .Grunnleggende laboratorietester: AHA-og ESC hf-retningslinjene anbefaler også grunnleggende laboratorietester i den første kliniske evalueringen for å støtte diagnosen HF eller årsaken til lavutgangstilstanden. Blodprøver bør utføres hos alle mistenkte HF-pasienter. Hemoglobin (hb > 10 g / dL) indikerer optimal oksygentilførsel til vev), kronisk anemi er vanlig ved kronisk HF og markert økte hvite blodlegemer øker mistanken for alternativ diagnose. Tester for serumelektrolytt for å bestemme nivåer av kalium, magnesium og kalsium. Urea og kreatinin tester for å vurdere renal hypoperfusjon og dysfunksjon vanlig I HF. Tester for nedsatt leverfunksjon, noe som tyder på nedsatt RV og / eller levertetthet. Glukosetest for å vurdere for hypoglykemi som kan svekke hjertefunksjonen. Skjoldbrusk funksjonstester for hypo – eller hyper-thyroidisme som kan forårsake indre hjerteinfarkt. Endelig tester for serum natriuretiske peptider hvis forhøyede nivåer indikerer økt ventrikulær veggspenning, men som ikke oppdager brå endringer i ventrikulær fyllingstrykk på grunn av deres lange halveringstid .cardiac imaging tester: Cardiac imaging spiller en sentral rolle i diagnostisering AV HF, samt i overvåking og guiding terapi. Ekkokardiografi er den foretrukne modaliteten på grunn av nøyaktighet, tilgjengelighet, sikkerhet og kostnadseffektivitet . Det kan suppleres med andre avbildningsmodaliteter valgt ut fra evnen til å svare på spesifikke kliniske spørsmål mens man vurderer kontraindikasjoner og risiko .Ekkokardiografi: Ekkokardiografi anbefales sterkt for alle mistenkte pasienter på grunn av sin evne til å bekrefte eller utelukke klinisk diagnose Av LoHF, for å vurdere SV og dens variasjoner, og for å bestemme årsaken til lavutgangsstatus . Transtorakal ekkokardiografi bør utføres så snart som mulig etter klinisk diagnose av lavt minuttvolum. Ikke bare måler det omfanget av systolisk og diastolisk dysfunksjon, det gir også verdifull informasjon om ventrikulær morfologi, valvulær dysfunksjon, myokardial og perikardial sykdom og regionale veggbevegelsesavvik . Ekkokardiografi evaluerer systolisk funksjon ved å måle LEVF, hvor> 45-50% regnes som normalt. På den annen side evalueres diastolisk funksjon ved hjelp av mitral i strømningsmønstre, lungevenestrøm og Vevdoppler ved mitral-ringrommet, MENS CO og SV evalueres ved Hjelp Av Doppler-prinsippet. Pulmonal arterie trykk (PAP) kan estimeres ved å måle regurgitate jet hastighet. Høy PAP i nærvær av dilatert RV med septal utflating eller bukker inn I LV indikerer akutt økning I RV trykkøkning klinisk mistanke OM PE som årsak til lav produksjon tilstand .
Brystrøntgen: Brystrøntgen kan vurderes hos pasienter med Mistanke Om LoHF. Viktige indikatorer som bør vurderes for vurdering inkluderer forstørret hjerte som indikerer kardiomegali eller lv hypertrofi; pulmonal venøs overbelastning som indikerer forhøyet lv-fyllingstrykk; og pleural effusjon som indikerer forhøyet LV trykk, lungeemboli eller post-hjertekirurgi (.
Koronar angiografi: Indikasjoner for koronar angiografi hos LoHF-pasienter bør være i samsvar med anbefaling av relevante konsensusretningslinjer for HF . HOS HF-pasienter med brystsmerter og tegn PÅ HJERTEINFARKT MED ST-elevasjon (STEMI) PÅ EKG, bør revaskularisering ved bruk av primær perkutan koronar intervensjon utføres så snart som mulig. Koronar angiografi bør også vurderes hos pasienter med post-hjertestans av iskemisk etiologi, når det er tegn PÅ HF og hos pasienter som har gjenopprettet fra lavutgangsstatus når årsaken ikke er bestemt .
Klinisk behandling
Tilstedeværelsen Av LoHF representerer en svært høyrisiko tilstand som krever rask behandling, men mangler standardiserte retningslinjer for klinisk behandling . Følgelig vurderer klinikere normalt individuell patofysiologi for å velge den mest hensiktsmessige behandlingsstrategien . HOS akutte LoHF-pasienter anbefaler 2016 esc hf-retningslinjene bruk av hemodynamiske profiler (basert på tilstedeværelse eller fravær av overbelastning og tilstrekkelig perfusjon) for å veilede klinisk behandling . For LoHF-pasienter I Profil L (no congestion but hypoperfused) og Profil C (både congestion og hypoperfused) som er i akutt dekompensasjonstilstand, kan akuttbehandlingsmål inkludere gjenopplivende pasienter, gjenopprette oksygenering, forbedre organperfusjon og optimalisere hemodynamisk (slagvolum og CO), og løse symptomer. Andre etterfølgende mål inkluderer optimal overvåking og etablering av den underliggende årsaken til lav hjerteutgang og behandling av årsaken hvis reversibel . I dag er tilgjengelige terapeutiske mål for LoHF optimalisering av vevsoksygenering, stabilisering av sirkulasjon og behandling av reversible årsaker til lav utgangsstatus (Figur 3).
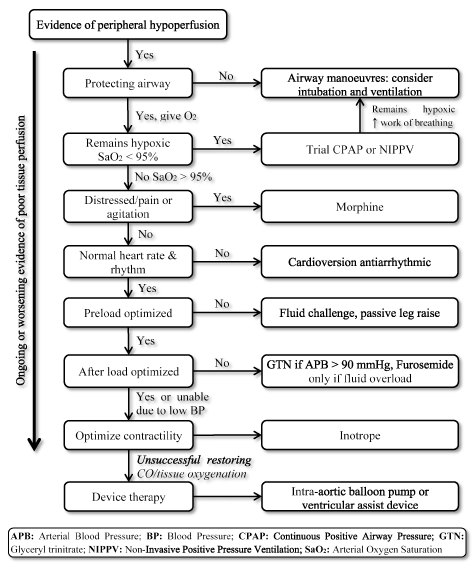
figur 3. Behandling algoritme for lav-output hjertesvikt
Behandling Av LoHF mål å forbedre vev oksygenering og stabilisere sirkulasjonen basert på pågående eller forverring symptom på vev perfusjon. Behandlingen starter med å forbedre ventilasjonen ved hjelp av tilførsel av høytflytende oksygen, kontinuerlig positivt luftveistrykk (CPAP) eller ikke-invasiv positivt trykkventilasjon (NIPPV). Hvis det ikke lykkes, blir kardioversjon eller antiarytmiske legemidler gitt for å normalisere hjertefrekvensen, væskeutfordring for å optimalisere pre-load, og / eller vasodilatorer og inotroper for å manipulere og forbedre kontraktilitet henholdsvis. Hvis tidligere ventilasjon og medisinering ikke lykkes med å gjenopprette hjerteutgang og / eller vevsoksygenering, kan enhetsterapi ved bruk av intra-aortisk ballongpumpe eller ventrikulære assistentinnretninger vurderes
Optimaliser vevsoksygenering (ventilasjonsstrategier)
Klinisk styring av LoHF-pasienter begynner ofte med vurdering av luftveier, pust og sirkulasjon for tegn på perifer hypoperfusjon. Respiratorstrategier som orofaryngeale eller nasofaryngeale luftveier er vanlige tillegg som brukes til å gjenopprette eller opprettholde luftveiene hos LoHF-pasienter med nedsatt bevissthetsnivå på grunn av redusert cerebral perfusjon. Ytterligere endotracheal intubasjon bør vurderes dersom pasienten fortsatt har kompromitterte luftveier . Hvis pasienter fortsetter å forbli hypoksiske (SaO2 < 95%), kan maksimering av oksygentilførsel ved bruk av høystrøms oksygen, kontinuerlig positivt luftveistrykk (CPAP) eller ikke-invasiv positivt trykkventilasjon (NIPPV) vurderes. Hos pasienter uten forbedring kan intubasjon eller ventilasjon vurderes .
Stabiliser sirkulasjon
Hjerteutgang (CO) er en funksjon AV HR og SV. SV avhenger i sin tur av fire sirkulasjonsvariabler-puls, forspenning, kontraktilitet og etterbelastning. Optimalisering av alle disse variablene vil forbedre CO Hos LoHF-pasienter . I klinisk setting er strategier for å øke CO avhengig av den underliggende årsaken og den berørte sirkulasjonsvariabelen . Kliniske intervensjoner inkluderer volumjustering, farmakologisk støtte og enhetsterapi.
Puls / Rytme: Som en del av kroppens fysiologiske respons øker økende HR CO. FOR rask ELLER langsom HR har en skadelig effekt PÅ CO. Hos LoHF-pasienter med takykardi (for rask hvile HR > 100 bpm) som er fortvilet, rastløs og dyspnoeic, kan morfin administreres for å lindre dyspnø, smerte og agitasjon, så vel som det er en mild venodilator for å redusere afterload, spesielt HOS CPAP-eller nippv-pasienter . HVIS HR< 40 bpm med tegn på hemodynamisk kompromiss og/eller nedsatt CO, bør medisiner som øker HR (atropin og antikolinergika) eller intervensjoner som transkutan/transvenøs pacing utføres. Urgent elektrisk kardio bør vurderes i utvalgte LoHF med ventrikulær / supraventrikulær takykardi eller rask AF med tegn på kardiovaskulær kompromiss .
Optimaliser preload (Volumjusteringer): Måling av preload er avgjørende for optimalisering. Det anbefales hos pasienter med kliniske tegn på svekket perifer perfusjon. En væskeutfordring bør utføres for å vurdere forspenningsrespons. Hurtig infusjon av 250 ml væske (krystalloid eller kolloid) i over fem minutter og objektivt vurdere effekten PÅ SV. Hvis effekten er en økning eller reduksjon > 10%, bør pasienten fortsette å motta væskeboluser for å optimalisere forspenningen til de ikke lenger reagerer på væske . For pasienter med tegn på overbelastning og lungeødem som ikke trenger væskebolus, kan en passiv benforhøyelse gjøres-løfte pasientens ben til 45 grader for å utelukke behovet for væskeutfordring. Hvis responsen hvis gunstig en reell væske utfordring kan gis .
Manipuler afterload( Farmakologisk støtte): Afterload er motstanden mot hvilken ventrikkelen utkaster blod, til tider estimert SOM SVR. Afterload bør reduseres hos LoHF-pasienter med høy afterload, lav CO, tegn på dårlig perifer perfusjon og lungeødem. Farmakologisk støtte ved bruk av vasodilatorer bør gis Til LoHF-pasienter med systolisk BP ≥110 mmHg. Hos pasienter med systolisk BP< 90 mmHG og gjennomsnittlig arterielt trykk< 65 mmHg anbefales ikke vasodilatorer på grunn av risikoen for hypotensjon, noe som kan komplisere organperfusjon. Hos disse pasientene anbefales inotroper som første behandlingslinje .
Forbedre kontraktilitet (Farmakologisk støtte): Hvis pasienten vedvarer med tegn på vevshypoperfusjon eller redusert oksygentilførsel til tross for intervensjoner for hjertefrekvens, forspenning og etterbelastning, bør behandling for å forbedre kontraktilitet vurderes. I mellomtiden bør optimalisering av oksygentilførsel fortsette å sikte mot hemoglobin ≥10 g / dl og sikre optimal oksygenmetning (SaO2). Faktorer som påvirker myokardial kontraktilitet er hyperkalemi, hypomagnesemi, hypokalsemi, alvorlig acidose, hypoksi og hypoglykemi, som må korrigeres. Inotroper anbefales for å forbedre kontraktiliteten og DERETTER CO Hos LoHF-pasienter med lavt BP og / eller lavt CI i nærvær av tegn på dårlig perifer perfusjon eller overbelastning . Farmakologisk støtte Ved Bruk Av Dobutamin (en inotrope) bør imidlertid brukes med forsiktighet hos pasienter som har takykardi eller AF fordi det øker AV-knutens ledning og kan utfelle raske ventrikulære rytmer . På den annen side anbefales levosimendan hos LoHF-pasienter med akutt myokardisk iskemisk eller postkardialkirurgi siden det ikke øker myokardisk oksygenbehov . Langsiktig effekt av inotroper kan være skadelig, og dermed bør bruken av dem stoppes når stabiliteten er oppnådd. Vasopressorer bør ikke være førstelinjemedisin i lavproduksjonstilstander da DE øker SVR og deretter svekker CO. En dobbel behandling av vasopressorer og inotrope anbefales imidlertid hos pasienter som har sepsis som den underliggende årsaken til lav produksjonstilstand .
Enhetsterapi: Enhetsterapi bør vurderes hos LoHF-pasienter når optimal medisinsk behandling ikke har lykkes med å gjenopprette CO-og vevsoksygenering. Vanlige enhetsterapier inkluderer intra-aorta ballongpumpe (iabp) og ventrikulær assistentenhet (VAD). Bruk Av IABP er vanlig Hos LoHF-pasienter med iskemisk hjertesykdom, pre-eller post-perkutan intervensjon eller postkardialkirurgi. Iabp består av en ballong satt inn i aorta gjennom lårarterien. Ballongen blåses opp under diastolen og tømmes ut under systolen for å øke diastolisk BLODTRYKK og dermed koronar perfusjon, og reduserer afterload og dermed øke CO . På den annen side er bruken AV VAD uvanlig. Den kan bare brukes i spesialiserte sentre. Det brukes ofte som en bro til hjertetransplantasjon hos pasienter med gunstig livskvalitet eller til utvinning hos pasienter med akutt myokarditt .
behandling av underliggende årsaker
noen årsaker til lav produksjonstilstand hos pasienter Med LoHF kan reverseres med spesifikke terapier. Reversible årsaker bør identifiseres tidlig under den første kliniske evalueringen. Disse årsakene inkluderer akutt myokardinfarkt, hjerte tamponade, spenningspneumothorax, lungeemboli og akutt ventilfeil . (Tabell 3).
Meta-analyse av diagnose og klinisk behandling
grunnlaget for klinisk diagnose Av LoHF har vært ekkokardiografisk bevis PÅ LV / RV systolisk dysfunksjon og / eller LV diastolisk dysfunksjon ledsaget av tegn på redusert CO og SvO2 . Hemodynamiske profiler basert på målinger av overbelastning og perfusjon har blitt brukt til å klassifisere akutte HF-pasienter i fire profiler: tørr-varm (a), våt-varm (B), tørr-kald (L) og våt-kald (C) og nyttig for å identifisere LoHF-pasienter . LoHF-pasienter har blitt klassifisert I Profiler (L) og (C) basert på tilstedeværelse/fravær av overbelastning og / eller utilstrekkelig perifer perfusjon . Disse to hemodynamiske profilene har dannet grunnlaget for å velge pasienter Med LoHF i kliniske studier, samt gi enkel bedside vurdering for å hjelpe klassifisere pasienter på presentasjonstidspunktet og for å veilede valg av innledende behandling . Målet med denne metaanalysen er å samle publiserte bevis på vanlige diagnostiske egenskaper og behandlingsresultater for pasienter med LoHF.
Søkestrategi
Tre store nettbaserte databaser (PubMed, EMBASE og Cochrane) ble systematisk søkt siden oppstart til desember 2018 for studier som undersøkte diagnose og klinisk styring Av LoHF. For å unngå å overse studier som ikke nevnte LoHF i tittelen eller abstraktet, ble de første 200 relevansrangerte artiklene hentet med Et Fulltekst Google Scholar-søk inkludert. Ingen publiseringstidspunkt eller språkrestriksjoner ble brukt. Ytterligere studier ble identifisert gjennom et manuelt søk i referanselisten fra de inkluderte studiene samt fra relevante oversiktsartikler, som deretter ble underlagt inklusjonskriteriene. Søkekriteriene inkluderte populasjon av interesse (pasienter Med LoHF eller LCOS), diagnostiske tester av interesse (ekkokardiografi og hemodynamiske profiler), og intervensjon av interesse (ventilatorstrategier, volumjustering, farmakologisk støtte og enhetsterapi). Studier ble inkludert dersom de oppfylte følgende kriterier: (a) inkluderte Pasienter Med LoHF; (b) diagnostisert ved hjelp av ekkokardiografi og hemodynamiske profiler; (c) behandlede pasienter for hemodynamisk stabilisering; og (d) rapporterte behandlingsresultater. I tilfeller av studier som rapporterte duplikatdata, ble bare studien som ga det største antall pasienter inkludert. Sammendrag av konferanser, saksrapporter og oversiktsartikler ble ekskludert.
studievalg
Figur 4 illustrerer søk-og screeningsprosessen som brukes til å inkludere kvalifiserte studier. To anmeldere uavhengig screenet alle titler og sammendrag hentet fra den systematiske online søk. Abstracts som inkluderte populasjon, intervensjon og utfall av interesse ble inkludert for fulltekstsøk. I ettertid har de to anmelderne også uavhengig gjennomgått fulltekstartikler opp mot inklusjonskriteriene. I tilfeller av uoverensstemmelse ble det løst gjennom diskusjon og konsensus.

Figur 4. Flytskjema for litteratursøk og inklusjonsprosess
datainnsamling
To anmeldere hentet uavhengig ut data fra de inkluderte studiene og eventuelle avvik ble løst gjennom konsensus. Hoveddataene som ble hentet ut var ekkokardiografiske og hemodynamiske profildata, og brukt behandling og behandlingsresultat på hemodynamisk (hjerteindeks, PCWP) og mortalitet. I tillegg til disse hoveddataene hentet de to anmelderne også ut data om studiekarakteristikker, pasientkarakteristikker og oppfølgingstid(Tabell 4).
Statistisk analyse
Utfall av interesse rapportert i mer enn en studie er hjerteindeks, PCWP og dødelighet. For hvert utfall ble sammendragsstatistikk (gjennomsnittlig ± standardavvik) før og etter intervensjon trukket ut eller forskjellen mellom baseline og etter behandling. Disse sammendragsstatistikkene ble ekstrahert separat for behandling og kontroll – /placebogrupper. Diagnostiske utfall og behandlingseffekter ble målt ved forskjell i midler før og etter intervensjon og assosiert 95% konfidensintervall. Skogplott ble brukt til å visuelt undersøke heterogenitet (I2) på tvers av studier. Samlet diagnostisk og behandlingseffekt og tilhørende 95% konfidensintervall ble estimert ved bruk av fast effekt (i2 < 49%) eller tilfeldig effektmodell (I2 > 50%). P-verdi > 0,05 ble ansett som statistisk signifikant.
Resultater
studiekarakteristika
Tolv (12) randomiserte kontrollerte studier (Rct) tilfredsstilte inklusjonskriteriene. Syv (7) studier inkluderte LoHF-pasienter og de resterende fem (5) inkluderte HF-pasienter som har gjennomgått hjertekirurgi med lav minuttvolum. De fleste publiserte kliniske studier (10) undersøkte medisiner som sammenlignet effekten av ulike typer inotroper på hemodynamisk og forebygging av død: kun dobutamin, dobutamin og dopamin; levosimendan og dobutamin, og levosimendan og placebo . Av de resterende to kliniske studiene undersøkte hver vasodilator (nitroprussid) og placebo , og enhetsterapi (IABP) og inotrope (levosimendan) alene eller i kombinasjon med iapb . I alt inkluderte de 12 kliniske studiene 3738 pasienter, gjennomsnittsalder 64 år (variasjonsbredde = 55-74 år), med et flertall menn (78%).
Syntese av resultater
Diagnosedata På LoHF var inkonsekvent. På tvers av de tolv kliniske forsøkene oppsto ingen felles definisjon Av LoHF som ville vært nyttig for å veilede diagnosen. Hemodynamiske kriterier brukt for inklusjon av pasienter i studiene inkluderte KI < 2,0 L/min/m2 , KI < 2,5 L/min/m2 OG PCWP > 15 mmhg eller ≥18 mmhg . Definisjonen varierte også på tvers av studier – postoperativ tilstand med hypotensjon (systolisk BP < 90 mmHg for > 30 minutter) eller behovet for inotrop støtte for å opprettholde systolisk BP > 90 mmHg og endorganhypoperfusjon (kalde periferier, urinutgang < 30 ml/time) . Kardiogent sjokk har blitt beskrevet som et komplekst syndrom som involverer en kaskade av akutt lv dysfunksjon, redusert CO, hypotensjon og vev hypoperfusjon .
Figur 5 og 6 viser skogplott for standardisert gjennomsnitt av hjerteindeks ved baseline og etter henholdsvis inotrope-eller vasodilatorbehandling. Baseline hjerteindeks økte fra gjennomsnitt på 1,93 (95% KI: 1,91-1,95) til gjennomsnitt etter behandling på 2,82 (95% KI: 2,80-2,84). Figur 7 viser en skogsplot for STANDARD gjennomsnittlig forskjell (SMD) for hjerteindeks etter behandling med levosimendan og dobutamin. Levosimendan oppnår høyere hjerteindeks sammenlignet med dobutamin (SMD: 2,82; 95% KI: 2,54-3,10). Som profylaktisk Mot LoHF hos postoperative pasienter oppnådde infusjon av levosimendan etter anestesi en høyere hjerteindeks (2,57) sammenlignet med preoperativ IABP (2,3) eller med en kombinasjon av levosimendan (2,4). Figur 8 viser en skogsplot av dødelighet mellom levosimendan og placebo. Levosimendan hadde lavere dødelighet sammenlignet med placebo (Oddsratio: 0,83; 95% KI: 0,59-1,18), men forskjellen var ikke statistisk signifikant (p=0,30). Endelig, Figur 9 viser Videre At Levosimendan har en lavere dødelighet sammenlignet med dobutamin (OR: 0,65; 95% KI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
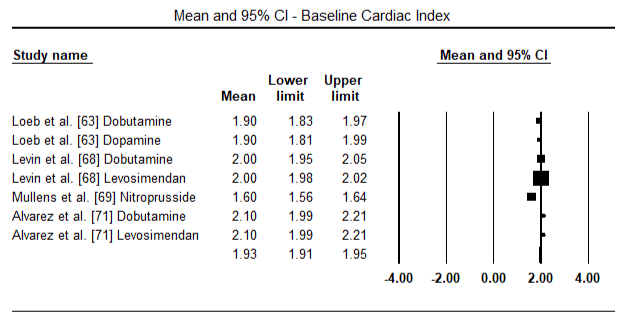
Figure 5. Mean baseline cardiac index
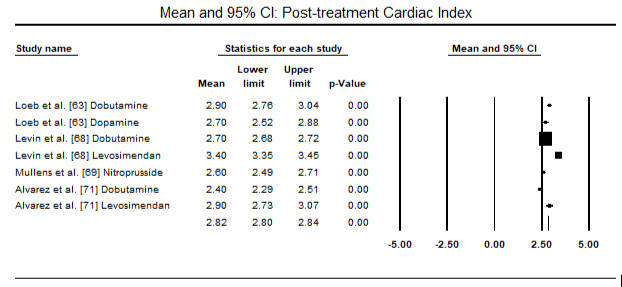
Figure 6. Mean post-treatment cardiac index
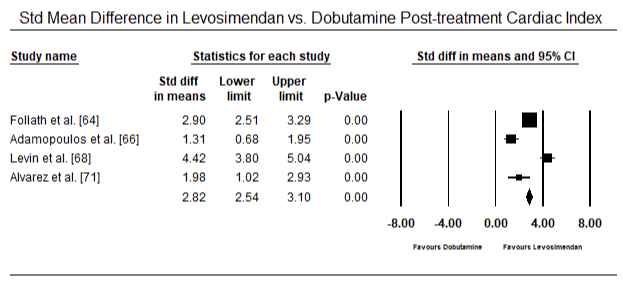
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
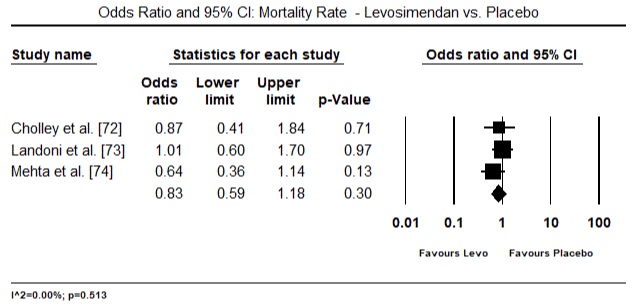
Figure 8. Mortality rate between levosimendan and placebo
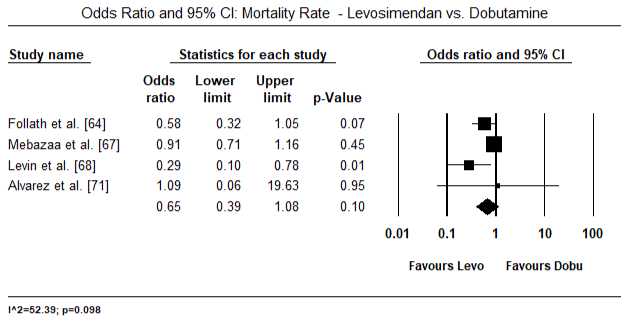
Figure 9. Dødelighet mellom levosimendan og dobutamin
Diskusjon av funn
denne systematiske oversikten og meta-analysen vurderte vanlige diagnostiske trekk og behandlingsutfall av medisinsk og utstyrsbehandling (iabp) på LoHF-pasienter. Resultatene indikerer At LoHF-pasienter mangler allment aksepterte eller standardiserte diagnosefunksjoner. Selv Om LoHF-pasienter kan vise flere funksjoner, inkludert hjerteindeks, PCWP, systolisk BP og SvO2 for å foreslå eller støtte klinisk diagnose, har alle disse funksjonene forskjellige grenseverdier på tvers av studier. Hjerteindeks, som er den vanligste kliniske funksjonen som viser lav utgangsstatus I LoHF, har tre grenseverdier: < 2,0 L / min / m2,< 2,5 l/min/m2 . Inotrop støtte dukket opp som en svært vanlig intervensjon for å forbedre perfusjon og normalisere hjerteutgang hos LoHF-pasienter.Inotrope legemidler som levosimendan, dobutamin, dopamin, vasodilator (nitroprussid) og IABP forbedret SIGNIFIKANT KI mellom baseline og etter behandling. Når det gjelder inotroper, er levosimendan mer effektiv for å forbedre hemodynamisk stabilitet og en bedre profylaktisk mot kortvarig død (30-dagers dødelighet) enn dobutamin. I tillegg kan inotroper virke som profylaktisk mot utviklingen av postoperativ LoHF. På den annen side, mens inotroper forbedrer hemodynamisk og normaliserer hjerteutgang, gir de ingen signifikant bedre beskyttelse mot dødelighet uavhengig av hvilken type inotrope som brukes.
rollen av inotroper i behandlingen Av LoHF har blitt støttet av en tidligere gjennomgang av inotrope midler og vasodilatorstrategier for behandling av kardiogent sjokk og LCOS . Gjennomgangen rapportert inotropes forbedre hemodynamiske, bivirkninger i postoperative LCOS og redusert dødelighet. Nyere inotroper som levosimendan (en kalsium sensibilisator og inodilator) er en positiv inotrope har noen vasodilatoriske egenskaper . Det kan også betraktes som en selektiv levervasodilator, som kan forbedre portalvenestrømmen via hepatisk arterie og portalvenestrøm sammenlignet med dobutamin som bare kan forbedre portalvenestrømmen uten vasodilaterende leverarterie . Levosimendan øker heller ikke myokardisk oksygenbehov og anbefales fremfor dobutamin hos LoHF-pasienter med akutt myokardisk iskemisk eller postkardialkirurgi . For postoperativ LoHF forblir den beskyttende effekten av inotroper mot korttidsdødelighet (30-dagers dødelighet) ubetydelig sammenlignet med placebo .
den nåværende systematiske oversikten og meta-analysen har noen viktige begrensninger. LoHF kan forekomme sekundært til underliggende hjertesykdom som akutt myokardinfarkt eller postoperativt. De fleste studiene inkluderte undersøkte postoperativ LoHF med færre presentasjoner Av LoHF av andre årsaker. De fleste studiene fokuserte på To inotroper (Levosimendan og dobutamin), noe som begrenser forståelsen av andre inotroper samt andre terapier som enhetsterapier. I noen studier var analysen i fare for feilklassifisering skjevhet på grunn av et betydelig antall pasienter tapt for oppfølging. Siden de fleste studiene ikke rapporterer parvis forskjell før og etter intervensjon med tilhørende standardavvik, før og etter intervensjonsforskjell med standardavvik, før og etter intervensjonsutfallsmål som uavhengige, oppnår dette siders konfidensintervaller for behandlingseffekt med tilhørende standardavvik.
Konklusjon
low-output hjertesvikt (LoHF) er et klinisk syndrom preget av redusert hjerteutgang ledsaget av endorganhypoperfusjon. Det er en uvanlig form for hjertesvikt i den generelle befolkningen, men utbredt i POST-operasjon HF pasienter. Etiologien er heterogen, bestående av ulike forhold som forårsaker lavutgangstilstand og hjertekirurgi. De viktigste patofysiologiske mekanismene er LV systolisk og / eller diastolisk dysfunksjon, OG RV dysfunksjon forårsaket av endringer i hjertefrekvens, forspenning, etterbelastning og / eller kontraktilitet. Generelle risikofaktorer for LoHF inkluderer Chagas sykdom, deprimert ejeksjonsfraksjon og nyresvikt, mens hos postoperative pasienter inkluderer nedsatt LV-funksjon, ufullstendig revaskularisering, eldre alder og tilstedeværelse av diabetes og nyresvikt. Diagnose mangler standardiserte retningslinjer og er avhengig av akseptert samling av hemodynamiske og fysiologiske avvik, inkludert forhold som forårsaker lav utgangsstatus. Pasienthistorikk og fysisk undersøkelse bidrar til å vurdere hemodynamisk status og gjenkjenne lav utgangsstatus mens ekkokardiografi bekrefter ventrikulær dysfunksjon (HF) og lav hjerteutgang. Andre tester for å støtte diagnose eller fastslå årsaken til lav utgangsstatus inkluderer elektrokardiogram og grunnleggende laboratorietester (blod, serumelektrolytt, urea og kreatinin, levertest, skjoldbruskfunksjon og serum natriuretiske peptider) og hjerteavbildning (brystrøntgen eller koronar angiografi). Behandling mangler etablerte retningslinjer, men avhenger av vurdering av individuell patofysiologi for å velge den mest hensiktsmessige behandlingsstrategien. Behandlingen inkluderer ventilatorstrategier for å forbedre hjertefrekvens og rytme; volumjustering for å optimalisere forspenning; farmakologisk støtte (inotroper og vasodilatorer) for å manipulere etterbelastning og forbedre kontraktilitet; og enhetsterapi (intra-aorta ballongpumpe eller ventrikulær assistentenhet) når disse strategiene ikke gjenoppretter hjerteutgang. Hos utvalgte pasienter kan terapier for å reversere underliggende sykdom gjenopprette hjerteutgang.
- Inamdar A, Inamdar A (2016) Hjertesvikt diagnose, ledelse og utnyttelse. J Clin Med 5: 62.
- Dassanayaka S, Jones SP (2015) Siste utviklingen i hjertesvikt. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Et al. (2012) Retningslinjer for diagnose og behandling av akutt og kronisk hjertesvikt 2012: Task Force For Diagnose og Behandling Av Akutt Og Kronisk Hjertesvikt 2012 Av European Society Of Cardiology. Utviklet i samarbeid Med Heart Failure Association (Hfa) AV ESC. Eur J Hjerte Mislykkes 14: 803-869.Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Et al. (2013) 2013 ACCF / AHA retningslinje for behandling av hjertesvikt: en rapport Fra American College Of Cardiology Foundation / American Heart Association Task Force På Praksis Retningslinjer. J Am Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 Esc Retningslinjer for diagnostisering og behandling av akutt og kronisk hjertesvikt: Arbeidsgruppen for diagnostisering og behandling av akutt og kronisk hjertesvikt I European Society Of Cardiology (ESC) Utviklet med Det spesielle bidraget Fra Heart Failure Association (HFA) I ESC. Eur Hjerte J 37: 2129-2200.
- Masse L, Antonacci M (2005) lavt hjerteutgangssyndrom: identifikasjon og styring. Crit Vare Nurs Clin 17: 375-383.
- Poppas A, Runder S (2002) Kongestiv hjertesvikt. Am J Respir Crit Omsorg Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS, Et al. (2005) Sammendrag av retningslinjene for diagnose og behandling av akutt hjertesvikt: Task Force On Acute Heart Failure Av European Society Of Cardiology. Eur Hjerte J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) Hjerteytelse og dødelighet tidlig etter intrakardiell kirurgi hos spedbarn og små barn. Opplag 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) Postoperativ kurs og hemodynamisk profil etter arteriell bryteroperasjon hos nyfødte og spedbarn: en sammenligning av lav-flow hjerte-bypass og sirkulasjons arrest. Sirkulasjon 92: 2226-2235.
- Hogue Cw Jr, Sundt t 3rd, Barzilai B, SCHECTMAN KB, Dá-Romá Vg (2001) Hjerte-og nevrologiske komplikasjoner identifiserer risiko for dødelighet for både menn og kvinner som gjennomgår koronar bypassoperasjon. Anestesiologi 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, Et al. (1996) Prediktorer av lavt hjerteutgangssyndrom etter koronar bypass. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, Et al. (2010) Epidemiologi og nye prediktorer av lavt hjerteutgangssyndrom etter isolert koronar bypass-podning. Eur Hjerte J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC, Et al. (2012) Risikofaktorer for lavt hjerteutgangssyndrom etter koronar bypass-grafting kirurgi. Braz J Cardiovasc Surg 27: 217-223.Algarni KD, Maganti M, Yau tm (2011) Prediktorer av lavt hjerteutgangssyndrom etter isolert koronar bypassoperasjon: trender over 20 år. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Behandling av lavt hjerteutgangssyndrom etter kirurgi for medfødt hjertesykdom. Curr Cardiol Rev 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, Fominskiy EV, Karaskov AM (2017) Lavt hjerteutgangssyndrom etter hjertekirurgi. J Cardiothorac Vasc Anesth31: 291-308.
- Tibby SM., Murdoch IA (2003) Overvåking av hjertefunksjon i intensiv omsorg. Arch Dis Barn 88: 46-52.
- Carcillo JA, Field AI (2002) kliniske praksisparametere for hemodynamisk støtte til pediatriske og nyfødte pasienter i septisk sjokk. Crit Vare Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, Cao DJ, Troncoso R, Et al. (2011) Det norske videnskabers selskabs skrifter. Celledød & sykdom 2: e244.
- Tavernarakis N (2007) Kardiomyocyttnekrose: alternative mekanismer, effektive inngrep. Biochimica et Biophysica Acta (BBA)-Molekylær Celleforskning 1773: 480-482.
- Dorn GW (2008) Apoptotisk og ikke-apoptotisk programmert kardiomyocyttdød ved ventrikulær remodellering. Cardiovasc Res 81: 465-473.Richard Conti C (1991) det bedøvede og dvale myokardiet: en kort gjennomgang. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012) Diastolisk hjertesvikt etter hjertekirurgi. I Koronarsykdom-Aktuelle Begreper I Epidemiologi, Patofysiologi, Diagnostikk og Behandling 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) Hvilke mekanismer ligger til grunn for diastolisk dysfunksjon i hjertesvikt? Circ Res 94: 1533-1542.Borlaug BA, Paulus WJ (2010) Hjertesvikt med bevart ejeksjonsfraksjon: patofysiologi, diagnose og behandling. Eur Hjerte J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) Er Fosfolamban eller Troponin jeg den «prima Donna» i β-adrenerg Indusert Lusitropi? Circ Res 101: 326-327. Paulus Wj, Vantrimpont PJ, Shah AM (1994) Akutte effekter av nitrogenoksid på venstre ventrikulær avslapping og diastolisk distensibilitet hos mennesker. Vurdering ved bikoronær natriumnitroprussidinfusjon. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prevalens Av Venstre Ventrikulær Diastolisk Fylling Abnorrnalities Hos Voksne Hjertekirurgiske Pasienter: En Intraoperativ Ekkokardiografisk Studie. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru A, Carrier M, et al. (2006) Biventrikulær diastolisk fyllingsmønster etter koronar bypass pode kirurgi. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone E, Bodini BD, Mazza A, Allegra L (2005) Pulmonal arteriell hypertensjon: nøkkelrollen til ekkokardiografi. Bryst 127: 1836-1843.
- Zochios V, Jones N (2014) Akutt høyre hjertesyndrom hos den kritisk syke pasienten. Hjerte lunge fartøy 6: 157-170.
- Fletcher N, Geisen M, Meeran H, Spray D, Cecconi M (2015 )Innledende klinisk erfaring med en miniatyrisert transesofageal ekkokardiografi sonde i en hjerteintensiv enhet. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) Ytelse av høyre ventrikel under stress: Forhold til høyre koronarstrøm. J Clin Investerer 50: 2176-2183.
- Pris LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Pulmonal vaskulær og høyre ventrikulær dysfunksjon i voksen kritisk omsorg: Nåværende og nye muligheter for ledelse: en systematisk litteraturgjennomgang. Crit Vare 14: R169.
- Pfisterer M (2003) Høyre ventrikulær involvering i hjerteinfarkt og kardiogent sjokk. Lancet 362: 392-394.
- Ochiai MEG, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) Prediktorer av lav hjerteutgang i dekompensert alvorlig hjertesvikt. Klinikker 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Klinisk utfall av akutt koronar bypass pode. J Koreansk Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) Prediktorer av lavt hjerteutgangssyndrom etter isolert aortaklaffkirurgi. Opplag 112: I-448.Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, Et al. (2013) Evaluering av ernæringsmessige screeningsverktøy for pasienter planlagt for hjertekirurgi. Ernæring 29: 436-442.
- Hern@ndez-Leiva E, Dennis R, Isaza D, Umañ JP (2013)Hemoglobin-og b-type natriuretiske peptid preoperative verdier, men ikke inflammatoriske markører, er assosiert med postoperativ morbiditet ved hjertekirurgi: en prospektiv kohortanalytisk studie. J Cardiothorac Surg 8: 170. lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, Et al. (2011) Preoperativt totalt lymfocyttall i perifert blod som en prediktor for dårlig utfall i voksen hjertekirurgi. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, Et al. (2009) n-terminale pro-B-type natriuretiske peptidnivåer og tidlig utfall etter hjertekirurgi: en prospektiv kohortstudie. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) Bruk Av b-type natriuretisk peptid for å forutsi postoperative komplikasjoner og utfall hos pasienter som gjennomgår hjertekirurgi. J Am Coll Cardiol 43: 1873-1879.Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, Et al. (2007) Forholdet mellom opptak serum natrium konsentrasjon og kliniske utfall hos pasienter innlagt på sykehus for hjertesvikt: en analyse FRA OPTIMIZE-HF registret. Eur Hjerte J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) sykehusdødelighet hos pasienter med akutt dekompensert hjertesvikt som krever intravenøse vasoaktive medisiner: en analyse Fra Acute Decompensated Heart Failure National Registry (ADHESIVE). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, Et al. (2000) Teamledelse av pasienter med hjertesvikt: en uttalelse for helsepersonell fra Cardiovascular Nursing Council Of American Heart Association. Opplag 102: 2443-24456.Stevenson Lw, Perloff JK (1989) den begrensede påliteligheten av fysiske tegn for å estimere hemodynamikk ved kronisk hjertesvikt. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) Klinisk vurdering identifiserer hemodynamiske profiler som forutsier utfall hos pasienter innlagt med hjertesvikt. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) Medisinsk terapi av akutt myokardinfarkt ved bruk av hemodynamiske undergrupper. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis E ,Stevenson LW (2002) Medisinsk behandling av avansert hjertesvikt. Jama 287: 628-640. Kirkpatrick Jn, Vannan MA, Narula J, Lang RM (2007) Ekkokardiografi i hjertesvikt: applikasjoner, verktøy og nye horisonter. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, Et al. (2011) Ekkokardiografisk evaluering av hemodynamikk hos pasienter med dekompensert systolisk hjertesvikt. Circ Cardiovasc Bildebehandling 4: 220-227.Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, Et al. (2015) Anbefalinger for hjertekammer kvantifisering ved ekkokardiografi hos voksne: en oppdatering fra American Society Of Echocardiography og European Association of Cardiovascular Imaging. Eur Hjerte J Cardiovasc Imaging 16: 233-271.Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, Et al. (2014) Bruk av hjerte-og karsykdommer: rapport fra litteraturgjennomgang. Eur Hjerte J Cardiovasc Imaging 16: 147-153.Gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B, Et al. (2014) Ikke-invasiv hjerteavbildningsevaluering av pasienter med kronisk systolisk hjertesvikt: en rapport Fra European Association Of Cardiovascular Imaging (EACVI). Eur Hjerte J 35: 3417-3425.
- Vazir A, Cowie MR (2012) Vurdere akutt dekompensert hjertesvikt: Strategier og verktøy. Eur Cardiol 8: 128-133.
- Grå A, Goodacre S, Newby DE, Masson M, Sampson F, et al. (2008) Ikke-Invasiv ventilasjon ved akutt kardiogent lungeødem. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008 )Hemodynamisk overvåking ved akutt hjertesvikt. Crit Omsorg Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) den intra-aorta ballongpumpen i hjertesviktbehandling: implikasjoner for sykepleiepraksis. Aust Crit Omsorg 22: 125-131.
- Slaughter MS, Singh R (2012) rollen som ventrikulære assistentenheter i avansert hjertesvikt. Revista Españ Cardiologia 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, et al. (2001) Hemodynamiske profiler av avansert hjertesvikt: forening med kliniske egenskaper og langsiktige resultater. J-Kort Mislykkes 7: 105-113.Loeb HS, Bredakis J, Gunner RM (1977) Overlegenhet av dobutamin over dopamin for forsterkning av hjerteutgang hos pasienter med kronisk lav utgang hjertesvikt. Opplag 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz H, Et al. (2002) Effekt og sikkerhet av intravenøs levosimendan sammenlignet med dobutamin ved alvorlig hjertesvikt med lav effekt (LIDO-studien): en randomisert dobbeltblind studie. The Lancet 360: 196-202 (Engelsk).Nishimura RA, Grantham JA, Connolly HM, Schaff HV, Higano ST, Et al. (2002) lav effekt, lavgradig aortastenose hos pasienter med deprimert venstre ventrikulær systolisk funksjon: den kliniske nytten av dobutaminutfordringen i kateteriseringslaboratoriet. Opplag 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) Effekter av levosimendan versus dobutamin på inflammatoriske og apoptotiske veier i akutt dekompensert kronisk hjertesvikt. Am J Cardiol 98: 102-106.Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX, Et al. (2007) Overleve Etterforskere. Levosimendan vs dobutamin for pasienter med akutt dekompensert hjertesvikt: OVERLEV Randomisert Studie. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) kalsiumsensibilisatoren levosimendan gir overlegne resultater til dobutamin i postoperativt lavt hjerteutgangssyndrom. Revista Españ De Cardiologí (engelsk utgave) 61: 471-479. mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC, Et al. (2008) Natriumnitroprussid for avansert hjertesvikt med lav utgang. J Am Coll Cardiol 52: 200-207. Lomivorotov VV, Bobosjko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, Et al. (2012) Levosimendan versus en intra-aorta ballongpumpe hos høyrisiko hjertepasienter. J Cardiothorac Vasc Anth 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, et al. (2013) en sammenligning av doubutamin og levosimendan n hepatisk blodstrøm hos pasienter med lav hjerteutgangstilstand etter hjertekirurgi: en randomisert kontrollert studie. Anaesth Intensiv Omsorg 41: 719-727.
- Colley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) Effekt av levosimendan på lavt hjerteutgangssyndrom hos pasienter med lav ejeksjonsfraksjon som gjennomgår koronar bypass-podning med kardiopulmonal bypass: DEN LICORN randomiserte kliniske studien. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, et al. (2017) Levosimendan for hemodynamisk støtte etter hjertekirurgi. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang A, et al. (2017) Levosimendan hos pasienter med venstre ventrikulær dysfunksjon som gjennomgår hjertekirurgi. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche S, et al. (2018) Inotrope midler og vasodilatorstrategier for behandling av kardiogent sjokk eller lavt hjerteutgangssyndrom. Cochrane Library. 2 : 1-10.