2.1: Ewolucja teorii atomów
teoria atomów po XIX wieku
gdyby Materia składała się z atomów, z czego by się składały Atomy? Czy były to najmniejsze cząstki, czy było coś mniejszego? Pod koniec XIX wieku wielu naukowców zainteresowanych takimi zagadnieniami badało wyładowania elektryczne, które mogą być wytwarzane w gazach niskociśnieniowych, z najbardziej znaczącym odkryciem dokonanym przez angielskiego fizyka J. J. Thomsona przy użyciu lampy elektronopromieniowej. Urządzenie to składało się z zamkniętej szklanej rurki, z której usunięto prawie całe powietrze; rurka zawierała dwie metalowe elektrody. Gdy na elektrody przyłożono wysokie napięcie, pomiędzy nimi pojawiła się widoczna wiązka zwana katodą. Wiązka ta była odchylana w kierunku ładunku dodatniego i od ładunku ujemnego i była wytwarzana w ten sam sposób z identycznymi właściwościami, gdy do elektrod stosowano różne metale. W podobnych eksperymentach promień był jednocześnie odchylany przez przyłożone pole magnetyczne, a pomiary stopnia ugięcia i natężenia pola magnetycznego pozwoliły Thomsonowi obliczyć stosunek ładunku do masy cząstek promieniowania katodowego. Wyniki tych pomiarów wykazały, że cząstki te były znacznie lżejsze od atomów (rysunek \(\PageIndex{1}\)).
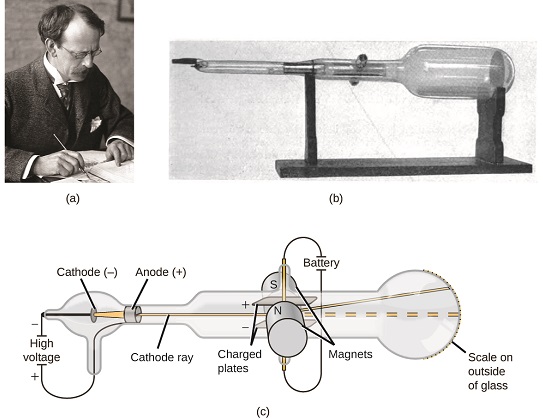
rysunek \(\PageIndex{5}\): (A) J. J. Thomson wytworzył widzialną wiązkę w lampie elektronopromieniowej. (b) jest to wczesna lampa elektronopromieniowa, wynaleziona w 1897 roku przez Ferdinanda Brauna. (c) w promieniu katodowym wiązka (pokazana na Żółto) pochodzi z katody i jest przyspieszana przez anodę w kierunku skali fluorescencyjnej na końcu rury. Jednoczesne ugięcia przez przyłożone pola elektryczne i magnetyczne pozwoliły Thomsonowi obliczyć stosunek masy do ładunku cząstek składających się na katodę. (kredyt a: modyfikacja pracy Fundacji Nobla; kredyt b: modyfikacja pracy Eugena Nespera; kredyt c: modyfikacja pracy „Kurzon” / Wikimedia Commons).
opierając się na jego obserwacjach, oto co zaproponował Thomson i dlaczego: cząstki są przyciągane przez ładunki dodatnie (+) i odpychane przez ładunki ujemne ( − ), więc muszą być naładowane ujemnie (tak jak ładunki odpychają, a w przeciwieństwie do ładunków przyciągają); są mniej masywne niż atomy i nie do odróżnienia, niezależnie od materiału źródłowego, więc muszą być podstawowymi, subatomowymi składnikami wszystkich atomów. Pomysł Thomsona, choć kontrowersyjny w tamtym czasie, został stopniowo zaakceptowany, a jego cząstka promieniowania katodowego jest tym, co teraz nazywamy elektronem, ujemnie naładowaną cząstką subatomową o masie ponad tysiąc razy mniejszej niż atom. Termin „elektron” został ukuty w 1891 roku przez irlandzkiego fizyka George ’ a Stoneya, od „electric ion.”
w 1909 roku amerykański fizyk Robert A. Millikan odkrył więcej informacji na temat elektronu w swoich eksperymentach” oil drop”. Millikan stworzył mikroskopijne kropelki oleju, które mogły być ładowane elektrycznie przez tarcie podczas ich formowania lub za pomocą promieni rentgenowskich. Krople te początkowo spadały z powodu grawitacji, ale ich postęp w dół mógł być spowolniony lub nawet odwrócony przez pole elektryczne niższe w aparacie. Dzięki regulacji natężenia pola elektrycznego oraz dokładnym pomiarom i odpowiednim obliczeniom, Millikan był w stanie określić ładunek na poszczególnych kroplach (rysunek \(\PageIndex{2}\)).
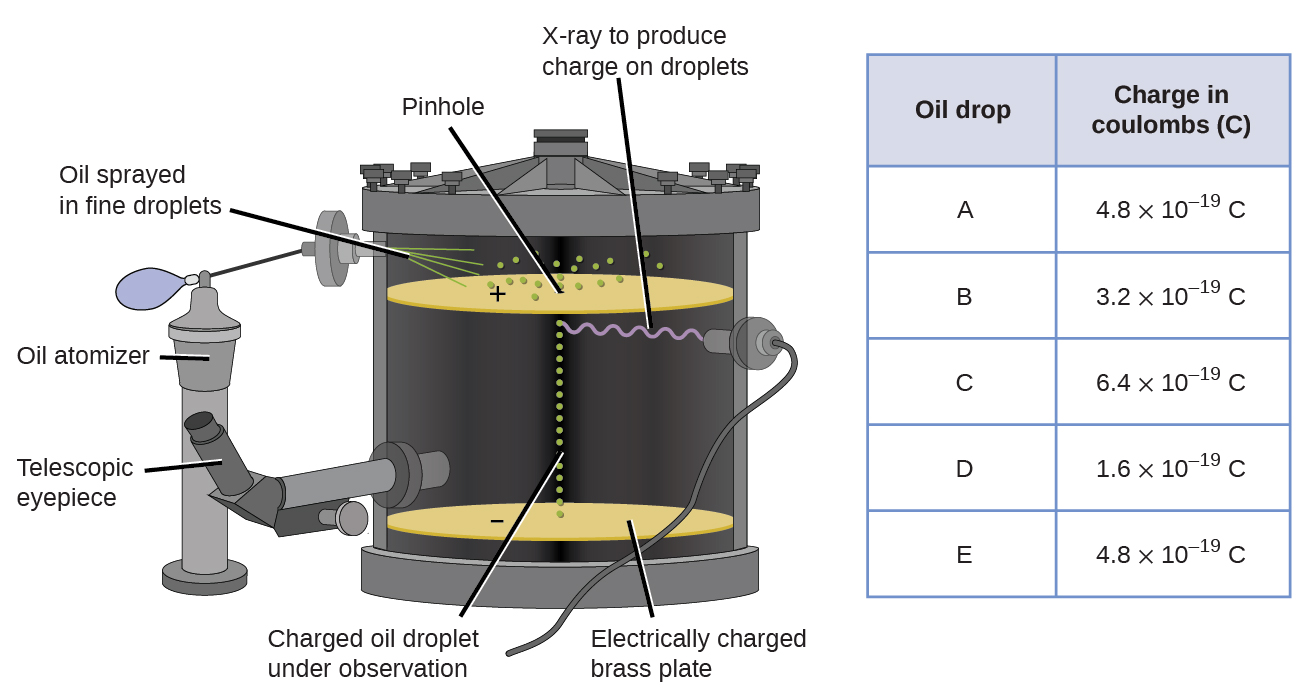
rysunek \(\PageIndex{6}\): eksperyment Millikana zmierzył ładunek poszczególnych kropli oleju. Tabelaryczne dane są przykładami kilku możliwych wartości.
patrząc na dane dotyczące ładunku, które zebrał Millikan, można zauważyć, że ładunek kropli oleju jest zawsze wielokrotnością określonego ładunku, 1,6 \(\razy\) 10-19 C. Millikan doszedł do wniosku, że wartość ta musi być zatem ładunkiem podstawowym—ładunkiem pojedynczego elektronu—z jego zmierzonymi ładunkami z powodu nadmiaru jednego elektronu (1 razy 1.6 \(\times\) 10-19 C), dwa elektrony (2 razy 1,6 \(\times\) 10-19 C), trzy elektrony (3 razy 1,6 \(\times\) 10-19 C) i tak dalej, na danej kropli oleju. Ponieważ ładunek elektronu był teraz znany dzięki badaniom Millikana, a stosunek ładunku do masy był już znany dzięki badaniom Thomsona (1,759 \(\times\) 1011 C/kg), wymagało to tylko prostego obliczenia, aby określić masę elektronu.
\
naukowcy odkryli, że atom nie jest niepodzielny, jak uważał Dalton, a dzięki pracy Thomsona, Millikana i innych, ładunek i masa ujemnych cząstek subatomowych—elektronów—były znane. Jednak dodatnio naładowana część atomu nie była jeszcze dobrze poznana. W 1904 Thomson zaproponował model atomów „plum pudding”, który opisywał dodatnio naładowaną masę z taką samą ilością ładunku ujemnego w postaci elektronów w niej osadzonych, ponieważ wszystkie atomy są elektrycznie obojętne. Konkurencyjny model został zaproponowany w 1903 roku przez Hantaro Nagaoka, który postulował atom podobny do Saturna, składający się z dodatnio naładowanej kuli otoczonej halo elektronów (rysunek \(\PageIndex{3}\)).
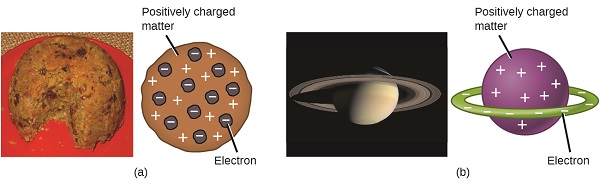
rysunek \(\PageIndex{7}\): (a) Thomson zasugerował, że atomy przypominają pudding śliwkowy, angielski deser składający się z wilgotnego ciasta z osadzonymi rodzynkami („śliwkami”). (B) Nagaoka zaproponował, że atomy przypominają planetę Saturn, z pierścieniem elektronów otaczającym pozytywną „planetę”.”(kredyt a: modyfikacja pracy Przez „Man vyi” / Wikimedia Commons; kredyt b: modyfikacja pracy przez „NASA” / Wikimedia Commons).
kolejny poważny rozwój w zrozumieniu atomu przyszedł od Ernesta Rutherforda, fizyka z Nowej Zelandii, który w dużej mierze spędził swoją karierę naukową w Kanadzie i Anglii. Przeprowadził serię eksperymentów z wykorzystaniem wiązki szybkich, dodatnio naładowanych cząstek alfa (cząstek α), które zostały wyprodukowane przez rozpad promieniotwórczy Radu; cząstki α składają się z dwóch protonów i dwóch neutronów (dowiesz się więcej o rozpadach promieniotwórczych w rozdziale na temat chemii jądrowej). Rutherford i jego koledzy Hans Geiger (później znany z licznika Geigera) i Ernest Marsden wycelowali wiązkę cząstek α, których źródło zostało osadzone w bloku ołowianym w celu wchłonięcia większości promieniowania, w bardzo cienki kawałek złotej folii i zbadali powstałe rozpraszanie cząstek α za pomocą ekranu luminescencyjnego, który świecił na krótko w miejscu uderzenia przez cząstkę α.
co odkryli? Większość cząstek przeszła przez folię bez odchylenia. Jednak niektóre z nich zostały lekko przesunięte, a bardzo mała liczba została odchylona prawie prosto w kierunku źródła (rysunek \(\PageIndex{4}\)). Rutherford opisał te wyniki: „To było najbardziej niesamowite wydarzenie, jakie kiedykolwiek przytrafiło mi się w moim życiu. To było prawie tak niesamowite, jakbyś wystrzelił 15-calową skorupę w kawałek bibułki i wrócił i uderzył cię ” 1 (s. 68).
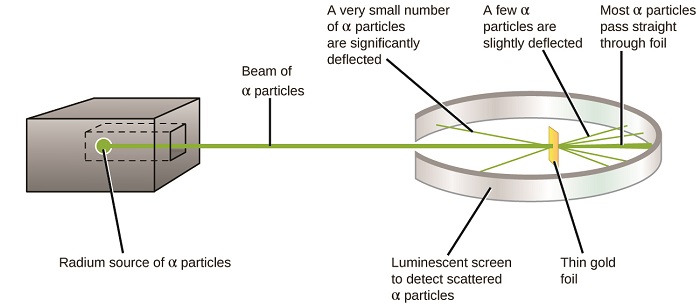
rysunek \(\PageIndex{8}\): Geiger i Rutherford wystrzelili cząstki α w kawałek złotej folii i wykryli, gdzie te cząstki się udały, jak pokazano na tym schemacie ich eksperymentu. Większość cząstek przeszła prosto przez folię, ale kilka zostało lekko odchylonych, a bardzo mała liczba została znacznie odchylona.
oto, co wywnioskował Rutherford: ponieważ większość szybko poruszających się cząstek α przechodziła przez atomy złota, musiały one podróżować przez zasadniczo pustą przestrzeń wewnątrz atomu. Cząstki alfa są naładowane dodatnio, więc ugięcia powstały, gdy napotkały inny ładunek dodatni (jak ładunki odpychają się nawzajem). Ponieważ podobne ładunki odpychają się nawzajem, kilka dodatnio naładowanych cząstek α, które nagle zmieniły ścieżki, musiało uderzyć lub zbliżyć się do innego ciała, które również miało silnie skoncentrowany ładunek dodatni. Ponieważ ugięcia występowały przez niewielki ułamek czasu, ładunek ten zajmował tylko niewielką ilość miejsca w złotej folii. Analizując szczegółowo serię takich eksperymentów, Rutherford wyciągnął dwa wnioski:
- objętość zajmowana przez atom musi składać się z dużej ilości pustej przestrzeni.
- małe, stosunkowo ciężkie, dodatnio naładowane ciało, jądro, musi znajdować się w centrum każdego atomu.
ta analiza doprowadziła Rutherforda do zaproponowania modelu, w którym atom składa się z bardzo małego, dodatnio naładowanego jądra, w którym większość masy atomu jest skoncentrowana, otoczona ujemnie naładowanymi elektronami, tak że atom jest elektrycznie neutralny (rysunek \(\PageIndex{5}\)).
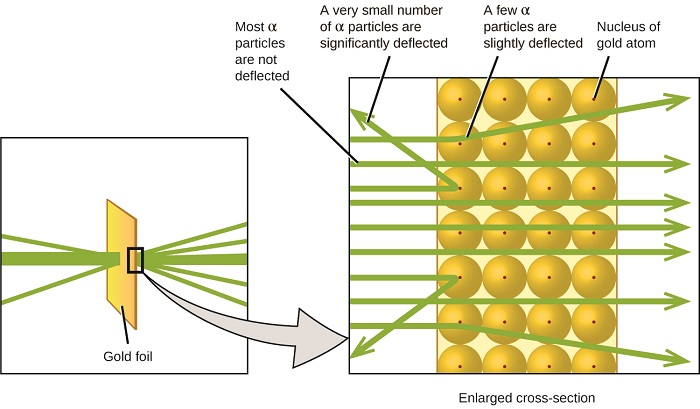
rysunek \(\PageIndex{9}\): cząstki α są odchylane tylko wtedy, gdy zderzają się lub przechodzą blisko znacznie cięższego, dodatnio naładowanego jądra złota. Ponieważ jądro jest bardzo małe w porównaniu do rozmiaru atomu, bardzo niewiele cząstek α jest odchylonych. Większość przechodzi przez stosunkowo duży obszar zajmowany przez elektrony, które są zbyt lekkie, aby odchylić szybko poruszające się cząstki.
Po wielu eksperymentach Rutherford odkrył również, że jądra innych pierwiastków zawierają jądro wodoru jako „budulec” i nazwał tę bardziej fundamentalną cząstkę protonem, dodatnio naładowaną cząstką subatomową znajdującą się w jądrze. Z jednym dodatkiem, o którym dowiecie się dalej, ten model atomowy, zaproponowany ponad sto lat temu, jest nadal używany dzisiaj.
kolejnym ważnym odkryciem było odkrycie izotopów. Na początku XX wieku naukowcy zidentyfikowali kilka substancji, które wydawały się nowymi pierwiastkami, izolując je od radioaktywnych rud. Na przykład „nowy pierwiastek” wytwarzany przez radioaktywny rozpad toru otrzymał początkowo nazwę mesothorium. Jednak bardziej szczegółowa analiza wykazała, że mezothorium było chemicznie identyczne z radem (innym produktem rozpadu), mimo że miało inną masę atomową. Ten wynik, wraz z podobnymi odkryciami dla innych pierwiastków, sprawił, że angielski chemik Frederick Soddy zdał sobie sprawę, że pierwiastek może mieć typy atomów o różnych masach, które były chemicznie nie do odróżnienia. Te różne typy nazywane są izotopami-atomami tego samego pierwiastka, które różnią się masą. Soddy otrzymał za to odkrycie Nagrodę Nobla w dziedzinie chemii w 1921 roku.
pozostała jedna zagadka: wiadomo, że jądro zawiera prawie całą masę atomu, a liczba protonów zapewnia tylko połowę lub mniej tej masy. Wysuwano różne propozycje, aby wyjaśnić, co stanowi pozostałą masę, w tym istnienie cząstek neutralnych w jądrze. Jak można się spodziewać, wykrywanie niezaładowanych cząstek jest bardzo trudne i dopiero w 1932 roku James Chadwick znalazł dowody na obecność neutronów, niezaładowanych cząstek subatomowych o masie zbliżonej do masy protonów. Istnienie neutronu wyjaśnia również izotopy: różnią się masą, ponieważ mają różną liczbę neutronów, ale są identyczne chemicznie, ponieważ mają tę samą liczbę protonów. Zostanie to wyjaśnione bardziej szczegółowo w dalszej części tej jednostki.