5.3: diagramy Lewisa
Lewis używał prostych diagramów (zwanych teraz diagramami Lewisa), aby śledzić, ile elektronów było obecnych w zewnętrznej lub walencyjnej powłoce danego atomu. Jądro atomu, tj. jądro wraz z wewnętrznymi elektronami, jest reprezentowane przez symbol chemiczny, a tylko elektrony walencyjne są rysowane jako kropki otaczające symbol chemiczny. Tak więc trzy atomy pokazane na fig. 1 z elektronów i Walencji mogą być reprezentowane przez następujące diagramy Lewisa:
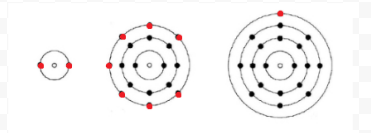

Jeśli atom jest atomem gazu szlachetnego, możliwe są dwie alternatywne procedury. Albo możemy uznać, że atom ma zerowe elektrony walencyjne, albo możemy uznać zewnętrzną wypełnioną powłokę za powłokę walencyjną. Pierwsze trzy gazy szlachetne można zapisać jako:
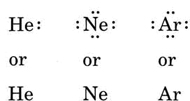
przykład \(\PageIndex{1}\): struktury Lewisa
narysuj diagramy Lewisa dla atomu każdego z następujących elementów: Li, N, F, na
rozwiązanie
z układu okresowego wewnątrz przedniej pokrywy dowiadujemy się, że Li ma liczbę atomową 3. W ten sposób zawiera trzy elektrony, jeden więcej niż gaz szlachetny He. Oznacza to, że zewnętrzna powłoka, czyli Walencja, zawiera tylko jeden elektron, a diagram Lewisa to
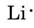
zgodnie z tym samym rozumowaniem, N ma siedem elektronów, pięć więcej niż on, podczas gdy F ma dziewięć elektronów, siedem więcej niż on, dając
![]()
Na ma dziewięć więcej elektronów niż on, ale osiem z nich znajduje się w jądrze, co odpowiada ośmiu elektronom w zewnętrznej powłoce Ne. Ponieważ Na ma tylko 1 elektron więcej niż Ne, jego diagram Lewisa to
![]()
zauważ z poprzedniego przykładu, że diagramy Lewisa metali alkalicznych są identyczne z wyjątkiem ich symboli chemicznych. Zgadza się to z bardzo podobnym zachowaniem chemicznym metali alkalicznych. Podobnie diagramy Lewisa dla wszystkich pierwiastków z innych grup, takich jak ziemie alkaliczne czy halogeny, wyglądają tak samo.
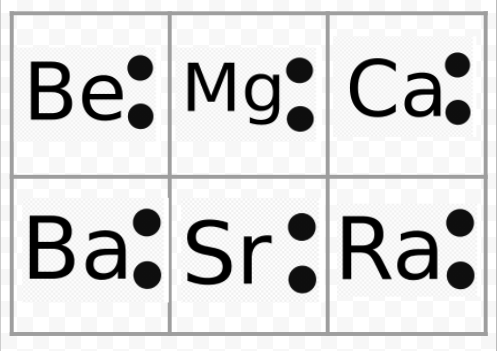
diagramy Lewisa mogą być również używane do przewidywania wartościowości elementów. Lewis zasugerował, że liczba Walencji atomu była równa liczbie elektronów w powłoce walencyjnej lub liczbie elektronów, które muszą być dodane do powłoki walencyjnej, aby osiągnąć strukturę powłoki elektronicznej następnego gazu szlachetnego. Jako przykład tej idei rozważ elementy Be I O. ich diagramy Lewisa i te gazów szlachetnych He i Ne to

porównując Be Z He, widzimy, że ten pierwszy ma jeszcze dwa elektrony i dlatego powinien mieć wartość 2. Element O może mieć wartość 6 lub wartość 2, ponieważ ma sześć elektronów walencyjnych-dwa mniej niż Ne. Korzystając z zasad Walencji opracowanych w ten sposób, Lewis był w stanie uwzględnić regularny wzrost i spadek indeksu związków w tabeli znajdującej się w sekcji Walencji i odtworzonej tutaj. Ponadto był w stanie uwzględnić ponad 50 procent wzorów w tabeli. (Te, które zgadzają się z jego pomysłami są zacienione w Kolorze w tabeli. Możesz teraz odwołać się do tej tabeli i sprawdzić, czy niektóre ze wskazanych formuł są zgodne z regułami Lewisa.) Sukces Lewisa w tym zakresie dał wyraźną wskazówkę, że elektrony były najważniejszym czynnikiem w utrzymywaniu atomów razem, gdy powstawały cząsteczki.
pomimo tych sukcesów, istnieją również trudności w teoriach Lewisa, w szczególności dla pierwiastków poza wapniem w układzie okresowym. Na przykład pierwiastek Br (Z = 35) mA o 17 więcej elektronów niż gaz szlachetny Ar (z = 18). To prowadzi nas do wniosku, że Br ma 17 elektronów walencyjnych, co sprawia, że niewygodne jest wyjaśnienie, dlaczego Br przypomina CL i F tak ściśle, mimo że te dwa atomy mają tylko siedem elektronów walencyjnych.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff i Adam Hahn.