Chemia Dla Nie-Majors
Jak zmienia się energia tego pracownika, gdy wspina się po drabinie?
wspinanie się po drabinie wymaga energii. Na każdym kroku stawiacie czoła grawitacji i gromadzicie energię potencjalną. Powrót na dół uwalnia tę potencjalną energię, gdy schodzisz krok po kroku. Jeśli nie jesteś ostrożny, możesz uwolnić tę potencjalną energię na raz, gdy spadniesz z drabiny (nigdy nie jest to dobry pomysł). Ponadto, można podjąć wspinaczkę lub zejście w krokach. Nie ma pozycji „pomiędzy” na drabinie-twoja stopa uderza w szczebel lub uderza w pustą przestrzeń i masz kłopoty, dopóki nie znajdziesz szczebla, na którym możesz stanąć.

po odkryciu widm emisji wodoru i efektu fotoelektrycznego duński fizyk Niels Bohr (1885-1962) zaproponował nowy model atomu w 1915 roku. Bohr zaproponował, że elektrony nie promieniują energii, jak orbitują jądro, ale istnieją w Stanach stałej energii, które nazwał stacjonarne Stany. Oznacza to, że elektrony orbitują w ustalonych odległościach od jądra (patrz rysunek poniżej). Prace Bohra opierały się przede wszystkim na widmach emisyjnych wodoru. Jest to również określane jako planetarny model atomu. Wyjaśniało wewnętrzne działanie atomu wodoru. Bohr otrzymał Nagrodę Nobla w dziedzinie fizyki w 1922 roku za swoją pracę.
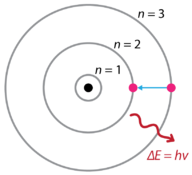
Rysunek 1. Widmo emisji wodoru w modelu atomowym Bohra.
Bohr wyjaśnił, że elektrony mogą być przemieszczane na różne orbity z dodatkiem energii. Po usunięciu energii elektrony wracają do stanu podstawowego, emitując odpowiednią ilość energii-kwant światła lub Foton. To było podstawą tego, co później stało się znane jako teoria kwantowa . Jest to teoria oparta na zasadzie, że materia i energia mają właściwości zarówno cząstek, jak i fal. Odpowiada za szeroki zakres zjawisk fizycznych, w tym istnienie dyskretnych pakietów energii i materii, zasadę nieoznaczoności i zasadę wykluczenia.
zgodnie z Modelem Bohra, często określanym jako model planetarny, elektrony okrążają jądro atomu w określonych dopuszczalnych ścieżkach zwanych orbitami. Gdy elektron znajduje się w jednej z tych Orbit, jego energia jest stała. Stan podstawowy atomu wodoru, gdzie jego energia jest najniższa, jest wtedy, gdy elektron znajduje się na orbicie, która jest najbliżej jądra. Orbity znajdujące się dalej od jądra mają kolejno większą energię. Elektron nie może zajmować żadnej z przestrzeni pomiędzy orbitalami. Codzienną analogią do modelu Bohra są szczeble drabiny. Poruszając się w górę lub w dół drabiny, możesz zajmować tylko określone szczeble i nie możesz znajdować się w przestrzeniach między szczeblami. Poruszanie się po drabinie zwiększa energię potencjalną, podczas gdy poruszanie się po drabinie zmniejsza energię.
prace Bohra miały silny wpływ na nasze współczesne rozumienie wewnętrznego funkcjonowania atomu. Jednak jego model pracował dobrze dla wyjaśnienia emisji atomu wodoru, ale był poważnie ograniczony, gdy zastosowano go do innych atomów. Wkrótce po Bohr opublikował swój planetarny model atomu, kilka nowych odkryć zostały dokonane, co spowodowało, po raz kolejny, zmieniony widok atomu.
podsumowanie
- model Bohra postuluje, że elektrony orbitują jądro na ustalonych poziomach energii.
- orbity dalej od jądra istnieją na wyższych poziomach energetycznych.
- kiedy elektrony wracają do niższego poziomu energii, emitują energię w postaci światła.
praktyka
użyj poniższego linku, aby odpowiedzieć na następujące pytania:
- Jak zmienia się Orbital elektronu?
- na czym opierał się model Bohra?
- co Bohr wierzył o orbitach?
- czy model Bohra działa dla wszystkich atomów?
Recenzja
- kiedy Bohr zaproponował swój model atomu?
- co to jest stan stacjonarny?
- co to jest stan podstawowy?
- czy elektron może zajmować dowolną przestrzeń między orbitami?
Słowniczek
- model planetarny: sposób opisu modelu atomu Bohra.
- teoria kwantowa: Materia i energia mają właściwości zarówno cząstek, jak i fal.
- stan stacjonarny: Orbita elektronów w stałej odległości od jądra.