Chemia wprowadzająca-i edycja Kanadyjska
cele nauki
- Zdefiniuj bufor.
- poprawnie identyfikuje dwa składniki bufora.
jak wskazano w punkcie 12.4 „silne i słabe kwasy oraz zasady i ich sole”, słabe kwasy są stosunkowo powszechne, nawet w żywności, którą spożywamy. Ale czasami napotykamy silny kwas lub zasadę, na przykład kwas żołądkowy, który ma silnie kwaśne pH 1,7. Z definicji silne kwasy i zasady mogą wytwarzać stosunkowo dużą ilość jonów H+ lub OH-i w związku z tym mają znaczną aktywność chemiczną. Ponadto bardzo małe ilości silnych kwasów i zasad mogą bardzo szybko zmienić pH roztworu. Jeśli do krwiobiegu Dodano 1 mL kwasu żołądkowego i nie było mechanizmu korygującego, pH krwi zmniejszyłoby się z około 7,4 do około 4,7—pH, które nie sprzyja dalszemu życiu. Na szczęście organizm ma mechanizm minimalizacji takich dramatycznych zmian pH.
mechanizm polega na buforze, roztworze, który jest odporny na dramatyczne zmiany pH. bufory robią to, składając się z pewnych par substancji rozpuszczonych: albo słabego kwasu plus sól otrzymaną z tego słabego kwasu, albo słabej zasady plus sól tej słabej zasady. Na przykład bufor może składać się z rozpuszczonego HC2H3O2 (słaby kwas) i NaC2H3O2 (sól otrzymana z tego słabego kwasu). Innym przykładem buforu jest roztwór zawierający NH3 (słabą zasadę) i NH4Cl (sól otrzymaną z tej słabej zasady).
użyjmy bufora HC2H3O2/NaC2H3O2 aby zademonstrować jak działają bufory. Jeśli do roztworu buforowego zostanie dodana mocna zasada—źródło jonów OH−(aq)—te jony OH− będą reagować z HC2H3O2 w reakcji kwasowo-zasadowej:
HC2H3O2(AQ) + OH−(AQ) → H2O(ℓ) + C2H3O2−(AQ)
zamiast radykalnie zmieniać pH, czyniąc roztwór zasadowym, dodane jony OH− reagują, tworząc H2O, więc pH nie zmienia się zbytnio.
Jeśli do roztworu buforowego zostanie dodany silny kwas—źródło jonów H+, jony H+ będą reagować z anionem z soli. Ponieważ HC2H3O2 jest słabym kwasem, nie jest zbyt zjonizowany. Oznacza to, że jeśli wiele jonów H+ i jonów C2H3O2− są obecne w tym samym roztworze, połączą się one w celu wytworzenia HC2H3O2:
h+(aq) + C2H3O2−(AQ) → HC2H3O2(AQ)
zamiast radykalnie zmieniać pH i sprawić, że roztwór będzie kwaśny, dodane jony H+ reagują, tworząc cząsteczki słabego kwasu. Rysunek 12.2 „działania buforów” ilustruje oba działania bufora.
rysunek 12.2 działanie buforów
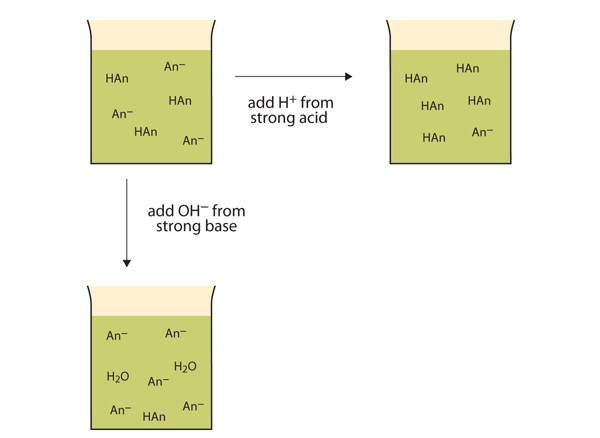
bufory mogą reagować zarówno z silnymi kwasami (Góra), jak i silnymi zasadami (strona), aby zminimalizować duże zmiany pH.
podobnie działają bufory wykonane ze słabych zasad i soli słabych zasad. Na przykład, w buforze zawierającym NH3 i NH4Cl, cząsteczki NH3 mogą reagować z dowolnym nadmiarem jonów H+ wprowadzanych przez silne kwasy:
NH3(aq) + H+(AQ) → NH4+(AQ)
, podczas gdy jon NH4+(AQ) może reagować z dowolnymi jonami OH− wprowadzonymi przez silne zasady:
NH4+(AQ) + OH−(AQ) → NH3(AQ) + H2O(ℓ)
przykład 15
które kombinacje związków mogą stworzyć roztwór buforowy?
- Hcho2 i NACHO2
- HCl i NaCl
- CH3NH2 i CH3NH3Cl
- NH3 i NaOH
roztwór
- HCHO2 jest kwasem mrówkowym, słabym kwasem, podczas gdy NACHO2 jest solą wytworzoną z anionu słabego kwasu (jonu mrówczanowego ). Połączenie tych dwóch substancji tworzy roztwór buforowy.
- HCl jest silnym kwasem, a nie słabym kwasem, więc połączenie tych dwóch substancji rozpuszczonych nie tworzy roztworu buforowego.
- CH3NH2 to metyloamina, która jest jak NH3 z jednym z jej atomów H podstawionym grupą CH3. Ponieważ nie jest wymieniony w Tabeli 12.2 „Silne kwasy i zasady”, możemy założyć, że jest to słaba zasada. Związek CH3NH3Cl jest solą wytworzoną z tej słabej zasady, więc połączenie tych dwóch substancji rozpuszczonych tworzyłoby roztwór buforowy.
- NH3 jest słabą bazą, ale NaOH jest silną bazą. Połączenie tych dwóch substancji nie tworzy roztworu buforowego.
Sprawdź się
które kombinacje związków mogą stworzyć roztwór buforowy?
- NaHCO3 i NaCl
- H3PO4 i NaH2PO4
- NH3 i (NH4)3PO4
- NaOH i NaCl
odpowiedzi
- nie
- tak
- nie
bufory działają dobrze tylko w przypadku ograniczonych ilości dodanego mocnego kwasu lub zasady. Po całkowitej reakcji roztworu roztwór nie jest już buforem i mogą wystąpić gwałtowne zmiany pH. Mówimy, że bufor ma pewną pojemność. Bufory, które mają więcej rozpuszczonych w nich, aby rozpocząć, mają większe pojemności, jak można się spodziewać.
ludzka krew ma system buforujący, aby zminimalizować skrajne zmiany pH. jeden bufor we krwi opiera się na obecności HCO3− i H2CO3 . Przy obecności tego bufora, nawet jeśli jakiś kwas żołądkowy miałby znaleźć drogę bezpośrednio do krwiobiegu, zmiana pH krwi byłaby minimalna. W wielu komórkach organizmu znajduje się system buforujący oparty na jonach fosforanów.
aplikacja do jedzenia i picia: Kwas, który łagodzi ból
chociaż leki nie są dokładnie „jedzeniem i piciem”, spożywamy je, więc spójrzmy na kwas, który jest prawdopodobnie najczęstszym lekiem: kwas acetylosalicylowy, znany również jako aspiryna. Aspiryna jest dobrze znana jako środek przeciwbólowy i przeciwgorączkowy (reduktor gorączki).
struktura aspiryny jest pokazana na załączonym rysunku. Część kwasowa jest okrążona; to atom H w tej części może być przekazany, ponieważ kwas Brønsteda-Lowry 'ego działa jak kwas Brønsteda-Lowry’ ego. Ponieważ nie podano go w tabeli 12.2 „silne kwasy i zasady”, kwas acetylosalicylowy jest słabym kwasem. Jednak nadal jest to kwas, a biorąc pod uwagę, że niektórzy ludzie spożywają stosunkowo duże ilości aspiryny dziennie, jego kwaśny charakter może powodować problemy w wyściółce żołądka, pomimo obrony żołądka przed własnym kwasem żołądkowym.
rysunek 12.3 Struktura molekularna aspiryny

okrężne atomy są kwaśną częścią cząsteczki.
ponieważ kwasowe właściwości aspiryny mogą być problematyczne, wiele marek aspiryny oferuje „buforowaną aspirynę”. W takich przypadkach aspiryna zawiera również środek buforujący-Zwykle MgO-który reguluje kwasowość aspiryny, aby zminimalizować jej kwaśne skutki uboczne.
tak użyteczna i powszechna jak aspiryna, została oficjalnie wprowadzona do obrotu jako lek od 1899 roku. US Food and Drug Administration (FDA), agencja rządowa odpowiedzialna za nadzorowanie i zatwierdzanie leków w Stanach Zjednoczonych, powstała dopiero w 1906 roku. Niektórzy twierdzili, że jeśli FDA została utworzona przed wprowadzeniem aspiryny, aspiryna może nigdy nie uzyskać zatwierdzenia ze względu na możliwość wystąpienia działań niepożądanych—krwawienia z przewodu pokarmowego, dzwonienie w uszach, zespół Reye ’ a (problem z wątrobą) i niektóre reakcje alergiczne. Jednak ostatnio aspiryna została reklamowana za jej działanie w zmniejszaniu zawałów serca i udarów mózgu, więc prawdopodobnie aspiryna zostanie tutaj.
najważniejsze informacje
- bufor jest rozwiązaniem odpornym na nagłe zmiany pH.
ćwiczenia
-
Zdefiniuj bufor. Jakie Dwa powiązane składniki chemiczne są wymagane do utworzenia buforu?
-
czy można stworzyć bufor łącząc mocny kwas z mocną zasadą? Dlaczego lub dlaczego nie?
-
które kombinacje związków mogą tworzyć bufor? Załóżmy roztwory wodne.
A) HCl i NaCl
b) HNO2 i NaNO2
c) NH4NO3 i HNO3
d) NH4NO3 i NH3
4. Które kombinacje związków mogą tworzyć bufor? Załóżmy roztwory wodne.
a) H3PO4 i Na3PO4
b) NaHCO3 i Na2CO3
c) NaNO3 i Ca(NO3)2
d) HN3 i NH3
5. Dla każdej kombinacji w ćwiczeniu 3, która jest buforem, należy zapisać równania chemiczne dla reakcji składników bufora, gdy dodaje się silny kwas i silną zasadę.
6. Dla każdej kombinacji w Ćwiczeniu 4, która jest buforem, należy zapisać równania chemiczne dla reakcji składników bufora, gdy dodaje się silny kwas i silną zasadę.
7. Kompletny system buforów fosforanowych oparty jest na czterech substancjach: H3PO4, H2PO4−, HPO42-i PO43 -. Jakie różne roztwory buforowe można wytworzyć z tych substancji?
8. Wyjaśnij, dlaczego NaBr nie może być składnikiem ani kwaśnego, ani zasadowego buforu.
9. Powstają dwa roztwory zawierające te same stężenia substancji rozpuszczonych. Jeden roztwór składa się z H3PO4 i Na3PO4, podczas gdy drugi składa się z HCN i NaCN. Które rozwiązanie powinno mieć większą pojemność jako bufor?
10. Powstają dwa roztwory zawierające te same stężenia substancji rozpuszczonych. Jeden roztwór składa się z NH3 i NH4NO3, podczas gdy drugi składa się z H2SO4 i Na2SO4. Które rozwiązanie powinno mieć większą pojemność jako bufor?
odpowiedzi
bufor jest połączeniem słabego kwasu lub zasady i soli tego słabego kwasu lub zasady.
a) nie
b) tak
c) nie
d) tak
3b: silny kwas: NO2− + H+ → HNO2; silna baza: HNO2 + OH− → NO2− + H2O; 3d: silna baza: NH4+ + OH− → NH3 + H2O; silny kwas: NH3 + H+ → NH4+7.
bufory mogą być wykonane z trzech kombinacji: (1) H3PO4 i H2PO4−, (2) H2PO4− i HPO42− oraz (3) HPO42− i PO43−. (Technicznie bufor może być wykonany z dowolnych dwóch elementów.)
bufor fosforanowy powinien mieć większą pojemność.