Chemia wstępna-i edycja Kanadyjska
cele nauki
- Zdefiniuj Prężność par cieczy.
- wyjaśnij pochodzenie zarówno napięcia powierzchniowego, jak i działania kapilarnego.
istnieją pewne właściwości, które mają wszystkie płyny. Płyn, który znamy najbardziej, to prawdopodobnie woda i ma takie właściwości. Inne płyny również je mają, o czym należy pamiętać.
wszystkie ciecze mają pewną część swoich cząstek o energii wystarczającej do wejścia w fazę gazową, a jeśli cząstki te znajdują się na powierzchni cieczy, robią to (rysunek 10.6 „odparowanie”). Powstawanie gazu z cieczy w temperaturach poniżej temperatury wrzenia nazywa się odparowaniem. W tych temperaturach materiał w fazie gazowej jest nazywany parą, a nie gazem; termin gaz jest zarezerwowany dla gdy faza gazowa jest fazą stabilną.
Rysunek 10.6 odparowanie

niektóre cząstki cieczy mają wystarczająco dużo energii, aby uciec z fazy ciekłej, aby stać się parą.
Jeśli dostępna objętość jest wystarczająco duża, w końcu cała ciecz stanie się parą. Ale jeśli dostępna objętość nie jest wystarczająca, w końcu niektóre cząstki pary powrócą do fazy ciekłej (rysunek 10.7 „równowaga”). W pewnym momencie liczba cząstek wchodzących w fazę parową będzie równa liczbie cząstek opuszczających fazę parową, więc nie ma żadnych zmian netto w ilości pary w układzie. Mówimy, że układ jest w równowadze. Parcjalne ciśnienie pary w równowadze nazywa się prężnością pary cieczy.
rysunek 10.7 równowaga

w pewnym momencie liczba cząstek wchodzących w fazę parową zostanie zrównoważona przez liczbę cząstek powracających do cieczy. Ten punkt nazywa się równowagą.
zrozum, że ciecz nie przestała parować. Proces odwrotny-kondensacja-zachodzi tak szybko, jak parowanie, więc nie ma netto zmiany ilości pary w układzie. Termin równowaga dynamiczna reprezentuje sytuację, w której proces nadal występuje, ale proces odwrotny zachodzi również w tym samym tempie, tak że nie ma zmian netto w systemie.
prężność pary dla substancji zależy od temperatury substancji; wraz ze wzrostem temperatury, tak samo prężność pary. Rysunek 10.8 „wykresy ciśnienia pary w stosunku do temperatury dla kilku cieczy” jest wykresem ciśnienia pary w stosunku do temperatury dla kilku cieczy. Mając zdefiniowaną prężność pary, możemy również przedefiniować temperaturę wrzenia cieczy: temperaturę, w której prężność pary cieczy jest równa ciśnieniu otoczenia. Normalną prężnością pary jest zatem temperatura, w której prężność pary wynosi 760 torr, czyli dokładnie 1 atm. Tak więc temperatura wrzenia zmienia się wraz z otaczającym ciśnieniem, co może mieć duży wpływ na gotowanie żywności na niższych lub wyższych niż normalne wysokościach. Ciśnienie atmosferyczne zmienia się znacznie wraz z wysokością.
rysunek 10.8 wykresy ciśnienia pary w stosunku do temperatury dla kilku cieczy
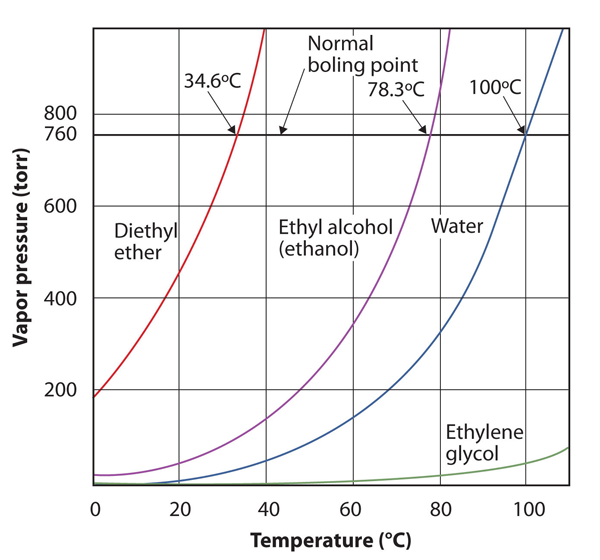
ciśnienie pary w cieczy zależy od tożsamości cieczy i temperatury, jak pokazuje ten wykres.
przykład 4
użyj rysunku 10.8 „wykresy ciśnienia pary w stosunku do temperatury dla kilku cieczy”, aby oszacować temperaturę wrzenia wody przy 500 torr, która jest przybliżonym ciśnieniem atmosferycznym na szczycie Mount Everestu.
rozwiązanie
Patrz załączony rysunek. 500 torr jest pomiędzy 400 A 600, więc wydłużamy linię od tego punktu na osi y w poprzek do krzywej dla wody, a następnie opuszczamy ją do osi x, aby odczytać związaną z nią temperaturę. Wygląda na to, że punkt na krzywej ciśnienia pary wodnej odpowiada temperaturze około 90°C, więc wnioskujemy, że temperatura wrzenia wody przy 500 torr wynosi 90 ° C.
rysunek 10.9 za pomocą rysunku 10.8 „wykresy ciśnienia pary w stosunku do temperatury dla kilku cieczy”aby odpowiedzieć na przykład 4
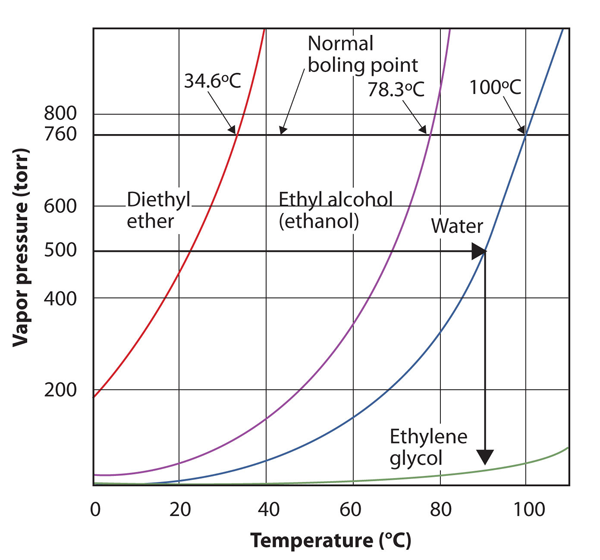
czytając poprawnie Wykres, można oszacować temperaturę wrzenia cieczy w różnych temperaturach.
Sprawdź się
użyj rysunku 10.8 „wykresy ciśnienia pary w stosunku do temperatury dla kilku cieczy”, aby oszacować temperaturę wrzenia etanolu przy 400 torr.
odpowiedź
około 65°c
krzywa prężności pary dla wody nie jest dokładnie Zerowa W temperaturze topnienia-0°C. nawet lód ma prężność pary; dlatego z czasem sublimuje. Jednak ciśnienie pary w ciałach stałych jest zwykle znacznie niższe niż w cieczach. W temperaturze -1°C ciśnienie pary lodu wynosi 4,2 torr. W temperaturze zamrażarki 0°F (-17°C) prężność pary lodu wynosi tylko 1,0 torr; tak zwane Głębokie zamrażarki mogą zejść do -23°C, gdzie prężność pary lodu wynosi tylko 0,6 torr.
diagramy fazowe
diagram fazowy jest graficzną reprezentacją relacji równowagi, które istnieją między fazami substancji pod określonymi ciśnieniami i temperaturami (rysunek 10.10). Wykres fazowy jest kombinacją trzech krzywych: krzywej prężności pary, krzywej topnienia i krzywej sublimacji. Wcześniej widzieliśmy, że krzywe ciśnienia pary reprezentują równowagę między fazą ciekłą i gazową, a punkt, w którym ciśnienie wynosi 1 atm, jest normalną temperaturą wrzenia. Dodatkową cechą tej krzywej na diagramie fazowym (zielonym) jest to, że kończy się ona w punkcie krytycznym. Punktem krytycznym jest punkt o najwyższej temperaturze i ciśnieniu, przy którym ciecze i gazy pozostają rozróżnialne. W temperaturach i ciśnieniu powyżej tego punktu Materia istnieje w fazie o właściwościach zarówno cieczy, jak i gazów znanej jako płyn nadkrytyczny.
krzywa topnienia (pomarańczowa) reprezentuje równowagę między ciałem stałym i cieczą, a punkt, w którym ciśnienie wynosi 1 atm, jest normalną temperaturą topnienia. Krzywa sublimacji (niebieska) przedstawia równowagę pomiędzy ciałem stałym i gazem. Wreszcie, punkt, w którym spotykają się wszystkie trzy krzywe, jest znany jako punkt potrójny. W tym momencie trzy fazy (ciało stałe, ciecz i gaz) istnieją w równowadze.
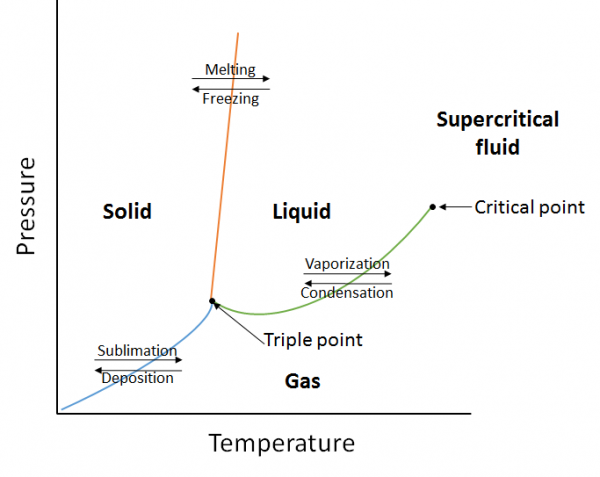
przykład:
korzystając z poniższego diagramu fazowego, określ, co by się stało, gdyby:
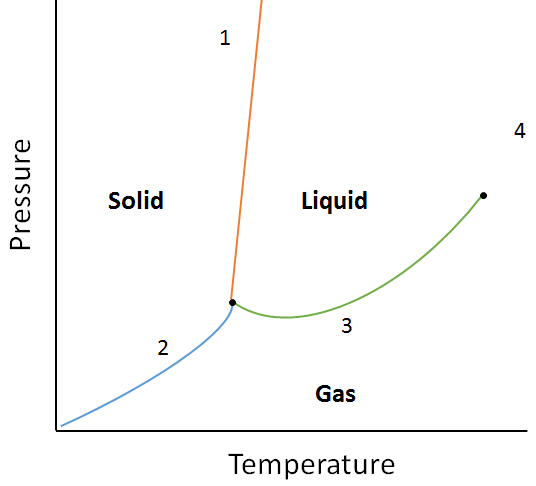
a. temperatura wzrasta dla materii w punkcie 1.
b. ciśnienie wzrasta w punkcie 3.
roztwór:
a. materia w punkcie 1 stopi się (zmienia fazę z stałej na ciekłą), jeśli temperatura zostanie zwiększona.
b. Materia w punkcie 3 skropli się (zmienia fazę z gazu na ciecz), jeśli temperatura wzrośnie.
napięcie powierzchniowe i działanie kapilarne
wszystkie ciecze mają również inne właściwości. Napięcie powierzchniowe jest efektem spowodowanym brakiem równowagi sił na atomach na powierzchni cieczy, jak pokazano na rysunku 10.11 „napięcie powierzchniowe”. Niebieska cząstka w większości cieczy doświadcza sił międzycząsteczkowych z całego otoczenia, Jak pokazują strzałki. Jednak żółta cząstka na powierzchni nie doświadcza nad nią żadnych sił, ponieważ nie ma nad nią żadnych cząstek. Prowadzi to do nierównowagi sił, które nazywamy napięciem powierzchniowym.
rysunek 10.11 napięcie powierzchniowe

napięcie powierzchniowe wynika z faktu, że cząstki na powierzchni cieczy nie doświadczają oddziaływań ze wszystkich kierunków, co prowadzi do nierównowagi sił na powierzchni.
rysunek 10.12 wpływ napięcia powierzchniowego

źródło: „mokre jabłko” Cristiana rubertiego jest na licencji Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generic.