Entalpia i reakcje chemiczne
7.3 Entalpia i reakcje chemiczne
cele nauki
- definiują entalpię.
- prawidłowo wyrażają zmianę entalpii reakcji chemicznych.
- wyjaśnij, jak zmiany entalpii są mierzone eksperymentalnie.
teraz, gdy pokazaliśmy, jak energia, praca i ciepło są powiązane, jesteśmy gotowi rozważyć zmiany energii w reakcjach chemicznych. Podstawową koncepcją jest to, że każda reakcja chemiczna zachodzi przy jednoczesnej zmianie energii. Teraz musimy nauczyć się prawidłowo wyrażać te zmiany energii.
nasze badania nad gazami w rozdziale 6 „gazy” oraz nasza definicja pracy w sekcji 7.2 „Praca i ciepło” wskazują, że Warunki takie jak ciśnienie, objętość i temperatura wpływają na zawartość energii w układzie. To, czego potrzebujemy, to definicja energii, która obowiązuje, gdy określone są niektóre z tych warunków (nieco podobna do naszej definicji standardowej temperatury i ciśnienia w naszym badaniu gazów). Określamy zmianę entalpii ciepła procesu przy stałym ciśnieniu; oznaczamy ΔH. (ΔH) jako ciepło procesu, gdy ciśnienie jest utrzymywane na stałym poziomie:
ΔH≡ciśnienie stałe qat
litera H oznacza „entalpię”, rodzaj energii, podczas gdy Δ oznacza zmianę ilości. Zawsze będziemy zainteresowani zmianą w H, a nie wartością bezwzględną samego H.
gdy zachodzi reakcja chemiczna, następuje charakterystyczna zmiana entalpii. Zmiana entalpii dla reakcji jest zwykle zapisywana po zrównoważonym równaniu chemicznym i na tej samej linii. Na przykład, gdy dwa Mole wodoru reagują z jednym molem tlenu, tworząc dwa Mole wody, charakterystyczna zmiana entalpii wynosi 570 kJ. Zapisujemy równanie jako
2H2(g) + O2(g) → 2H2O(ℓ) ΔH = -570 kJ
równanie chemiczne zawierające zmianę entalpii nazywa się równaniem termochemicznym równanie chemiczne zawierające zmianę entalpii.. Przyjmuje się, że równanie termochemiczne odnosi się do równania w ilościach molowych, co oznacza, że musi być interpretowane w kategoriach moli, a nie pojedynczych cząsteczek.
przykład 5
napisz równanie termochemiczne reakcji PCl3(G) z Cl2(G), aby uzyskać PCl5(g), który ma zmianę entalpii -88 kJ.
roztwór
równanie termochemiczne to
PCl3(G) + Cl2(G) → PCl5(G) ΔH = -88 kJ
Sprawdź się
napisz równanie termochemiczne dla reakcji N2(g) Z O2(g), aby uzyskać 2NO(g), który ma zmianę entalpii 181 kJ.
odpowiedź
N2(g) + O2(g) → 2NO(G) ΔH = 181 kJ
być może zauważyłeś, że ΔH dla reakcji chemicznej może być dodatnie lub ujemne. Przyjmuje się, że liczba jest dodatnia, jeśli nie ma znaku; znak + można dodać wyraźnie, aby uniknąć nieporozumień. Reakcja chemiczna, która ma dodatnią ΔH, jest uważana za reakcję chemiczną endotermiki, która ma dodatnią zmianę entalpii., podczas gdy reakcja chemiczna, która ma ujemną ΔH, jest uważana za egzotermiczną reakcję chemiczną, która ma ujemną zmianę entalpii..
Co to znaczy, że ΔH procesu jest dodatnia? Oznacza to, że układ, w którym zachodzi reakcja chemiczna, zyskuje energię. Jeśli ktoś uważa, że energia układu jest reprezentowana jako wysokość na pionowym wykresie energii, zmiana entalpii, która towarzyszy reakcji, może być schematycznie jak w części (a) na rysunku 7.3 „Energia reakcji”: energia reagentów ma pewną energię, a system zwiększa swoją energię, gdy idzie do produktów. Produkty są wyższe w skali pionowej niż reagenty. Endotermiczny oznacza zatem, że system zyskuje lub pochłania energię.
odwrotna sytuacja istnieje dla procesu egzotermicznego, jak pokazano w części (b) na rysunku 7.3 „Energia reakcji”. Jeśli zmiana entalpii reakcji jest ujemna, układ traci energię, więc produkty mają mniej energii niż reagenty, a produkty są niższe w pionowej skali energetycznej niż reagenty. Egzotermika oznacza zatem, że system traci lub wydziela energię.
rysunek 7.3 Energia reakcji
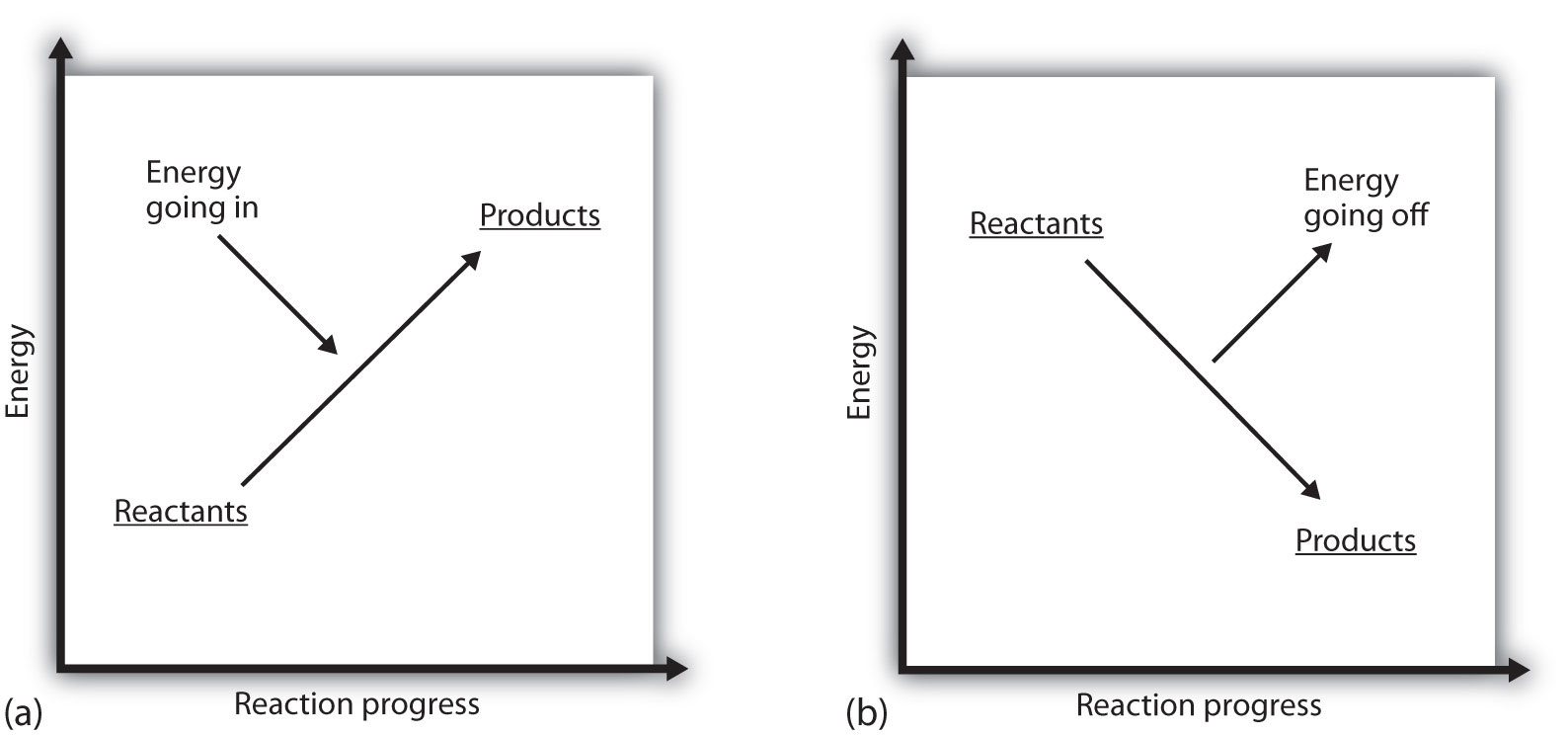
(a) w reakcji endotermicznej energia układu wzrasta (tj. przesuwa się wyżej w pionowej skali energii). b) w reakcji egzotermicznej energia układu maleje (tj. porusza się niżej w pionowej skali energii).
przykład 6
rozważ to równanie termochemiczne.
2CO(g) + O2(g) → 2CO2 (G) ΔH = -565 kJ
czy to egzotermiczne czy endotermiczne? Ile energii jest wydzielane lub pochłaniane?
roztwór
z definicji reakcja chemiczna o ujemnym ΔH jest egzotermiczna, co oznacza, że tyle energii—w tym przypadku 565 kJ—jest wydzielana przez reakcję.
Sprawdź się
rozważ to równanie termochemiczne.
CO2 (g) + H2(g) → co(G) + H2O(G) ΔH = 42 kJ
czy jest egzotermiczny czy endotermiczny ? Ile energii jest wydzielane lub pochłaniane?
odpowiedź
endotermiczne; 42 kJ są wchłaniane.
jak mierzy się wartości ΔH doświadczalnie? W rzeczywistości ΔH nie jest mierzone; Q jest mierzone. Ale pomiary są wykonywane w warunkach stałego ciśnienia, więc ΔH jest równe mierzonemu Q.
eksperymentalnie, Q mierzy się korzystając z równania
q = mcΔT
przedmierzamy masę substancji chemicznych w układzie. Następnie pozwalamy na reakcję chemiczną i mierzymy zmianę temperatury (ΔT) układu. Jeśli znamy ciepło właściwe materiałów w systemie (zazwyczaj tak jest), Możemy obliczyć q. ta wartość q jest numerycznie równa ΔH procesu, który możemy skalować do skali molowej. Pojemnik, w którym znajduje się system, jest zazwyczaj izolowany, więc każda zmiana energii przechodzi w zmianę temperatury systemu, zamiast wycieku z systemu. Pojemnik jest określany jako pojemnik calorimeterA używany do pomiaru ciepła reakcji chemicznej., a proces pomiaru zmian entalpii nazywa się kalorymetrycznym procesem pomiaru zmian entalpii dla reakcji chemicznych..
rysunek 7.4 Kalorymetry
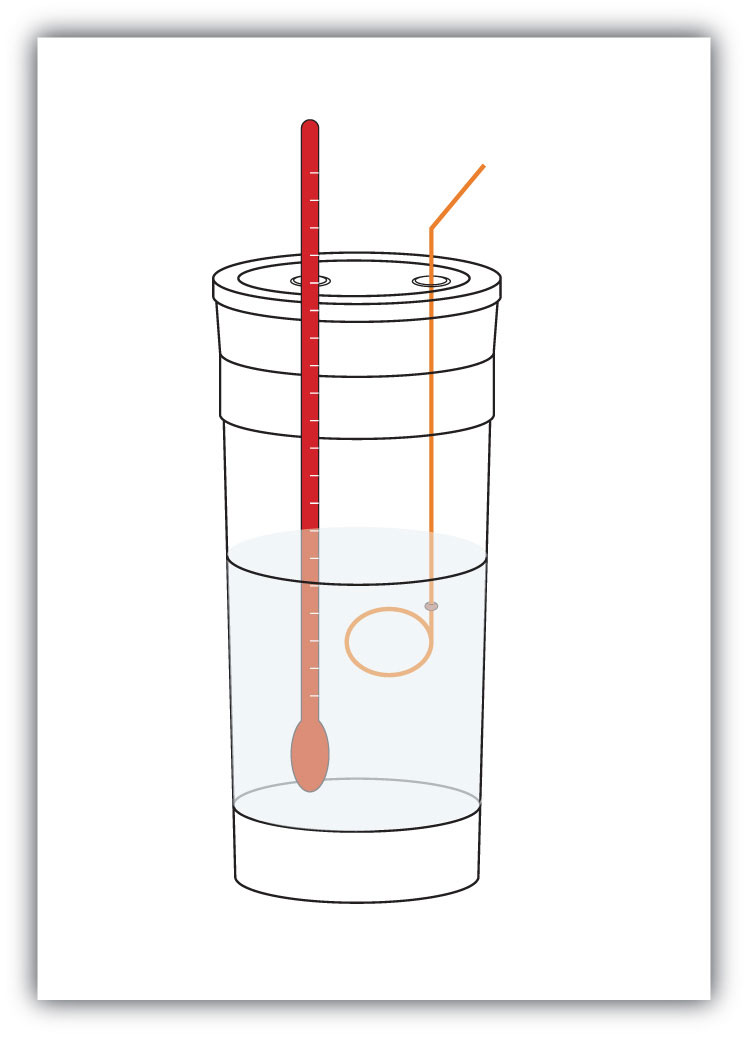
prosty kalorymetr może być zbudowany z niektórych zagnieżdżonych piankowych kubków do kawy, pokrywy, termometru i mieszadła.
na przykład załóżmy, że 4,0 g NaOH lub 0,10 mola NaOH rozpuszcza się, aby uzyskać 100,0 mL roztworu wodnego, podczas gdy 3,65 G HCl lub 0,10 mola HCl rozpuszcza się, aby uzyskać kolejne 100,0 mL roztworu wodnego. Oba rozwiązania są mieszane w izolowanym kalorymetrze, wkłada się termometr i kalorymetr jest zakryty (patrz rysunek 7.4 „Kalorymetry” dla przykładowego ustawienia). Termometr mierzy zmianę temperatury, gdy zachodzi następująca reakcja chemiczna:
NaOH (AQ) + HCl(AQ) → NaCl(AQ) + H2O(ℓ)
obserwator zauważa, że temperatura wzrasta z 22,4°C do 29,1°C. zakładając, że pojemności cieplne i gęstości roztworów są takie same jak w czystej wodzie, mamy teraz informacje potrzebne do określenia zmiany entalpii reakcji chemicznej. Całkowita ilość roztworu wynosi 200,0 mL, a przy gęstości 1,00 g / mL mamy zatem 200,0 g roztworu. Używając równania dla q, zastępujemy nasze eksperymentalne pomiary i ciepło właściwe wody(tabela 7.1 „ciepło właściwe różnych substancji”):
q=(200,0 G) (4,184 J g⋅°C) (6,7°C)
rozwiązując dla q, otrzymujemy
q=5600 J δ ΔH dla reakcji
ciepło q jest równe ΔH dla reakcji, ponieważ reakcja chemiczna zachodzi przy stałym ciśnieniu. Jednak reakcja oddaje tę ilość energii, więc rzeczywisty znak ΔH jest ujemny:
ΔH = -5600 J dla reakcji
mamy więc następujące równanie termochemiczne dla reakcji chemicznej, która wystąpiła w kalorymetrze:
110 NaOH(aq)+110 HCl(AQ)→110 NaCl(AQ)+110 H2O(ℓ)ΔH=-5600 J
współczynniki 1/10 są obecne, aby przypomnieć nam, że zaczęliśmy od jednej dziesiątej mola każdego reagenta, więc produkujemy jedną dziesiątą mola każdego produktu. Zazwyczaj jednak zgłaszamy równania termochemiczne w kategoriach moli, a nie jednej dziesiątej mola. Aby przeskalować do wielkości molowych, musimy pomnożyć współczynniki przez 10. Jednak kiedy to robimy, otrzymujemy 10 razy więcej energii. Tak więc, mamy
NaOH (AQ) + HCl(AQ) → NaCl(AQ) + H2O(ℓ) ΔH = -56 000 J
ΔH można przekształcić w jednostki kJ, więc nasze końcowe równanie termochemiczne to
NaOH (aq) + HCl(aq) → NaCl(AQ) + H2O(ℓ) ΔH = -56 kJ
właśnie wzięliśmy nasze dane eksperymentalne z kalorymetrii i ustaliliśmy wartość zmiana entalpii reakcji chemicznej. Podobne pomiary na innych reakcjach chemicznych mogą określić wartości ΔH dowolnej reakcji chemicznej, którą chcesz zbadać.
przykład 7
100 mL roztworu 0.25 mol Ca2+(aq) zmieszano z 0,50 mol jonów F−(AQ) i wytrącono CaF2:
Ca2+(aq) + 2F−(AQ) → CaF2(s)
temperatura roztworu wzrosła o 10,5°C. jaka była zmiana entalpii w reakcji chemicznej? Jaka była zmiana entalpii przy produkcji 1 mola CaF2? Załóżmy, że roztwór ma taką samą gęstość i ciepło właściwe jak woda.
roztwór
ponieważ otrzymujemy ΔT bezpośrednio, możemy określić ciepło reakcji, które jest równe ΔH:
q=(100 g)(4,184 J G⋅°C)(10.5°C)
rozwiązując dla q, otrzymujemy
q = 4,400 J
zatem ΔH = -4,400 J.
zgodnie ze stechiometrią reakcji powstanie dokładnie 0,25 mola CaF2, więc ta ilość ciepła wynosi 0,25 mola.
q = 4,400 J × 4 = 17,600 J dla 1 mola CaF2
w przeliczeniu na mol zmiana entalpii wynosi
ΔH = -17,600 J = -17,6 kJ
Sprawdź się
w kalorymetrze przy stałym ciśnieniu, 0,10 mola CH4(g) i 0,20 mola kJ
O2 (g) poddaje się reakcji.
CH4(g) + 2O2(g) → CO2 (g) + 2H2O (ℓ)
reakcja ogrzewa się 750.0 g H2O w temperaturze 28,4°C. Co to jest ΔH dla reakcji w skali molowej?
odpowiedź
-891 kJ
Najważniejsze odpowiedzi
- każda reakcja chemiczna zachodzi przy jednoczesnej zmianie energii.
- zmiana entalpii równa się ciepłu przy stałym ciśnieniu.
- zmiany entalpii można wyrazić za pomocą równań termochemicznych.
- zmiany entalpii są mierzone za pomocą kalorymetrii.
ćwiczenia
-
w jakich okolicznościach q i ΔH są takie same?
-
w jakich okolicznościach różnią się q i ΔH?
-
Gaz wodorowy i gaz chloru reagują, tworząc Gaz chlorowodorowy z towarzyszącą zmianą entalpii wynoszącą -184 kJ. Napisz odpowiednio wyważone równanie termochemiczne dla tego procesu.
-
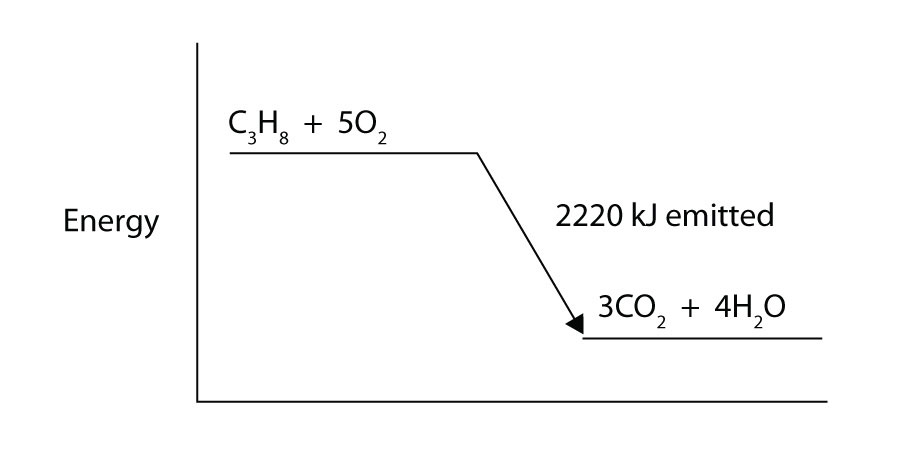
propan (C3H8) reaguje z pierwiastkowym gazem tlenowym w celu wytworzenia dwutlenku węgla i ciekłej wody z towarzyszącą zmianą entalpii -2220 kJ. Napisz odpowiednio wyważone równanie termochemiczne dla tego procesu.
-
Gaz azotowy reaguje z gazem tlenowym, wytwarzając NO(g) podczas pochłaniania 180 kJ. Napisz odpowiednio wyważone równanie termochemiczne dla tego procesu.
-
stały sód reaguje z gazem chloru, tworząc stały chlorek sodu, wydzielając jednocześnie 772 kJ. Napisz odpowiednio wyważone równanie termochemiczne dla tego procesu.
-
Gaz wodorowy i gaz chloru reagują, tworząc Gaz chlorowodorowy z towarzyszącą zmianą entalpii wynoszącą -184 kJ. Czy ten proces jest endotermiczny czy egzotermiczny?
-
propan (C3H8) reaguje z pierwiastkowym gazem tlenowym, wytwarzając dwutlenek węgla, wydzielając jednocześnie 2220 kJ energii. Czy ten proces jest endotermiczny czy egzotermiczny?
-
Gaz azotowy reaguje z gazem tlenowym, wytwarzając NO(g) podczas pochłaniania 180 kJ. Czy ten proces jest egzotermiczny czy endotermiczny?
-
metal sodu może reagować z azotem, tworząc azydek sodu (NaN3) o ΔH 21,72 kJ. Czy ten proces jest egzotermiczny czy endotermiczny?
-
narysuj wykres poziomu energii reakcji chemicznej w ćwiczeniu 8. (Patrz rysunek 7.3 „Energia reakcji” dla przykładu.)
-
narysuj wykres poziomu energii reakcji chemicznej w ćwiczeniu 9. (Patrz rysunek 7.3 „Energia reakcji” dla przykładu.)
-
w 250 mL roztworu łączy się 0,25 mola KOH(AQ) i 0,25 mola HNO3(aq). Temperatura roztworu wzrasta z 22,5°C do 35,9°C. Załóżmy, że roztwór ma taką samą gęstość i pojemność cieplną wody. Jakie jest ciepło reakcji i jaka jest ΔH reakcji w przeliczeniu na mole?
-
w roztworze 600 mL, 0.50 mol Ca(OH)2(AQ) i 0,50 mol H2SO4(aq) są połączone. Temperatura roztworu wzrasta o 22,3°C. Jakie jest ciepło reakcji i jaka jest ΔH reakcji w przeliczeniu na mole? Załóżmy, że roztwór ma taką samą gęstość i pojemność cieplną wody.
-
do ogrzania 400,0 g H2O spala się 0,050 mola etanolu (C2H5OH). Woda ogrzewa się od 24,6°C do 65,6°C. Jakie jest ciepło reakcji i jaka jest ΔH reakcji w przeliczeniu na mole?
-
do ogrzania 100,0 g H2O spala się 0,066 mola wosku pszczelego. Woda ogrzewa się od 21,4°C do 25,5°C. Jakie jest ciepło reakcji i jaka jest ΔH reakcji w przeliczeniu na mole?
odpowiedzi
-
w warunkach stałego ciśnienia
-
H2(G) + Cl2(G) → 2HCl(G) ΔH = -184 kJ
-
egzotermiczna
N2(g) + O2(g) → 2NO(g) δh = 180 kJ
ciepło reakcji = -14,0 kJ; ΔH = -56,0 kJ/mol reagentów
ciepło reakcji = -68,6 kJ; ΔH = -1,370 kJ/mol etanolu