zapoznaj się z najnowszymi artykułami
Streszczenie
niska niewydolność serca (LoHF) jest rzadką formą niewydolności serca (HF), ale taką, która sygnalizuje bardzo zaawansowaną niewydolność serca . Jest to związane ze złowieszczymi rokowaniami, a także znaczną zachorowalnością i śmiertelnością. Jednak LoHF pozostaje w dużej mierze niedostatecznie zbadane. Tradycyjny opis HF koncentrował się na zastoinowej niewydolności serca (CHF) charakteryzującej się niską wydajnością sercową i towarzyszącym zatorem płucnym/obwodowym. Koncentracja ta przyczyniła się do niedoceniania pacjentów z LoHF, u których objawy zatorów są niewielkie lub nie występują. Ponadto pacjenci z LoHF nie mają sprawdzonej terapii, a wybór odpowiedniego leczenia zależy od indywidualnej patofizjologii i etiologii podstawowej. Pacjenci z LoHF mają heterogeniczną etiologię i patofizjologię, podkreślając znaczenie dogłębnego zrozumienia jego cech klinicznych, diagnozy i postępowania klinicznego, co stanowi podstawę niniejszego przeglądu.
słowa kluczowe
zespół serca o niskiej mocy wyjściowej, niewydolność serca o niskiej mocy wyjściowej, Stan o niskiej mocy wyjściowej
wprowadzenie
pomimo znacznego postępu w terapiach medycznych i chirurgicznych, skuteczne zarządzanie niewydolnością serca (HF) nadal stanowi poważne wyzwanie dla pracowników służby zdrowia. Wyzwanie to odzwierciedla wysoki odsetek readmisji szpitalnych związanych z HF wraz ze zwiększoną śmiertelnością i zachorowalnością . Częścią wyzwania jest bardzo niejednorodna etiologia, Patofizjologia i kliniczne prezentacje różnych form HF, w których niektóre formy HF mają ograniczoną ilość danych z badań klinicznych, a tym samym ograniczone zrozumienie. W szczególności tradycyjny opis HF jest prawie synonimem zastoinowej niewydolności serca (CHF), jednak termin CHF wyklucza mniejszość pacjentów z HF, którzy mają niewielkie lub żadne widoczne objawy zatorów płucnych i / lub obwodowych . Low-output HF (LoHF) wiąże się również ze złowrogą prognozą i sygnalizuje bardzo zaawansowany HF. Ponadto różnice objawowe i patofizjologiczne w zastoinowej niewydolności serca i LoHF potwierdzają potrzebę stosowania różnych metod postępowania klinicznego . Pomimo tych różnic, tradycyjne terapie HF zostały uogólnione na wszystkie formy HF, w tym CHF i LoHF, tworząc kliniczną potrzebę zrozumienia patofizjologii, diagnostyki i klinicznego postępowania z LoHF. W tym artykule zebraliśmy opublikowane dowody na temat LoHF w zakresie epidemiologii, etiologii, patofizjologii, diagnostyki i zarządzania klinicznego. Celem jest poprawa wiedzy na temat stanu klinicznego LoHF, jak również poprawa klinicznego zarządzania HF w ogóle.
definicja
niewydolność serca jest złożonym zespołem klinicznym charakteryzującym się strukturalnymi i (lub) czynnościowymi wadami mięśnia sercowego prowadzącymi do upośledzenia wypełnienia lub wyrzutu komór . Złożoność zespołu jest widoczna w jego niejednorodnych klasyfikacjach: prawej, lewej lub dwukomorowej w zależności od lokalizacji wady; ostrej lub przewlekłej w zależności od czasu wystąpienia; zachowanej, granicznej lub zmniejszonej frakcji wyrzutowej w zależności od stanu czynnościowego; niska lub wysoka wydajność w oparciu o pojemność minutową serca (co), awaria do przodu lub do tyłu w oparciu o kierunek przepływu krwi. Każda z tych klasyfikacji ma znaczenie dla diagnostyki i leczenia HF . Pomimo kilku klasyfikacji, termin CHF był tradycyjnie używany zamiennie z HF, ale który nie opisuje wystarczająco LoHF z powodu kilku różnic objawowych i patofizjologicznych.
LoHF, znany również jako niski CO w ostrej zdekompensowanej HF, opisuje postać wysokiej ostrości HF charakteryzującą się zmniejszonym do przodu CO (indeks serca< 2.0 L / min / m2 i skurczowe ciśnienie krwi < 90 mmHg) I hipoperfuzja narządu końcowego z niewielkim lub żadnym objawem przekrwienia płuc . LoHF różni się od zastoinowej niewydolności serca, która opisuje HF charakteryzujące się zmniejszonym CO powodującym, odpowiednio, zatory płucne i obwodowe prowadzące do duszności i obrzęków obwodowych . Wytyczne Europejskiego Towarzystwa Kardiologicznego (ESC) z 2005 r.dotyczące diagnostyki i postępowania z HF sugerują kontynuację od zespołu low cardiac output syndrome (LCOS) do lohf do wstrząsu kardiogennego. Wytyczne ESC definiują wstrząs kardiogenny jako dowód perfuzji tkankowej wywołanej przez HF po korekcji obciążenia wstępnego charakteryzującego się skurczowym ciśnieniem < 90 mmHg lub spadkiem średniego ciśnienia tętniczego > 30 mmHg; wydalanie moczu < 0,5 ml/kg/h; tętno > 60 uderzeń na minutę (BPM) z lub bez śladów zatorów . Z drugiej strony LCOS jest powszechne u pacjentów pooperacyjnych z HF i definiowane jako potrzeba pooperacyjnej wewnątrzaortalnej pompy balonowej lub inotropowego wsparcia przez ponad 30 minut w ostrej opiece.
Epidemiologia
dokładna częstość występowania i częstość występowania LoHF w populacji ogólnej jest całkowicie nieznana. Obecnie nie istnieją dane epidemiologiczne dotyczące LoHF oparte na populacji. Jedyne dostępne Dane pochodzą z jednoośrodkowych badań klinicznych oceniających wybraną populację pacjentów z HF, którzy przeszli operację serca. W 1975 Parr et al. dokonał przełomowego opisu jednostki klinicznej LCO i zgłosił częstość występowania 25% u dzieci, które przeszły operację kardiochirurgiczną na podstawie zmniejszonego CO zdefiniowanego jako CI < 2,0 L / min/m2. Dwie dekady później Wernovsky et al. wykazano taką samą częstość występowania LCOS pooperacyjnych u pacjentów, którzy przeszli operację zmiany tętnicy występującą w ciągu 6-18 godzin po operacji. W ostatnich badaniach klinicznych odnotowano znaczne zróżnicowanie częstości występowania, od 3,6% (mężczyźni) i 5,9% (kobiety) do 9,1% i 41% oraz częstość występowania 14,7% . W ostatnim dłuższym okresie (dwadzieścia lat: 1990-2009) prospektywne badanie kliniczne z udziałem 25 176 pacjentów po operacjach przeszczepu obejściowego tętnicy wieńcowej (CABG), Algarni i wsp. odnotowano znaczny spadek częstości występowania LCO pooperacyjnych z 9,1% (1990-1994) do 2,4% (2005-2009) .
etiologia
etiologia LoHF jest wieloczynnikowa. Ogólnie rzecz biorąc, jest konsekwencją lewej komory (LV), prawej komory (RV) lub układowej Komory (anatomia pojedynczej komory) dysfunkcji i może obejmować zarówno skurczowe i/lub rozkurczowe dysfunkcji . Zaburzenia w wypełnianiu lub wyrzucaniu komór prowadzą do LoHF, co jest częstym powikłaniem u pacjentów, którzy przeszli operację serca lub są w wstrząsie kardiogennym . U pacjentów z przewlekłą HF może występować ostre pogorszenie stanu lub może być przemijającym i odwracalnym epizodem z ustąpieniem ostrego wyzwalacza. Jest to zespół kliniczny uważany za końcowy szlak wielu chorób wpływających na czynność serca. Nie wystarczy postawić diagnozę LoHF, przyczyna lub wyzwalacz muszą być również określone, a jeśli to możliwe, leczone . Tabela 1 zawiera podsumowanie Stanów powodujących stan niskiego wyjścia u pacjentów z HF.
Tabela 1. Etiologia stanu niskiego wyjściowego według patofizjologii
|
mechanizmy |
Warunki sprawcze |
|
utrata kurczliwości mięśnia sercowego |
choroba wieńcowa, kardiomiopatia, zapalenie mięśnia sercowego, niewyrównana przewlekła choroba HF, chirurgia pooperacyjna, toksyny, odżywianie (otyłość)m choroby naciekowe, schyłkowa niewydolność nerek, Choroba Chagasa lub zakażenie HIV |
|
upośledzenie napełniania lub wyrzucania komór |
zapalenie osierdzia, wysięk osierdziowy, tamponada serca, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
obecne zrozumienie patofizjologii LoHF w dużej mierze opiera się na dowodach z badań klinicznych na pacjentach pooperacyjnych CABG . Cechą patologiczną jest nadmiernie przygnębiony CO, któremu towarzyszy hipoperfuzja narządu końcowego. Fizjologicznie serce działa jak pompa do dystrybucji natlenionej krwi w ilościach wystarczających do zaspokojenia potrzeb metabolicznych tkanek. Ponieważ potrzeby metaboliczne różnią się w normalnych i stresujących sytuacjach, CO zmienia się również w celu zaspokojenia tego dynamicznego zapotrzebowania . Faza rozkurczowa cyklu sercowego jest krytyczna u pacjentów z LoHF, ponieważ to właśnie podczas relaksacji komór następuje wypełnienie wieńcowe, które zapewnia dotlenienie mięśnia sercowego . Tętno (HR) jest również istotne w rozkurczu, ponieważ zbyt szybkie HR uniemożliwia sercu osiągnięcie całkowitego rozluźnienia mięśnia sercowego i perfuzji. Tak więc, dysfunkcja serca wynika ze strukturalnej (szczątkowej anomalii serca) lub czynnościowego zaburzenia serca (zaburzenia napełniania lub opróżniania komór lub zwiększony ogólnoustrojowy opór naczyniowy).
Patofizjologicznie CO zależy od HR i objętości udaru (SV) (CO = HR * SV). Objętość skoku jest z kolei iloczynem netto trzech powiązanych ze sobą zmiennych obiegowych: napięcia wstępnego, napięcia końcowego i kurczliwości. Jeśli jeden lub więcej z tych składników jest zaburzony, może rozwinąć się stan małej pojemności minutowej serca . Co więcej, składniki te wpływają zarówno na fazę skurczową, jak i rozkurczową cyklu sercowego, powodując dysfunkcję skurczową LV/RV i / lub dysfunkcję rozkurczową znaną również jako HF z zachowaną frakcją wyrzutową (ryc. 1). Inne warunki, takie jak zastawkowe choroby serca, nadciśnienie płucne (PH), zaburzenia mechaniczne zastawki, i niewydolność oddechowa może przyspieszyć lub pogorszyć rozwój LoHF .
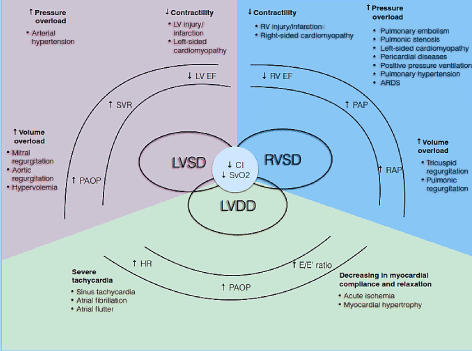
Rysunek 1. Patofizjologiczne mechanizmy małej niewydolności serca
najczęstsze przyczyny i typowe; uwzględniono objawy LoHF. Głównymi mechanizmami patofizjologicznymi LoHF jest dysfunkcja komorowa: Zaburzenia skurczowe i (lub) rozkurczowe LV i zaburzenia skurczowe RV, z których wszystkie mają wspólne cechy patologiczne obniżonego wskaźnika sercowego (CI) i zmniejszonego mieszanego nasycenia żylnego tlenem (SvO2). Dysfunkcja skurczowa LV i RV wynika ze zwiększonego przeciążenia ciśnieniem, zwiększonego przeciążenia objętościowego i zmniejszonej kurczliwości, podczas gdy dysfunkcja rozkurczowa LV wynika z ciężkiej tachykardii i zmniejszonej zgodności mięśnia sercowego i relaksacji. Zaadaptowane z Lomivorotov et al. 2017, s.
LV zaburzenia czynności histolicznych
zaburzenia skurczowe lewej komory (LV) (lub obniżona frakcja wyrzutowa LV ) są najczęstszym mechanizmem patofizjologicznym obserwowanym u pacjentów z LoHF. Zmienne cyrkulacyjne wpływające na funkcję skurczową LV to napięcie wstępne, po obciążeniu i kurczliwość . Ogólnie rzecz biorąc, dysfunkcja skurczowa LV jest konsekwencją utraty lub zmniejszenia funkcjonalnych kardiomiocytów w wyniku martwicy spowodowanej upośledzeniem krążenia wieńcowego i niedokrwieniem, uszkodzeniem reperfuzyjnym lub mniej zrozumiałym naturalnym zjawiskiem apoptozy kardiomiocytów . Utrata funkcjonalnych kardiomiocytów może być przemijająca, jak widać podczas ogłuszania mięśnia sercowego, definiowana jako żywotne mięsień sercowy uratowany przez reperfuzję wieńcową, która wykazuje przedłużoną dysfunkcję po niedokrwiennej po reperfuzji . Utrata funkcjonalnych kardiomiocytów może być również oporna na odwrócenie w warunkach takich jak infekcja; tachykardia; choroba zastawek; zaburzenia metaboliczne, takie jak kwasica, hipoglikemia, hipokalcemia; ekspozycja na środowiskowe toksyny kardiologiczne i chemikalia; idiopatyczna kardiomiopatia rozstrzeniowa (DCM); i zaburzenia genetyczne, takie jak rodzinna DCM, kardiomiopatia przerostowa i dystrofie mięśniowe . Zaburzona odpowiedź serca na obciążenie wstępne powoduje dramatyczne zmniejszenie dostarczania CO i tlenu do innych kluczowych narządów ciała, podwyższone ciśnienie przedsionkowe, ciśnienie klina kapilarnego i kardiogenny obrzęk płuc. Chociaż wyrównawcze zmiany w LV dostosowują się do stosunkowo wysokiego ogólnoustrojowego ciśnienia tętniczego, znaczny wzrost obciążenia wtórnego może wywołać dysfunkcję skurczową LV .
zaburzenia rozkurczowe LV
chociaż niezbyt często, LoHF może rozwinąć się u pacjentów z zaburzeniami rozkurczowymi LV z zachowanym LVEF. Stan wynika z niezdolności Komory komorowej do wypełnienia odpowiednią objętość krwi pomimo normalnego napięcia wstępnego, co objawia się jako dysfunkcja rozkurczowa . Podstawowe warunki, takie jak ciężka tachykardia, zmniejszenie zgodności mięśnia sercowego lub nieprawidłowe rozluźnienie komór upośledza rozluźnienie i wypełnienie LV podczas fazy rozkurczowej cyklu sercowego. Na poziomie kardiomiocytów warunki te są związane z usuwaniem wapnia z cytozolu i homeostazy wapnia, adekwatnością odwarstwienia krzyżowego i wewnętrznym zaburzeniem czynnościowym elementu cytoszkieletu . Odwarstwienie mostu krzyżowego może przyczynić się do opóźnionego czasu relaksacji izowolumicznej, co skutkuje zmniejszeniem objętości udaru LV, szczególnie przy wyższej HR . Relaksacja LV zależy również od wychwytu zwrotnego jonów wapnia i sygnalizacji tlenku azotu, które również ułatwiają odwarstwienie mostu poprzecznego. Ponieważ proces odwarstwienia krzyżowego jest energochłonny, może powodować deficyt energii mięśnia sercowego, a tym samym spowolnić relaksację mięśnia sercowego LV .
pomimo , że zaburzenia rozkurczowe są powszechnym zjawiskiem obserwowanym nawet u 70% pacjentów pooperacyjnych, same zaburzenia rozkurczowe nie są wystarczające do wyjaśnienia rozwoju ostrej HF. W ustawieniu innych warunków klinicznych, takich jak migotanie przedsionków (AF), zaburzenia krążenia wieńcowego i nadciśnienie tętnicze, dysfunkcja rozkurczowa może powodować niewyrównany stan, a zatem uważa się, że jest wczesnym objawem niedokrwienia mięśnia sercowego . Dynamiczny związek między LV funkcji rozkurczowych i skurczowych również przyczynia się do zaburzeń rozkurczowych u pacjentów z LoHF. Stymulacja inotropowej katecholaminy wpływa zarówno na rozkurcz, jak i na skurcz i może nasilać dysfunkcję rozkurczową. Depresja LVEF prowadzi do zwiększenia końcowej objętości skurczowej i wydłuża fazę rozkurczową cyklu sercowego .
dysfunkcja RV
w LoHF, szczególnie po operacji tętnicy wieńcowej, podstawowe mechanizmy patofizjologiczne dysfunkcji RV obejmują zwiększone obciążenie wstępne, zwiększone obciążenie wtórne, upośledzoną perfuzję prawej tętnicy wieńcowej i zmniejszoną kurczliwość . W przeciwieństwie do lewej tętnicy wieńcowej, perfuzja prawej tętnicy wieńcowej występuje zarówno podczas rozkurczu, jak i skurczu. Obecność PH powoduje wzrost ciśnienia RV prowadząc do zmniejszenia perfuzji prawej tętnicy wieńcowej, co wyjaśnia znaczenie dla zapewnienia optymalnego lewego i prawego krążenia wieńcowego . U pacjentów, którzy przeszli operację tętnicy wieńcowej, dysfunkcja RV może rozwinąć się w wyniku połączenia mechanizmów. Okołooperacyjne niedokrwienie RV i zawał są głównymi przyczynami upośledzonej kurczliwości RV. Niedomykalność trójdzielna lub pulmoniczna re częstymi przyczynami zwiększonego napięcia wstępnego objętości, podczas gdy lewostronna choroba zastawkowa lub kardiomiopatia, pH lub zatorowość płucna (PE), zespół ostrej niewydolności oddechowej i wentylacja pod wysokim ciśnieniem są częstymi przyczynami przeciążenia ciśnieniowego . Ponieważ RV Zwykle umożliwia niskociśnieniową perfuzję naczyń płucnych, jest bardzo wrażliwy nawet na umiarkowany wzrost ciśnienia w tętnicy płucnej (PAP). Awaria RV może rozwinąć się w ustawieniu PH lub upośledzonej kurczliwości związanej z szybkim postępem rozszerzania RV prowadzącym do zwiększenia ciśnienia RV w rozkurczu końcowym . Te zmiany fizjologiczne mogą spowodować przesunięcie przegrody międzykomorowej w kierunku już niedostatecznie wypełnionej Komory LV i w konsekwencji spowodować zmniejszenie napięcia wstępnego LV i zmniejszenie CO .
czynniki ryzyka
czynniki ryzyka LoHF pozostaje obszarem niedostatecznie zbadanym. Jednak niewiele dostępnych danych z badań klinicznych dotyczących HF i pacjentów pooperacyjnych z LCOS zapewnia cenny wgląd w Czynniki ryzyka i czynniki predykcyjne LoHF. W analizie 452 pacjentów hospitalizowanych z niewyrównaną HF i małą pojemność minutową serca, istotnymi czynnikami ryzyka LoHF były: Choroba Chagasa (ryzyko względne : 3,66), obniżona frakcja wyrzutowa (RR: 2,41), hiponatremia (RR: 1,62) i zaburzenia czynności nerek (RR: 1,92) . Czynniki ryzyka pooperacyjnego LoHF obejmują zaburzenia czynności LV (< 50%), CABG na pompie, operację awaryjnego lub krążeniowo-oddechowego bypassu (CPB), niekompletną rewaskularyzację, wiek > 65 lat oraz połączoną obecność cukrzycy i przedoperacyjnych zaburzeń czynności nerek . Oprócz czynników ryzyka dla pacjenta i operacji, biochemicznymi czynnikami predykcyjnymi LoHF u pacjentów pooperacyjnych są niskie poziomy hemoglobiny, całkowita liczba limfocytów < 2000 komórek/µL oraz przedoperacyjne poziomy peptydów natriuretycznych w surowicy. W ciągu ostatnich dwóch dekad nastąpiły zmiany w trendach niektórych uznanych czynników ryzyka. Czynniki takie jak nadciśnienie tętnicze, Płeć żeńska, choroba naczyń potrójnych i główna choroba lewej strony nie są już statystycznie istotne, podczas gdy ryzyko związane z obniżoną frakcją wyrzutową przedoperacyjną podwoiło się .
diagnoza
nie ma zgodnych wytycznych ani sprawdzonych kryteriów diagnostycznych dla pacjentów z LoHF. Ponadto objawy kliniczne są niespecyficzne. W przypadku braku znormalizowanych wytycznych diagnoza zwykle opiera się na zaakceptowanym zbiorze aberracji hemodynamicznych i fizjologicznych przydatnych do wzbudzania klinicznego podejrzenia LoHF . Sama diagnoza LoHF często nie wystarcza. Należy również ustalić przyczynę stanu niskiego wyjścia. W niektórych przyczyn stanu niskiego wyjścia, takich jak PE lub MI, leczenie przyczyny jest najważniejszym czynnikiem, a zatem konieczne jest postawienie diagnozy. Ponieważ pacjenci z LoHF są często niestabilni, często zdarza się również, że ocena kliniczna, diagnostyka i leczenie występują jednocześnie bardziej w ostrych warunkach opieki .
objawy podmiotowe i przedmiotowe
Mała pojemność minutowa serca jako cecha charakteryzująca ostre niewyrównane HF jest niezbyt częsta, dotyczy tylko 8, 9 do 9, 6% hospitalizowanych pacjentów z HF . LoHF może dzielić wiele cech klinicznych z CHF, ale istnieją znaczące różnice, które mogą wspierać lub kierować późniejszymi decyzjami diagnostycznymi. Nadmierne zmęczenie i zwiększona nietolerancja wysiłkowa są ważnymi początkowymi objawami zauważonymi przez pacjentów z LoHF jeszcze przed diagnozą . Ponadto u pacjentów z LoHF często występuje pobudzenie, splątanie i (lub) obniżony poziom świadomości; zimne/zwężone naczynia obwodowe lub opóźniony czas uzupełniania naczyń włosowatych; niedociśnienie; tachykardia lub bradykardia; nitkowate tętno; podwyższone ciśnienie żylne w szyjce macicy; duszność i hipoksemia; oraz skąpomocz/bezmocz . Te objawy przedmiotowe i podmiotowe mogą różnić się między małą perfuzją a przekrwieniem u pacjentów z HF(Tabela 2).
Tabela 2. Objawy i oznaki niskiej perfuzji vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: Wytyczne ESC z 2016 r. dotyczące diagnostyki i postępowania z HF podkreślają znaczenie uzyskania szczegółowej historii pacjenta i badania fizykalnego u wszystkich pacjentów, u których podejrzewa się HF . Szczegółowa historia od pacjenta, lub krewnych i przyjaciół, jeśli pacjent jest zbyt źle, należy skupić się na uzyskaniu informacji o objawach, poprzednich i obecnych chorób serca i poza-sercowych zdolnych do wytrącania lub nasilenia HF, ekspozycji na czynniki ryzyka HF lub stanu niskiego wyjściowego, i historii leków dla poprzednich i obecnych schorzeń . Oprócz wywiadu pacjenta, zaleca się badanie fizykalne dla wszystkich pacjentów z LoHF w celu oceny klinicznych wskaźników hemodynamicznych, perfuzji obwodowej, zatorów, etiologii podstawowej i patologii zastawek. Hemodynamiczne parametry zainteresowania obejmują ciśnienie krwi, HR i rytm serca, rytm galopu, nasycenie tlenem, i częstość oddechów . Testy na perfuzję obwodową powinny obejmować poziom świadomości, temperaturę skóry obwodowej/centralnej, czas napełniania naczyń włosowatych i wydalanie moczu. Badania w kierunku zatorów obejmują podwyższone ciśnienie żylne szyjne, obrzęk obwodowy/płucny, powiększenie wątroby, wodobrzusze i wysięk opłucnowy. Testy dla podstawowej etiologii powinny obejmować badanie sercowo-naczyniowe, i dźwięk serca i szmery. Wreszcie, dowody na zaburzenia czynności zastawek powinny obejmować rub osierdziowy i dowody na wysięk osierdziowy z tamponadą serca lub bez niej .
połączenie wywiadu pacjenta z badaniem fizykalnym okazało się nieocenione w ocenie stanu hemodynamicznego i rozpoznawaniu LoHF . W 1976 Forrester et al. przeprowadzono badanie fizykalne pacjentów z ostrym zawałem mięśnia sercowego i zidentyfikowano cztery profile hemodynamiczne (A, B, L I C), jak pokazano na fig. Profile hemodynamiczne opierają się na obecności lub braku zatoru płucnego (ciśnienie klina kapilarnego w płucach > lub ≤ 18 mmHg) i adekwatności perfuzji (CI > 2,2 L/min/m2). Profil A oznacza brak zatorów / hipoperfuzji; profil B zatorów bez hipoperfuzji; profil C hipoperfuzji bez zatorów; oraz Profil L zatorów i hipoperfuzji . Pacjenci LoHF podlegają profilom L I C (hypoperfusion ± Congregation based on Nohria et al. wykazanie, że średni CI profilu L I C wynosi odpowiednio 1, 6 L/min/m2 i 1, 9 L/min/m2.
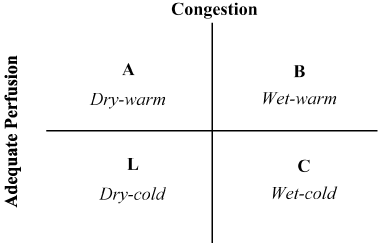
Rysunek 2. Schematyczne przedstawienie profilu klinicznego ostrej niewyrównanej niewydolności serca
przekrwienie ocenia się na podstawie obecności oddechu ortopedycznego, wzdęcia żylnego szyjnego, rzęs płucnych, refluksu wątrobowo-jajnikowego, wodobrzusza, obrzęku obwodowego, refluksu brzusznego i fali kwadratowej Walsalvy. Niską perfuzję oceniano na podstawie występowania wąskiego ciśnienia tętna, zmian pulsu, zimnych kończyn, senności, spadku stężenia sodu w surowicy i pogorszenia czynności nerek. Adaptacja z Nohria, et al.
elektrokardiogram (EKG): zarówno wytyczne AHA, jak i ESC dotyczące HF zalecają jak najwcześniejsze wykonanie elektrokardiogramu (EKG) u wszystkich pacjentów, u których podejrzewa się HF. EKG może wykazywać różne nieprawidłowości i jest bardzo mało prawdopodobne, aby było prawidłowe u pacjentów z HF. Może również dostarczyć dowodów na podstawową etiologię zaburzeń czynności serca, w tym bradykardię, blok przedsionkowo-komorowy, tachykardię zatokową, tachyarytmię przedsionkową lub komorową, niedokrwienie, przerost LV i kompleksy niskiego napięcia .
podstawowe badania laboratoryjne: wytyczne AHA i ESC HF zalecają również podstawowe badania laboratoryjne we wstępnej ocenie klinicznej w celu wsparcia diagnozy HF lub przyczyny stanu niskiego wyjściowego. U wszystkich pacjentów, u których podejrzewa się HF, należy wykonać badania krwi. Hemoglobina (Hb > 10 g/dL) wskazuje na optymalne dostarczanie tlenu do tkanek), przewlekła niedokrwistość występuje często w przewlekłej HF i znacznie zwiększona liczba białych krwinek budzi podejrzenie alternatywnej diagnozy. Testy na elektrolit w surowicy w celu określenia poziomu potasu, magnezu i wapnia. Badania mocznika i kreatyniny w celu oceny hipoperfuzji nerek i zaburzeń czynności nerek często w HF. Badania w kierunku zaburzeń czynności wątroby, które sugerują zaburzenia RV i (lub) zatkania wątroby. Test stężenia glukozy w celu oceny hipoglikemii, która może zaburzać czynność serca. Badania czynności tarczycy w kierunku niedoczynności lub nadczynności tarczycy, które mogą powodować wewnętrzny zawał mięśnia sercowego. Wreszcie, testy dla surowiczych peptydów natriuretycznych, których podwyższone poziomy wskazują na zwiększony stres ściany komory, ale które nie wykrywają nagłych zmian ciśnienia napełniania komór z powodu ich długiego okresu półtrwania .
badania obrazowe serca: obrazowanie serca odgrywa kluczową rolę w diagnostyce HF, a także w monitorowaniu i prowadzeniu terapii. Echokardiografia jest preferowaną modalnością ze względu na dokładność, dostępność, Bezpieczeństwo i opłacalność . Może on być uzupełniony o inne metody obrazowania wybrane w oparciu o zdolność do odpowiedzi na konkretne pytania kliniczne, biorąc pod uwagę przeciwwskazania i zagrożenia .
echokardiografia: echokardiografia jest zdecydowanie zalecana dla wszystkich podejrzanych pacjentów ze względu na jego zdolność do potwierdzenia lub wykluczenia diagnozy klinicznej LoHF, do oceny SV i jego zmian oraz do określenia przyczyny stanu niskiego wyjścia. Echokardiografia przeztwardówkowa powinna być wykonana tak szybko, jak to możliwe po klinicznym rozpoznaniu małej pojemności minutowej serca. Nie tylko mierzy stopień dysfunkcji skurczowej i rozkurczowej, ale także dostarcza cennych informacji na temat morfologii komór, dysfunkcji zastawek, chorób mięśnia sercowego i osierdziowego oraz regionalnych zaburzeń ruchu ścian . Echokardiografia ocenia czynność skurczową mierząc LEVF, gdzie> 45-50% jest uważane za prawidłowe. Z drugiej strony, funkcja rozkurczowa jest oceniana za pomocą mitral w schematach przepływu, przepływ żyły płucnej i Dopplera tkankowego w pierścieniu mitralnym, podczas gdy CO i SV są oceniane za pomocą Zasady Dopplera. Ciśnienie w tętnicy płucnej (PAP) można oszacować mierząc prędkość strumienia. Wysoki PAP w obecności rozszerzonego RV ze spłaszczeniem przegrody lub pochyleniem się do LV, wskazując na ostry wzrost ciśnienia RV, podnosząc kliniczne podejrzenie PE jako przyczyny niskiego stanu wyjściowego .
RTG klatki piersiowej: u pacjentów podejrzewanych o LoHF można rozważyć wykonanie zdjęcia rentgenowskiego klatki piersiowej. Ważne wskaźniki, które należy wziąć pod uwagę do oceny, obejmują powiększenie serca wskazujące na kardiomegalię lub przerost LV; przekrwienie żył płucnych wskazujące na podwyższone ciśnienie napełniania LV; i wysięk opłucnowy wskazujący na podwyższone ciśnienie LV, zatorowość płucną lub po operacji kardiochirurgicznej( .
angiografia wieńcowa: wskazania do angiografii wieńcowej u pacjentów z LoHF powinny być zgodne z zaleceniem odpowiednich wytycznych konsensusu dla HF . U pacjentów z HF z bólem w klatce piersiowej i objawami zawału mięśnia sercowego z uniesieniem ST (STEMI) w EKG należy jak najszybciej wykonać rewaskularyzację z zastosowaniem pierwotnej przezskórnej interwencji wieńcowej. Angiografię wieńcową należy również rozważyć u pacjentów po zatrzymaniu krążenia o etiologii niedokrwiennej, gdy istnieją dowody na HF oraz u pacjentów, którzy powrócili do stanu niskiego wyjściowego, gdy przyczyna nie została określona .
postępowanie kliniczne
obecność LoHF stanowi stan bardzo wysokiego ryzyka, wymagający szybkiego leczenia, ale nie ma znormalizowanych wytycznych dotyczących postępowania klinicznego . W związku z tym lekarze zazwyczaj rozważają indywidualną patofizjologię, aby wybrać najbardziej odpowiednią strategię leczenia . U pacjentów z ostrym LoHF wytyczne ESC HF z 2016 r. zalecają stosowanie profili hemodynamicznych (w oparciu o obecność lub brak zatorów i adekwatność perfuzji) w celu prowadzenia postępowania klinicznego . W przypadku pacjentów z LoHF w profilu L (brak zatorów, ale hipoperfused) i profilu C (zarówno zatory, jak i hipoperfused), którzy są w stanie ostrej dekompensacji, cele leczenia w nagłych wypadkach mogą obejmować reanimację pacjentów, przywrócenie dotlenienia, poprawę perfuzji narządów i optymalizację hemodynamiczną (objętość udaru i CO) oraz rozwiązywanie objawów. Inne kolejne cele obejmują optymalne monitorowanie i ustalenie przyczyny niskiej pojemności minutowej serca i leczenie przyczyny, jeśli odwracalne . Obecnie dostępne cele terapeutyczne dla LoHF to optymalizacja dotlenienia tkanek, stabilizacja krążenia i leczenie odwracalnych przyczyn stanu niskiego wyjściowego (ryc. 3).
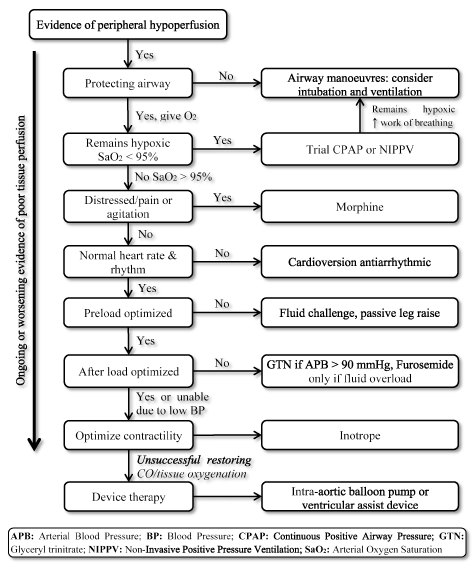
Rysunek 3. Algorytm leczenia niewydolności serca o małej mocy
leczenie lohf ma na celu poprawę dotlenienia tkanek i stabilizację krążenia w oparciu o trwający lub nasilający się objaw perfuzji tkankowej. Leczenie rozpoczyna się od poprawy wentylacji za pomocą dostarczania tlenu o wysokim przepływie, ciągłego dodatniego ciśnienia w drogach oddechowych (CPAP) lub nieinwazyjnej wentylacji dodatniego ciśnienia (NIPPV). Jeśli się nie powiedzie, kardiowersja lub leki antyarytmiczne są podawane w celu normalizacji tętna, płynu wyzwanie w celu optymalizacji wstępnego obciążenia, i / lub leki rozszerzające naczynia i inotropy manipulować i poprawić kurczliwość odpowiednio. Jeśli poprzednia wentylacja i leki nie są w stanie przywrócić wydolności serca i (lub) dotlenienia tkanek, można rozważyć terapię przyrządową za pomocą pompki balonowej do aorty lub urządzeń wspomagających komorę
optymalizację dotlenienia tkanek (strategie wentylacyjne)
leczenie kliniczne pacjentów z LoHF często rozpoczyna się od oceny dróg oddechowych, oddychania i krążenia pod kątem objawów hipoperfuzji obwodowej. Strategie respiratorów, takie jak drogi oddechowe jamy ustnej i gardła lub nosogardzieli, są częstymi uzupełnieniami stosowanymi w celu przywrócenia lub utrzymania drożności dróg oddechowych u pacjentów z LoHF z obniżonym poziomem świadomości spowodowanym zmniejszoną perfuzją mózgową. Należy rozważyć dodatkową intubację dotchawiczą, jeśli pacjent nadal ma upośledzone drogi oddechowe . Jeśli pacjenci nadal pozostają niedotlenieni (SaO2 < 95%), można rozważyć maksymalizację dostarczania tlenu przy użyciu tlenu o wysokim przepływie, ciągłego dodatniego ciśnienia w drogach oddechowych (CPAP) lub nieinwazyjnej wentylacji dodatnim ciśnieniem (NIPPV). U pacjentów bez poprawy można rozważyć intubację lub wentylację .
stabilizacja krążenia
pojemność minutowa serca (co) jest funkcją HR i SV. Z kolei SV zależy od czterech zmiennych krążenia – tętna, napięcia wstępnego, kurczliwości i obciążenia końcowego. Optymalizacja wszystkich tych zmiennych poprawi CO u pacjentów z LoHF . W warunkach klinicznych strategie zwiększania CO zależą od przyczyny i zmiennej cyrkulacji . Interwencje kliniczne obejmują regulację objętości, wsparcie farmakologiczne i terapię przyrządową.
tętno/rytm: W ramach reakcji fizjologicznej organizmu, zwiększenie HR zwiększa CO. Zbyt szybkie lub wolne HR ma szkodliwy wpływ na CO. U pacjentów z częstoskurczem (zbyt szybki spoczynkowy HR > 100 uderzeń na minutę), u których występuje niepokój, niepokój i duszność, morfina może być podawana w celu złagodzenia duszności, bólu i pobudzenia, a także jest łagodnym lekiem rozszerzającym żylaki zmniejszającym obciążenie wtórne, szczególnie u pacjentów z CPAP lub NIPPV . Jeśli HR < 40 uderzeń na minutę z objawami zaburzeń hemodynamicznych i (lub ) upośledzonego CO, należy wykonać leki zwiększające HR (atropina i leki przeciwcholinergiczne) lub interwencje, takie jak stymulacja przezskórna/przezcewkowa. Należy rozważyć pilną kardiowersję elektryczną w wybranych przypadkach LoHF z częstoskurczem komorowym/nadkomorowym lub szybkim AF z objawami zaburzeń sercowo-naczyniowych .
Optymalizacja obciążenia wstępnego( regulacja głośności): pomiar napięcia wstępnego jest niezbędny do jego optymalizacji. Zaleca się go u pacjentów z klinicznymi objawami upośledzenia perfuzji obwodowej. W celu oceny reakcji na obciążenie wstępne należy przeprowadzić badanie płynu. Szybkie wlewanie 250 ml płynu (krystaloidu lub koloidu) przez ponad pięć minut i obiektywna ocena wpływu na SV. Jeśli skutkiem jest zwiększenie lub zmniejszenie> 10%, pacjent powinien kontynuować otrzymywanie bolusów płynowych w celu optymalizacji napięcia wstępnego do momentu, gdy nie będzie już reagował na płyn . U pacjentów z objawami przekrwienia i obrzękiem płuc, którzy nie wymagają podania płynu w bolusie, można wykonać bierne podniesienie nogi – podniesienie nogi pacjenta do 45 stopni, aby wykluczyć konieczność podania płynu w bolusie. Jeśli odpowiedź jest korzystna, można podać prawdziwe wyzwanie płynne .
manipulowanie obciążeniem następczym( wsparcie farmakologiczne): obciążenie następcze to opór, z którym komora wyrzuca krew, czasami oceniany jako SVR. Należy zmniejszyć obciążenie wtórne u pacjentów z LoHF, u których występuje duże obciążenie wtórne, małe stężenie CO, oznaki słabej perfuzji obwodowej i obrzęk płuc. U pacjentów z LoHF z ciśnieniem skurczowym ≥110 mmHg należy zapewnić wsparcie farmakologiczne z zastosowaniem leków rozszerzających naczynia krwionośne. U pacjentów z ciśnieniem skurczowym < 90 mmHG I średnim ciśnieniem tętniczym < 65 mmHg nie zaleca się stosowania leków rozszerzających naczynia krwionośne ze względu na ryzyko wystąpienia niedociśnienia, które może skomplikować perfuzję narządów. U tych pacjentów zaleca się stosowanie inotropów jako pierwszej linii leczenia .
Poprawa kurczliwości (wsparcie farmakologiczne): Jeśli pacjent utrzymuje się z objawami hipoperfuzji tkanek lub zmniejszonego dostarczania tlenu pomimo interwencji dotyczących częstości akcji serca, obciążenia wstępnego i obciążenia wtórnego, należy rozważyć leczenie mające na celu poprawę kurczliwości. W międzyczasie należy kontynuować optymalizację dostarczania tlenu w celu osiągnięcia stężenia hemoglobiny ≥10 g / dl i zapewnienia optymalnego nasycenia tlenem (SaO2). Czynnikami niekorzystnie wpływającymi na kurczliwość mięśnia sercowego są: hiperkaliemia, hipomagnezemia, hipokalcemia, ciężka kwasica, niedotlenienie i hipoglikemia, które należy skorygować. Inotropy są zalecane w celu poprawy kurczliwości, a następnie CO u pacjentów z LoHF z niskim BP i (lub) niskim CI w obecności objawów słabej perfuzji obwodowej lub zatorów . Jednak wsparcie farmakologiczne przy użyciu dobutaminy (inotrope) należy stosować ostrożnie u pacjentów z tachykardią lub Af, ponieważ zwiększa przewodzenie węzła AV i może przyspieszać szybkie rytmy komorowe . Z drugiej strony, levosimendan jest zalecany u pacjentów z ostrym niedokrwieniem mięśnia sercowego lub po operacji kardiochirurgicznej, ponieważ nie zwiększa zapotrzebowania mięśnia sercowego na tlen . Długotrwałe działanie inotropów może być szkodliwe, a zatem ich stosowanie powinno zostać przerwane po osiągnięciu stabilności. Wazopresory nie powinny być lekami pierwszego rzutu w Stanach o niskiej wydajności, ponieważ zwiększają trwałą odpowiedź wirusologiczną, a następnie upośledzają CO. Jednak u pacjentów z sepsą jako podstawową przyczyną stanu niskiego wyjściowego zaleca się podwójną terapię leków wazopresorowych i inotropowych .
terapia przyrządowa: leczenie przyrządowe należy rozważyć u pacjentów z LoHF, gdy optymalne terapie medyczne okazały się nieskuteczne w przywróceniu CO i dotlenieniu tkanek. Typowe terapie urządzenia obejmują wewnątrz aorty pompy balonowej (iabp) i ventricular assist device (VAD). Stosowanie IABP jest częste u pacjentów z chorobą niedokrwienną serca z LoHF, interwencją przed lub po przezskórnej lub po operacji kardiochirurgicznej. IABP składa się z balonu wprowadzonego do aorty przez tętnicę udową. Balon napompowuje się podczas rozkurczu i spuszcza powietrze podczas skurczu, zwiększając ciśnienie rozkurczowe, a w konsekwencji perfuzję wieńcową, i zmniejsza obciążenie wtórne, zwiększając w ten sposób CO . Z drugiej strony stosowanie VAD jest rzadkie. Może być stosowany tylko w specjalistycznych ośrodkach. Jest powszechnie stosowany jako pomost do przeszczepu serca u pacjentów z korzystną jakością życia lub do powrotu do zdrowia u pacjentów z ostrym zapaleniem mięśnia sercowego .
leczenie przyczyn podstawowych
niektóre przyczyny stanu niskiego wyjściowego u pacjentów z LoHF można odwrócić za pomocą specyficznych terapii. Odwracalne przyczyny należy określić na wczesnym etapie wstępnej oceny klinicznej. Przyczyny te obejmują ostry zawał mięśnia sercowego, tamponadę serca, odmę opłucnową, zatorowość płucną i ostrą niewydolność zastawek . (Tabela 3).
metaanaliza diagnostyki i postępowania klinicznego
podstawą klinicznej diagnozy LoHF były echokardiograficzne dowody zaburzeń skurczowych LV/RV i / lub zaburzeń rozkurczowych LV wraz z dowodami zmniejszonego CO i SvO2 . Profile hemodynamiczne oparte na pomiarach zatorów i perfuzji zostały wykorzystane do klasyfikacji ostrych pacjentów z HF na cztery profile: suchy-ciepły (A), mokry-ciepły (B), suchy-zimny (L) i mokry-zimny (C) i przydatne w identyfikacji pacjentów z LoHF . Pacjentów z LoHF podzielono na Profile (L) I (C) w oparciu o obecność/brak zatorów i (lub) niewystarczającą perfuzję obwodową . Te dwa profile hemodynamiczne stworzyły podstawę do selekcji pacjentów z LoHF w badaniach klinicznych, a także zapewniają prostą ocenę przy łóżku, aby pomóc w klasyfikacji pacjentów w czasie prezentacji i pokierować wyborem wstępnych terapii . Celem niniejszej metaanalizy jest zebranie opublikowanych dowodów wspólnych cech diagnostycznych i wyników leczenia u pacjentów z LoHF.
strategia wyszukiwania
trzy główne internetowe bazy danych (PubMed, EMBASE i Cochrane) były systematycznie przeszukiwane od początku istnienia do grudnia 2018 r.w celu zbadania diagnostyki i klinicznego zarządzania LoHF. Aby uniknąć przeoczenia badań, które nie wspominały o LoHF w tytule lub streszczeniu, uwzględniono pierwsze 200 artykułów z rankingiem trafności pobranych za pomocą pełnotekstowej wyszukiwarki Google Scholar. Nie zastosowano ograniczeń czasowych ani językowych. Dodatkowe badania zidentyfikowano poprzez ręczne przeszukiwanie listy odniesień z włączonych badań, a także z odpowiednich artykułów przeglądowych, które następnie zostały poddane kryteriom włączenia. Kryteria wyszukiwania obejmowały populację zainteresowaną (pacjenci z LoHF lub LCOS), badania diagnostyczne zainteresowania (echokardiografia i profile hemodynamiczne) i interwencję zainteresowania (strategie respiratora, regulacja objętości, wsparcie farmakologiczne i terapia urządzeń). Badania zostały włączone, jeśli spełniały następujące kryteria: a) obejmowały pacjentów z LoHF; (b) diagnozowane za pomocą echokardiografii i profili hemodynamicznych; (c) leczeni pacjenci w celu stabilizacji hemodynamicznej; oraz (d) zgłoszone wyniki leczenia. W przypadkach badań, w których podawano zduplikowane dane, uwzględniono tylko badanie, które dostarczyło największą liczbę pacjentów. Abstrakty konferencji, kazuistyki i artykuły przeglądowe zostały wyłączone.
wybór badania
Rysunek 4 ilustruje proces wyszukiwania i badania przesiewowego zastosowany do włączenia kwalifikujących się badań. Dwóch recenzentów niezależnie przejrzało wszystkie tytuły i abstrakty pobrane z systematycznego wyszukiwania online. Abstrakty, które obejmowały populację, interwencję i wyniki zainteresowania, zostały włączone do wyszukiwania pełnotekstowego. Następnie obaj recenzenci niezależnie recenzowali pełnotekstowe artykuły pod kątem kryteriów włączenia. W przypadkach rozbieżności rozwiązywano je w drodze dyskusji i konsensusu.

Rysunek 4. Schemat wyszukiwania literatury i procesu integracji
gromadzenie danych
dwóch recenzentów niezależnie wyodrębniło dane z włączonych badań, a wszelkie rozbieżności zostały rozwiązane w drodze konsensusu. Głównymi pozyskanymi danymi były dane o Profilu echokardiograficznym i hemodynamicznym oraz zastosowane leczenie i wyniki leczenia dotyczące hemodynamiki (indeks sercowy, PCWP) i śmiertelności. Oprócz tych głównych danych obaj recenzenci uzyskali również dane dotyczące charakterystyki badania, charakterystyki pacjentów i czasu trwania obserwacji (Tabela 4).
analiza statystyczna
wyniki zainteresowania zgłaszane w więcej niż jednym badaniu to indeks serca, PCWP i śmiertelność. Dla każdego wyniku wyodrębniono statystykę podsumowującą (średnie ± odchylenie standardowe) przed i po interwencji lub różnicę między wartością początkową a po leczeniu. Te zbiorcze statystyki zostały wyodrębnione oddzielnie dla grup leczonych i grup kontrolnych / placebo. Wyniki diagnostyczne i efekty leczenia oceniano na podstawie różnicy w średnich przed i po interwencji oraz związanego z tym 95% przedziału ufności. Do wizualnej oceny heterogeniczności (I2) w badaniach wykorzystano Działki Leśne. Łączny efekt diagnostyczny i terapeutyczny oraz związany z nim 95% przedział ufności oszacowano za pomocą efektu stałego (I2 < 49%) lub modelu efektu losowego (I2 > 50%). Wartość P > 0,05 została uznana za statystycznie istotną.
wyniki
charakterystyka badania
dwanaście (12) randomized controlled trials (rcts) spełniło kryteria włączenia. Do siedmiu (7) badań zakwalifikowano pacjentów z LoHF, a do pozostałych pięciu (5) zakwalifikowano pacjentów z HF, którzy przeszli operację kardiochirurgiczną z małym wysiłkiem sercowym. Większość opublikowanych badań klinicznych (10) badała leki porównujące wpływ różnych typów inotropów na hemodynamikę i zapobieganie śmierci: tylko dobutamina , dobutamina i dopamina ; levosimendan i dobutamina oraz levosimendan i placebo . Z pozostałych dwóch badań klinicznych, każdy badany lek rozszerzający naczynia krwionośne (nitroprusyd) i placebo oraz terapia przyrządowa (iabp) i inotropowa (levosimendan) w monoterapii lub w skojarzeniu z IAPB . Łącznie w 12 badaniach klinicznych uczestniczyło 3738 pacjentów, średnia wieku 64 lat (zakres = 55-74 lata), z czego większość stanowili mężczyźni (78%).
synteza wyników
dane diagnostyczne dotyczące LoHF były niespójne. W ciągu dwunastu badań klinicznych nie pojawiła się wspólna definicja LoHF, która byłaby przydatna do kierowania diagnozą. Kryteria hemodynamiczne stosowane do włączenia pacjentów do badań obejmowały CI < 2,0 L/min/m2 , CI < 2,2 L/min/m2 lub CI < 2,5 L/min/m2 i PCWP > 15 mmHg Lub ≥18 mmHg . Definicja różniła się również w różnych badaniach – stan pooperacyjny z niedociśnieniem (ciśnienie skurczowe < 90 mmHg Dla > 30 minut) lub potrzeba inotropowego wsparcia w celu utrzymania ciśnienia skurczowego > 90 mmHg I hipoperfuzja narządu końcowego (zimne obwody, wyjście moczu < 30 ml/godz.) . Wstrząs kardiogenny został opisany jako złożony zespół obejmujący kaskadę ostrej dysfunkcji LV, zmniejszenie stężenia CO, niedociśnienie i hipoperfuzję tkanek .
Fig.5 i 6 przedstawiają wykresy leśne dla znormalizowanej średniej wskaźnika serca na początku badania i odpowiednio po terapii inotropowej lub rozszerzającej naczynia krwionośne. Początkowy wskaźnik serca wzrósł ze średniej wartości 1,93 (95% CI: 1,91-1,95) do średniej wartości po leczeniu 2,82 (95% CI: 2,80-2,84). 7 przedstawia wykres leśny dla standardowej średniej różnicy (SMD) wskaźnika serca po leczeniu lewosimendanem i dobutaminą. Levosimendan osiąga wyższy wskaźnik serca w porównaniu z dobutaminą (SMD: 2,82; 95% CI: 2,54-3,10). Jako środek profilaktyczny przeciwko LoHF u pacjentów pooperacyjnych, wlew lewosimendanu po znieczuleniu osiągnął wyższy wskaźnik Kardiologiczny (2,57) w porównaniu z przedoperacyjnym IABP (2,3) lub w skojarzeniu z levosimendanem (2,4). Rysunek 8 przedstawia wykres śmiertelności pomiędzy levosimendanem a placebo. Lewozymendan wykazywał mniejszą śmiertelność w porównaniu z placebo (iloraz szans : 0,83; 95% CI: 0,59-1,18), ale różnica nie była statystycznie istotna (p=0,30). Końcowy, Rysunek 9 dalej pokazuje, że Levosimendan ma niższy wskaźnik śmiertelności w porównaniu z dobutaminą (lub: 0,65; 95% CI: 0,39-1.08) but the difference was not statistically significant (p=0.10).
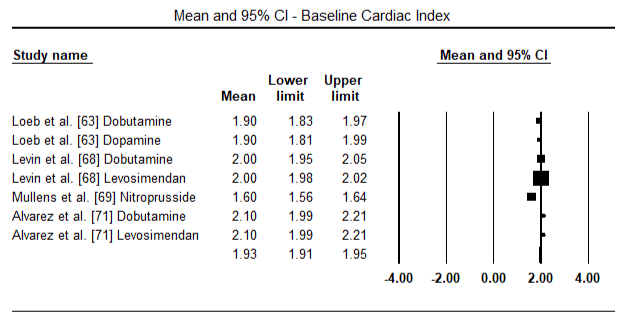
Figure 5. Mean baseline cardiac index
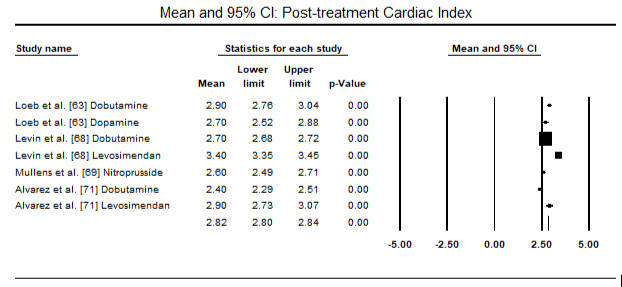
Figure 6. Mean post-treatment cardiac index
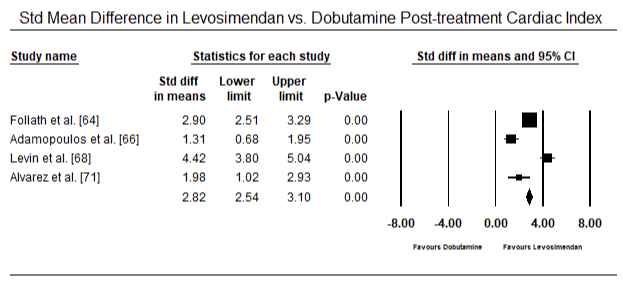
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
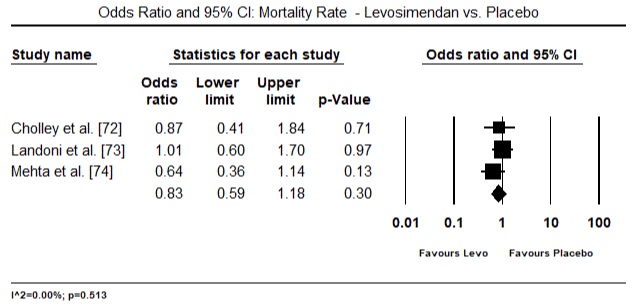
Figure 8. Mortality rate between levosimendan and placebo
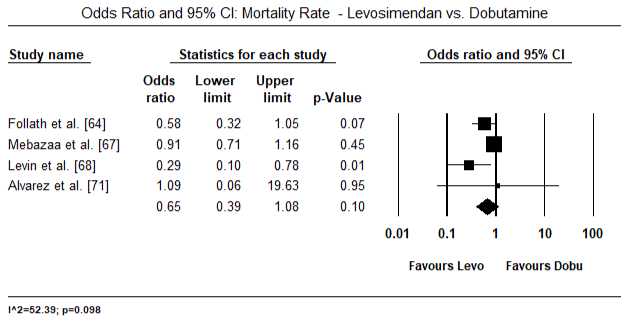
Figure 9. Wskaźnik umieralności pomiędzy levosimendanem i dobutaminą
omówienie wyników
Ten systematyczny przegląd i metaanaliza oceniały wspólne cechy diagnostyczne i wyniki leczenia pacjentów z LoHF w terapii medycznej i przyrządowej (iabp). Wyniki wskazują, że pacjenci z LoHF nie mają powszechnie akceptowanych lub standaryzowanych cech diagnostycznych. Chociaż pacjenci z LoHF mogą wykazywać kilka cech, w tym indeks serca, PCWP, ciśnienie skurczowe i SvO2, aby sugerować lub wspierać diagnostykę kliniczną, wszystkie te cechy mają różne wartości odcięcia w badaniach. Indeks serca, który jest najczęstszą cechą kliniczną wykazującą stan niskiego wyjścia w LoHF, ma trzy wartości odcięcia: <2,0 L/min/m2 , <2,2 L/min/m2 lub < 2,5 L/min/m2 . Wsparcie inotropowe pojawiło się jako bardzo częsta interwencja w celu poprawy perfuzji i normalizacji pojemności minutowej serca u pacjentów z LoHF.
leki inotropowe, takie jak levosimendan, dobutamina, dopamina, środek rozszerzający naczynia krwionośne (nitroprusyd) i IABP znacznie poprawiły CI między początkowym i po leczeniu. Pod względem inotropów levosimendan jest bardziej skuteczny w poprawie stabilności hemodynamicznej i lepszej profilaktyce przed krótkotrwałą śmiercią (śmiertelność 30-dniowa) niż dobutamina. Ponadto inotropy mogą działać profilaktycznie przeciwko rozwojowi pooperacyjnego LoHF. Z drugiej strony, podczas gdy inotropy poprawiają hemodynamikę i normalizują pojemność minutową serca, nie zapewniają znacznie lepszej ochrony przed śmiertelnością, niezależnie od rodzaju stosowanego inotropu.
rola inotropów w leczeniu LoHF została poparta poprzednim przeglądem środków inotropowych i strategii rozszerzających naczynia w leczeniu wstrząsu kardiogennego i LCOS . W przeglądzie stwierdzono, że inotropy poprawiają hemodynamikę, zdarzenia niepożądane w LCO pooperacyjnych i zmniejszoną śmiertelność. Nowsze inotropy, takie jak levosimendan (substancja uczulająca wapń i inodilator), są dodatnimi inotropami, które mają pewne właściwości rozszerzające naczynia . Można go również uznać za selektywny środek rozszerzający naczynia wątrobowe, który może poprawić przepływ żylny wrotny przez tętnicę wątrobową i przepływ żylny wrotny w porównaniu z dobutaminą, która może poprawić przepływ żylny wrotny bez rozszerzania naczyń tętnicy wątrobowej . Levosimendan nie zwiększa również zapotrzebowania na tlen w mięśniu sercowym i zaleca się stosowanie dobutaminy u pacjentów z ostrym niedokrwieniem mięśnia sercowego lub po operacji kardiochirurgicznej . W przypadku pooperacyjnego LoHF ochronne działanie inotropów przeciwko krótkoterminowej śmiertelności (30-dniowa śmiertelność) pozostaje nieznaczne w porównaniu z placebo .
obecny przegląd systematyczny i metaanaliza mają pewne istotne ograniczenia. LoHF może wystąpić wtórnie do podstawowych chorób serca, takich jak ostry zawał mięśnia sercowego lub pooperacyjny. Większość badań obejmowała badane pooperacyjne LoHF z mniejszą ilością lohf z innych przyczyn. Większość badań koncentrowała się na dwóch inotropach (Levosimendan i dobutamina), ograniczając zrozumienie innych inotropów, a także innych terapii, takich jak terapie urządzeń. W niektórych badaniach analiza była narażona na ryzyko błędnej klasyfikacji ze względu na znaczną liczbę pacjentów, którzy utracili kontrolę. Ponieważ większość badań nie zgłasza różnicy przed i po interwencji w parze z powiązanym odchyleniem standardowym, różnica przed i po interwencji z odchyleniem standardowym, miary wyników przed i po interwencji jako niezależne, to uzyskanie przedziałów ufności Sidera dla efektu leczenia z powiązanym odchyleniem standardowym.
wniosek
niska wyjściowa niewydolność serca (ang. Low-output heart failure, LoHF) to zespół kliniczny charakteryzujący się zmniejszonym wysiłkiem serca, któremu towarzyszy hipoperfuzja narządu końcowego. Jest to rzadka forma niewydolności serca w populacji ogólnej, ale rozpowszechniona u pacjentów po operacji HF. Jego etiologia jest niejednorodna, składa się z różnych stanów powodujących stan niskiego wyjścia i kardiochirurgii. Głównymi mechanizmami patofizjologicznymi są zaburzenia skurczowe i (lub) rozkurczowe LV oraz zaburzenia RV spowodowane zmianami częstości akcji serca, napięcia wstępnego, obciążenia końcowego i (lub) kurczliwości. Ogólne czynniki ryzyka lohf obejmują chorobę Chagasa, obniżoną frakcję wyrzutową i zaburzenia czynności nerek, podczas gdy u pacjentów pooperacyjnych występują zaburzenia czynności LV, niepełna rewaskularyzacja, starszy wiek oraz obecność cukrzycy i zaburzeń czynności nerek. Diagnoza nie ma znormalizowanych wytycznych i zależy od przyjętego gromadzenia aberracji hemodynamicznych i fizjologicznych, w tym warunków powodujących stan niskiego wyjściowego. Wywiad pacjenta i badanie fizykalne pomagają ocenić stan hemodynamiczny i rozpoznawać stan niskiego wyjścia, podczas gdy echokardiografia potwierdza dysfunkcję komorową (HF) i niską wydajność sercową. Inne badania wspierające diagnozę lub ustalenie przyczyny stanu niskiego wyjściowego obejmują elektrokardiogram i podstawowe badania laboratoryjne (krew, elektrolit w surowicy, mocznik i kreatynina, test wątroby, czynność tarczycy i surowicze peptydy natriuretyczne) i obrazowanie serca (RTG klatki piersiowej lub angiografia wieńcowa). Leczenie nie ma ustalonych wytycznych, ale zależy od oceny indywidualnej patofizjologii, aby wybrać najbardziej odpowiednią strategię leczenia. Leczenie obejmuje strategie respiratora w celu poprawy częstości akcji serca i rytmu; regulacja objętości w celu optymalizacji obciążenia wstępnego; wsparcie farmakologiczne (inotropy i leki rozszerzające naczynia krwionośne) w celu manipulowania obciążeniem wtórnym i poprawy kurczliwości; i terapia urządzenia (wewnątrzaortalna pompa balonowa lub urządzenie wspomagające komorę), gdy strategie te nie przywracają pojemności minutowej serca. U wybranych pacjentów, terapie w celu odwrócenia choroby podstawowej, może przywrócić pojemność minutową serca.
- Inamdar a, Inamdar a (2016) Diagnostyka niewydolności serca, zarządzanie i wykorzystanie. J Clin Med 5: 62
- Dassanayaka s, Jones SP (2015) Recent developments in heart failure. Circ Res 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio a, Bohm M, et al. (2012) Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 Of The European Society of Cardiology. Opracowany we współpracy ze Stowarzyszeniem niewydolności serca (HFA) ESC. Eur J Heart Fail 14: 803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, et al. (2013) 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation / American Heart Association Task Force on Practice Guidelines. J am Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 wytyczne ESC w diagnostyce i leczeniu ostrej i przewlekłej niewydolności serca: Grupa Zadaniowa ds. diagnostyki i leczenia ostrej i przewlekłej niewydolności serca Europejskiego Towarzystwa Kardiologicznego (ESC) opracowała specjalny wkład Stowarzyszenia niewydolności serca (HFA) ESC. Eur Heart J 37: 2129-2200.
- Masse L, Antonacci M (2005) Low cardiac output syndrome: identification and management. Crit Care Nurs Clin 17: 375-383.
- Poppas A, Rounds S (2002) Am J Respir Crit Care Med 165: 4-8.
- Nieminen MS, Bohm m, Cowie MR, Drexler H, Filippatos GS, et al. (2005) executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the task Force on Acute Heart Failure of the European Society of Cardiology. Eur Heart J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) Cardiac performance and mortality early after intracardiac surgery in infants and small children. Obieg 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL, et al. (1995) przebieg pooperacyjny i profil hemodynamiczny po operacji przełącznika tętniczego u noworodków i niemowląt: porównanie bypassu krążeniowo-oddechowego o niskim przepływie i zatrzymania krążenia. Obieg 92: 2226-2235.
- Hogue CW Jr, Sundt t 3rd, Barzilai B, Schectman KB, Dávila-Román VG (2001) cardiac and neurologic complications identify risk for mortality for both men and women through coronary artery bypass graft surgery. Anestezjologia 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, et al. (1996) Predictors of low cardiac output syndrome after coronary artery bypass. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ, et al. (2010) Epidemiology and new predictors of low cardiac output syndrome after isolated coronary artery bypass przeszczep. Eur Serce J 31: 68-69.
- Sá MP, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC, et al. (2012) czynniki ryzyka zespołu niskiego wyjścia sercowego po operacji pomostowania tętnic wieńcowych. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) Predictors of low cardiac output syndrome after isolated coronary artery bypass surgery: trends over 20 years. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) zarządzanie zespołem niskiego wyjścia sercowego po operacji wrodzonej choroby serca. Curr Cardiol Rev 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, FOMINSKIY EV, Karaskov AM (2017) Zespół niskiego wyjścia sercowego po operacji serca. J Cardiothorac Vasc 31: 291-308.
- Tibby SM., Murdoch IA (2003) Monitoring cardiac function in intensive care. Arch Dis Child 88: 46-52.
- Carcillo JA, Field AI (2002) Clinical practice parameters for hemodynamic support of pediatric and neonatal patients in septic shock. Crit Care Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo z, CAO DJ, Troncoso R, et al. (2011) cardiomyocyte death: mechanisms and translational implications. Śmierć komórki & choroba 2: e244.
- tavernarakis N (2007) martwica kardiomiocytów: alternatywne mechanizmy, skuteczne interwencje. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research 1773: 480-482.
- Dorn GW (2008)apoptotyczna i nieapoptotyczna zaprogramowana śmierć kardiomiocytów w przebudowie komór. Cardiovasc Res 81: 465-473.
- Richard Conti C (1991) the stunned and hibernating myocardium: a brief review. Clin Cardiol 14: 708-712.
- Alsaddique AA, Royse CF, Fouda MA, Royse AG (2012)rozkurczowa niewydolność serca po operacji serca. W chorobie wieńcowej-aktualne koncepcje w Epidemiologii, patofizjologii, diagnostyce i leczeniu 2012. InTech.
- Kass DA, Bronzwaer JG, Paulus WJ (2004) jakie mechanizmy leżą u podstaw dysfunkcji rozkurczowej w niewydolności serca? Circ Res 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) niewydolność serca z zachowaną frakcją wyrzutową: patofizjologia, diagnostyka i leczenie. Eur Heart J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) is Phospholamban or Troponin I the „prima Donna” in β-adrenergic Induced Lusitropy? Circ Res 101: 326-327.
- Paulus WJ, Vantrimpont PJ, Shah AM (1994) Acute effects of nitric oxide on left ventricular relaxation and diastolic distentibility in humans. Ocena za pomocą dwukoronowego wlewu nitroprusydku sodu. 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, et al. (1999) Prevalence of Left Ventricular Diastolic Filling abnorrnalities in Adult Cardiac surgery Patients: an Intraoperative Echo cardiographic Study. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru a, Carrier m, et al. (2006) dwukomorowe wzory wypełniania rozkurczowego po operacji pomostowania tętnic wieńcowych. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone e, Bodini BD, Mazza a, Allegra L (2005) pulmonary arterial hypertension: the key role of echocardiography. Klatka piersiowa 127: 1836-1843.
- Zochios V, Jones N (2014) Acute right heart syndrome in the critically ill patient. Heart lung vessel 6: 157-170.
- Fletcher N, Geisen m, Meeran H, Spray D, Cecconi M (2015) wstępne doświadczenie kliniczne ze zminiaturyzowaną sondą echokardiograficzną przez przełyk na oddziale intensywnej terapii serca. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, Vokonas PS, Urschel CW, Sonnenblick EH (1971) Performance of the right ventricle under stress: Relation to right coronary flow. J Clin Invest 50: 2176-2183.
- cena LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) Pulmonary vascular and right ventricular dysfunction in adult critical care: Current and emerging options for management: a systematic literature review. Crit Care 14: R169.
- Pfisterer M (2003) udział prawej komory w zawale mięśnia sercowego i wstrząsie kardiogennym. Lancet 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao EC, et al. (2011) Predictors of low cardiac output in decompensated severe heart failure. Klinik 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) Clinical outcome of urgent coronary artery bypass grafting. J Korean Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) Predictors of low cardiac output syndrome after isolated aortic valve surgery. Obieg 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, et al. (2013) Evaluation of nutritional screening tools for patients planed to cardiac surgery. Nutrition 29: 436-442.
- Hernández-Leiva E, Dennis R, Isaza D, Umaña JP (2013) hemoglobina i peptyd natriuretyczny typu B wartości przedoperacyjne, ale nie markery zapalne, są związane z chorobowością pooperacyjną w kardiochirurgii: prospektywne badanie analityczne kohorty. J Cardiothorac Surg 8: 170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, et al. (2011)przedoperacyjna całkowita liczba limfocytów we krwi obwodowej jako czynnik predyktor złego wyniku w kardiochirurgii dorosłych. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, et al. (2009) N-terminal Pro-B-type natriuretic peptide levels and early outcome after cardiac surgery: a prospective cohort study. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, et al. (2004) użyteczność peptydu natriuretycznego typu B w przewidywaniu powikłań pooperacyjnych i wyników u pacjentów poddawanych operacji serca. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, et al. (2007) Relationship between admission serum sodium concentration and clinical outcomes in patients hospitalized for heart failure: an analysis from the OPTIMIZE – HF registry. Eur Heart J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL, et al. (2005) in-hospital mortality in patients with acute decompensated heart failure requiring dożylnie vasoactive medicines: an analysis from the Acute Decompensated Heart Failure National Registry (ADHERE). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, Piano M, et al. (2000) Team management of patients with heart failure: a statement for healthcare professionals from the Cardiovascular Nursing Council of the American Heart Association. Obieg 102: 2443-24456.
- Stevenson LW, Perloff JK (1989) the limited reliability of physical signs for estimating hemodynamics in chronic heart failure. Jama 261: 884-888.
- Nohria a, Tsang SW, Fang JC, Lewis EF, Jarcho JA, et al. (2003) Clinical assessment identyfikuje profile hemodynamiczne, które przewidują wyniki u pacjentów przyjętych z niewydolnością serca. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) Medical therapy of acute myocardial infarction by application of hemodynamic subsets. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis e, Stevenson LW (2002) Medical management of advanced heart failure. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, Lang RM (2007) Echocardiography in heart failure: applications, utility, and new horizons. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, et al. (2011) Echokardiograficzna ocena hemodynamiki u pacjentów z niewyrównaną skurczową niewydolnością serca. Circ Cardiovasc Imaging 4: 220-227.
- Lang RM, badano LP, Mor-Avi V, Afilalo J, Armstrong A, et al. (2015) zalecenia dotyczące kwantyfikacji komory serca przez echokardiografię u dorosłych: aktualizacja Amerykańskiego Towarzystwa echokardiografii i Europejskiego Stowarzyszenia obrazowania sercowo-naczyniowego. Eur Heart J Cardiovasc Imaging 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, et al. (2014) kryteria adekwatności do stosowania obrazowania sercowo-naczyniowego w niewydolności serca: raport z przeglądu literatury. Eur Heart J Cardiovasc Imaging 16: 147-153.
- Gimelli a, Lancellotti P, Badano LP, Lombardi M, Gerber B, et al. (2014) nieinwazyjna ocena obrazowania Kardiologicznego pacjentów z przewlekłą niewydolnością serca skurczową: raport Europejskiego Stowarzyszenia obrazowania sercowo-naczyniowego (EACVI). Eur Heart J 35: 3417-3425.
- Vazir a, Cowie MR (2012) ocena ostrej niewyrównanej niewydolności serca: strategie i narzędzia. Eur Cardiol 8: 128-133.
- Gray a, Goodacre S, Newby DE, Masson m, Sampson F, et al. (2008) nieinwazyjna wentylacja w ostrym kardiogennym obrzęku płuc. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kałuski E (2008) monitorowanie hemodynamiczne w ostrej niewydolności serca. Crit Care Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) the intra-aortic balloon pump in heart failure management: implications for nursing practice. Aust Crit Care 22: 125-131.
- Slaughter MS, Singh r (2012) the role of ventricular assist devices in advanced heart failure. Revista Española de Cardiologia 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, GHEORGHIADE M, Swedberg K, et al. (2001) Hemodynamic profiles of advanced heart failure: association with clinical characteristics and long-term outcomes. J Card Fail 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) wyższość dobutaminy nad dopaminą w zwiększaniu pojemności minutowej serca u pacjentów z przewlekłą niską wyjściową niewydolnością serca. Obieg 55: 375-378.
- Follath F, Cleland JG, Just H, Papp JG, Scholz h, et al. (2002) skuteczność i bezpieczeństwo dożylnego stosowania lewosimendanu w porównaniu z dobutaminą w ciężkiej niewydolności serca o niskiej mocy wyjściowej (badanie LIDO): randomizowane badanie z podwójnie ślepą próbą. The Lancet 360: 196-202.
- Nishimura RA, Grantham ja, Connolly HM, Schaff HV, Higano ST, et al. (2002) Low-output, low-gradient stenosis in patients with depressed left ventricular systolic function: the clinical utility of the dobutamine challenge in the catheterization laboratory. Obieg 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D, et al. (2006) Effects of levosimendan versus dobutamine on inflammatory and apoptotic pathways in acutely decompensated chronic heart failure. Am J Cardiol 98: 102-106.
- Mebazaa a, Nieminen MS, Packer M, Cohen-Solal a, Kleber FX, et al. (2007) Survive Investigators. Levosimendan vs dobutamina dla pacjentów z ostrą niewyrównaną niewydolnością serca: randomizowane badanie przetrwania. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, et al. (2008) środek uczulający wapń levosimendan daje lepsze wyniki dobutaminy w pooperacyjnym zespole niskiego wyjścia sercowego. Hiszpański Journal of Cardiology (English edition) 61: 471-479.
- Mullens w, Abrahams Z, Francis GS, Skouri HN, Starling RC i in. (2008) nitroprusydek sodu dla advanced low-output heart failure. J Am Coll Cardiol 52: 200-207.
- Lomivorotov V. V., Boboshko V. A., Efremov S. M., Kornilov I. A., Czerniawski A. M. i in. (2012) Lewosimendan vs.wewnątrzaortowa pompa powietrza u wysoce ryzykownych pacjentów kardiologicznych. J Cardiothorac Vasc Anesth 26: 596-603.
- Alvarez J, Baluja a, Selas S, Otero P, Rial M itp. (2013) a comparison of doubutamine and levosimendan N hepatic blood flow in patients with a low cardiac output state after cardiac surgery: a randomized controlled study. Anaesth Intensive Care 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, et al. (2017) wpływ levosimendanu na zespół niskiego wyjścia sercowego u pacjentów z niską frakcją wyrzutową poddawanych przeszczepowi pomostowania tętnic wieńcowych z pominięciem krążeniowo-płucnym: randomizowane badanie kliniczne LICORN. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano a, et al. (2017) Levosimendan do wsparcia hemodynamicznego po operacji serca. N Engl J Med 376: 2021-2031.
- Mehta Rh, Leimberger JD, Van Diepen S, Meza J, Wang A, et al. (2017) Levosimendan u pacjentów z dysfunkcją lewej komory w trakcie operacji serca. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich EC, Strobl H, Prondzinsky R, Weiche s, et al. (2018) środki inotropowe i strategie rozszerzające naczynia krwionośne w leczeniu wstrząsu kardiogennego lub zespołu niskiego wyjścia sercowego. Biblioteka Cochrane. 2 : 1-10.