2.1: Evolution of Atomic Theory
Atomic Theory after the Nineteenth Century
If matter were composed of atoms, what were atoms composed of? Eram as partículas mais pequenas ou havia algo mais pequeno? No final de 1800, uma série de cientistas interessados em questões como estas investigaram as descargas elétricas que poderiam ser produzidas em gases de baixa pressão, com a descoberta mais significativa feita pelo físico inglês J. J. Thomson usando um tubo de raios catódicos. Este aparelho consistia num tubo de vidro selado do qual quase todo o ar tinha sido removido; o tubo continha dois eléctrodos de metal. Quando a alta voltagem foi aplicada através dos eletrodos, um feixe visível chamado raio catódico apareceu entre eles. Este feixe foi desviado para a carga positiva e para longe da carga negativa, e foi produzido da mesma forma com propriedades idênticas quando diferentes metais foram usados para os eletrodos. In similar experiments, the ray was simultaneously deflected by an applied magnetic field, and measurements of the extent of deflection and the magnetic field strength allowed Thomson to calculate the charge-to-mass ratio of the cathode ray particles. Os resultados destas medições indicaram que estas partículas eram muito mais leves do que os átomos (figura \(\PageIndex{1}\)).
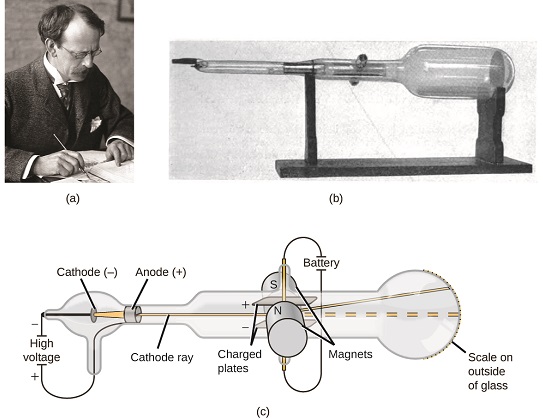
Figura \(\PageIndex{5}\): (a) J. J. Thomson produziu um feixe de luz visível em um tubo de raios catódicos. (b) Este é um tubo de raios catódicos, inventado em 1897 por Ferdinand Braun. c) no raio catódico, o feixe (apresentado em amarelo) provém do cátodo e é acelerado para além do ânodo em direcção a uma escala fluorescente na extremidade do tubo. As deflexões simultâneas por campos elétricos e magnéticos aplicados permitiram a Thomson calcular a razão massa-carga das partículas que compõem o raio catódico. (credit a: modification of work by Nobel Foundation; credit b: modification of work by Eugen Nesper; credit c: modification of work by “Kurzon”/Wikimedia Commons).
Baseado em suas observações, aqui está o que Thomson propôs e o porquê: As partículas são atraídos pelo pólo positivo (+) encargos e repelidos pelo terminal negativo (−) despesas, por isso devem ser carregadas negativamente (como encargos repelir e, ao contrário de encargos de atrair); eles são menos massivo do que átomos e indistinguíveis, independentemente do material de origem, para que eles devem ser fundamental, subatômicas constituintes de todos os átomos. Embora controversa na época, a ideia de Thomson foi gradualmente aceita, e sua partícula de raios catódicos é o que agora chamamos de elétron, uma partícula subatômica carregada negativamente com uma massa mais de mil vezes menor que a de um átomo. O termo “elétron “foi cunhado em 1891 pelo físico irlandês George Stoney, de “Ion elétrico”.”
In 1909, more information about the electron was uncovered by American physicist Robert A. Millikan via his “oil drop” experiments. Millikan criou gotículas de óleo microscópicas, que poderiam ser eletricamente carregadas por fricção à medida que se formavam ou usando raios-X. Estas gotículas inicialmente caíram devido à gravidade, mas seu progresso descendente poderia ser retardado ou até mesmo revertido por um campo elétrico mais baixo no aparelho. Ajustando a intensidade do campo elétrico e fazendo medições cuidadosas e cálculos apropriados, Millikan foi capaz de determinar a carga em gotas individuais (figura \(\PageIndex{2}\)).
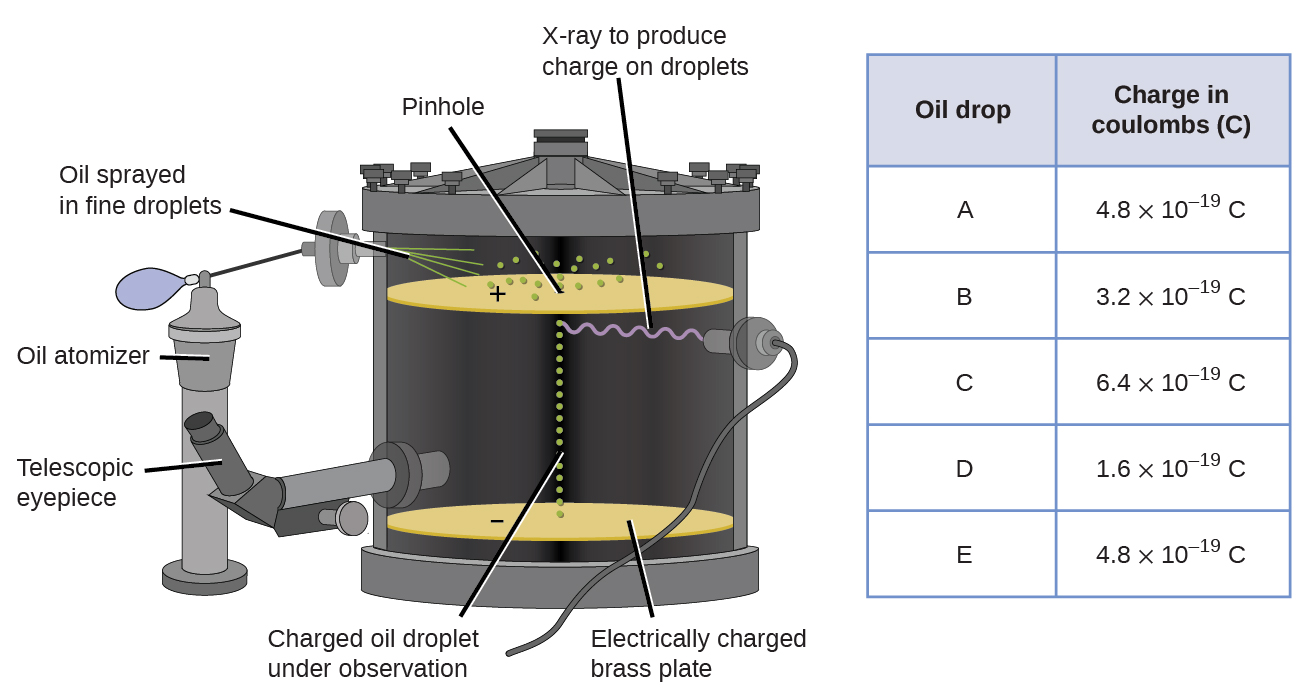
figura \(\PageIndex{6}\): O experimento de Millikan mediu a carga de gotas de óleo individuais. Os dados tabulados são exemplos de alguns valores possíveis.
Olhando para a carga de dados que Millikan reunidos, você pode ter reconhecido que a taxa de uma gota de óleo é sempre um múltiplo de uma cobrança específica, 1.6 \(\times\) 10-19 C. Millikan, concluiu-se que este valor deve ser, portanto, fundamental carga—carga de um único elétron—com a sua medida encargos devido a um excesso de um elétron (1 de 1 vezes.6 \(\vezes\) 10-19 c) , dois electrões (2 vezes 1,6 \(\vezes\) 10-19 c), três electrões (3 vezes 1,6 \(\vezes\) 10-19 C), e assim por diante, numa dada gota de óleo. Uma vez que a carga de um elétron era agora conhecida devido à pesquisa de Millikan, e a relação carga-massa já era conhecida devido à pesquisa de Thomson (1,759 \(\vezes\) 1011 C/kg), ele só necessitava de um cálculo simples para determinar a massa do elétron também.
\
Cientistas já tinham estabelecido que o átomo não era indivisível como Dalton tinha acreditado, e devido ao trabalho de Thomson, Millikan, e outros, a carga e a massa de negativa, as partículas subatômicas—os elétrons—eram conhecidos. No entanto, a parte positivamente carregada de um átomo ainda não era bem compreendida. Em 1904, Thomson propôs o modelo de” pudim de ameixa ” de átomos, que descrevia uma massa positivamente carregada com uma quantidade igual de carga negativa na forma de elétrons embutidos nele, uma vez que todos os átomos são eletricamente neutros. Um modelo concorrente tinha sido proposto em 1903 por Hantaro Nagaoka, que postulou um átomo semelhante a Saturno, consistindo de uma esfera positivamente carregada cercada por um halo de elétrons (figura \(\PageIndex{3}\)).
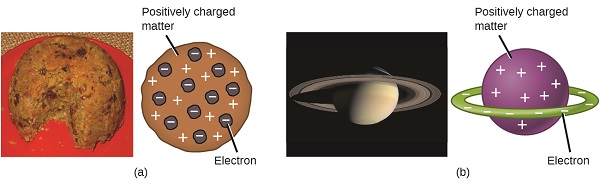
figura \(\PageIndex{7}\): (a) Thomson sugeriu que os átomos se assemelhavam a pudim de ameixa, uma sobremesa inglesa consistindo de bolo úmido com passas incorporadas (“ameixas”). (B) Nagaoka propôs que átomos semelhantes ao planeta Saturno, com um anel de elétrons em torno de um planeta positivo.”(credit a: modification of work by”Man vyi “/Wikimedia Commons; credit b: modification of work by”NASA” /Wikimedia Commons).
O próximo grande desenvolvimento na compreensão do átomo veio de Ernest Rutherford, físico, da Nova Zelândia, que em grande parte passou a sua carreira científica no Canadá e Inglaterra. Ele realizou uma série de experimentos usando um feixe de alta velocidade, com carga positiva partículas alfa (partículas α) que foram produzidos pelo decaimento radioativo do rádio; α partículas consistem em dois prótons e dois nêutrons (você aprenderá mais sobre decaimento radioativo no capítulo sobre química nuclear). Rutherford e seus colegas Hans Geiger (mais tarde famoso para o contador Geiger) e Ernest Marsden visando um feixe de partículas α, a fonte da qual foi incorporado em um bloco de chumbo de absorver grande parte da radiação, em uma parte muito fina folha de ouro, e examinou a resultante do espalhamento de partículas α usando uma tela luminescente que brilhou por instantes onde atingido por um α de partículas.
O que descobriram? A maioria das partículas atravessou a folha sem serem desviadas. No entanto, alguns foram desviados ligeiramente, e um número muito pequeno foi desviado quase diretamente para trás em direção à fonte (figura \(\PageIndex{4}\)). Rutherford descreveu encontrando esses resultados: “foi o evento mais incrível que já aconteceu comigo na minha vida. Foi quase tão incrível como se você tivesse disparado uma concha de 15 polegadas em um pedaço de papel tissue e ele voltou e bateu em você”1 (p. 68).
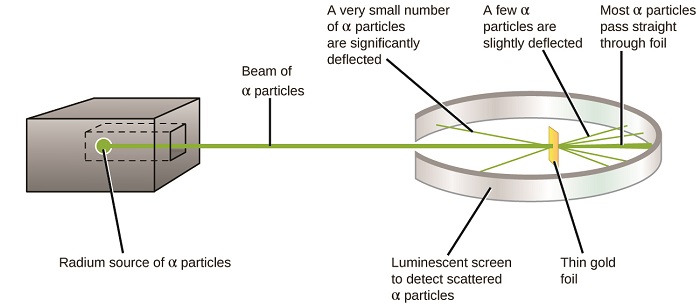
figura \(\PageIndex{8}\): Geiger e Rutherford dispararam partículas α num pedaço de folha de ouro e detectaram onde essas partículas foram, como mostrado neste diagrama esquemático da sua experiência. A maioria das partículas passou diretamente através da folha, mas algumas foram desviadas ligeiramente e um número muito pequeno foi significativamente desviado.
Aqui está o que Rutherford deduziu: Porque a maioria dos rápido movimento de partículas α passaram pelo ouro átomos undeflected, eles devem ter viajado através, essencialmente, o espaço vazio dentro do átomo. Partículas alfa são carregadas positivamente, então deflexões surgiram quando eles encontraram outra carga positiva (como cargas repelem uns aos outros). Como as cargas se repelem umas às outras, as poucas partículas α carregadas positivamente que mudaram os caminhos abruptamente devem ter atingido, ou se aproximado de perto, outro corpo que também tinha uma carga positiva altamente concentrada. Uma vez que as deflexões ocorreram uma pequena fração do tempo, esta carga ocupou apenas uma pequena quantidade do espaço na folha de ouro. Analisando uma série de experiências em detalhe, Rutherford tirou duas conclusões:
- o volume ocupado por um átomo deve consistir numa grande quantidade de espaço vazio.
- um pequeno, relativamente pesado, corpo positivamente carregado, o núcleo, deve estar no centro de cada átomo.
Esta análise levou Rutherford a propor um modelo no qual um átomo consiste de um muito pequeno, com carga positiva do núcleo, em que a maior parte da massa do átomo está concentrada, rodeado por elétrons carregados negativamente, de modo que o átomo é eletricamente neutro (Figura \(\PageIndex{5}\)).
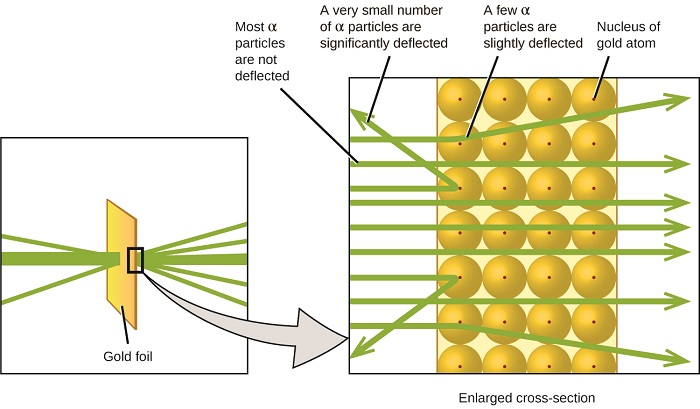
figura \(\PageIndex{9}\): as partículas α São deflectidas apenas quando colidem com ou passam perto do núcleo de ouro muito mais pesado e carregado positivamente. Como o núcleo é muito pequeno em comparação com o tamanho de um átomo, muito poucas partículas α são desviadas. A maioria passa pela região relativamente grande ocupada por elétrons, que são muito leves para desviar as partículas em movimento rápido.
Depois de muitos outros experimentos, Rutherford também descobriu que os núcleos de outros elementos contêm o núcleo de hidrogênio como um “bloco de construção”, e nomeou esta partícula mais fundamental o próton, a partícula subatômica positivamente carregada encontrada no núcleo. Com uma adição, que você aprenderá a seguir, este modelo nuclear do átomo, proposto há mais de um século, ainda é usado hoje.
outra descoberta importante foi a descoberta de isótopos. Durante o início de 1900, os cientistas identificaram várias substâncias que pareciam ser novos elementos, isolando-os de minérios radioativos. Por exemplo, um” novo elemento ” produzido pelo decaimento radioativo do tório recebeu inicialmente o nome de mesotório. No entanto, uma análise mais detalhada mostrou que o mesotório era quimicamente idêntico ao rádio (outro produto de decaimento), apesar de ter uma massa atômica diferente. Este resultado, juntamente com achados semelhantes para outros elementos, levou o químico inglês Frederick Soddy a perceber que um elemento poderia ter tipos de átomos com massas diferentes que eram quimicamente indistinguíveis. Estes tipos diferentes são chamados de isótopos-átomos do mesmo elemento que diferem em massa. Foi agraciado com o Nobel de Química de 1921 por esta descoberta.
um quebra-cabeça permaneceu: o núcleo era conhecido por conter quase toda a massa de um átomo, com o número de prótons fornecendo apenas metade, ou menos, dessa massa. Diferentes propostas foram feitas para explicar o que constituía a massa restante, incluindo a existência de partículas neutras no núcleo. Como seria de esperar, detectar partículas não carregadas é muito desafiador, e foi só em 1932 que James Chadwick encontrou provas de neutrões, não carregados, partículas subatómicas com uma massa aproximadamente igual à dos protões. A existência do nêutron também explicou isótopos: eles diferem em massa porque têm números diferentes de nêutrons, mas eles são quimicamente idênticos porque eles têm o mesmo número de prótons. Isto será explicado mais detalhadamente mais adiante nesta unidade.