5.3: Lewis Diagramas
Lewis utilizados diagramas simples (agora chamado Lewis diagramas) para manter o controle de quantos elétrons estão presentes na ultraperiféricas, ou valence shell de um dado átomo. O núcleo do átomo, isto é, o núcleo juntamente com os elétrons internos, é representado pelo símbolo químico, e apenas os elétrons de Valência são desenhados como pontos em torno do símbolo químico. Assim, os três átomos mostrados na Figura 1 a partir de elétrons e Valência podem ser representados pelos seguintes diagramas de Lewis::
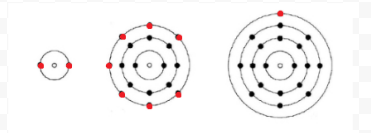

Se o átomo é um átomo de gases nobres, dois procedimentos alternativos são possíveis. Ou podemos considerar o átomo como tendo electrões de Valência zero ou podemos considerar a camada exterior cheia como a camada de Valência. Os três primeiros gases nobres, portanto, pode ser escrito como:
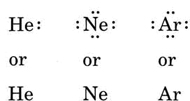
Exemplo de \(\PageIndex{1}\): Estruturas de Lewis
Desenhar diagramas de Lewis para um átomo de cada um dos seguintes elementos: Li, N, F, Na
solução
encontramos na tabela periódica dentro da capa que Li tem um número atômico de 3. Contém assim três elétrons, um a mais do que o gás nobre. Isto significa que a concha externa, ou Valência, contém apenas um elétron, e o diagrama de Lewis é
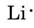
Seguindo o mesmo raciocínio, N tem sete elétrons, cinco a mais do que Ele, enquanto que F tem nove elétrons, sete a mais do que Ele, dando
![]()
Na tem mais nove elétrons do que ele, mas oito deles estão no núcleo, correspondendo aos oito elétrons na camada externa de Ne. Uma vez que Na tem apenas mais 1 elétron do que Ne, seu diagrama de Lewis é
![]()
Notice from the preceding example that the Lewis diagrams of the alkali metals are identical except for their chemical symbols. Isto concorda muito bem com o comportamento químico muito semelhante dos metais alcalinos. Similarly, Lewis diagrams for all elements in other groups, such as the alkaline landhs or halogens, look the same.
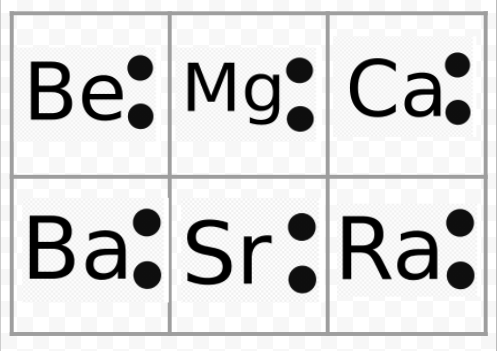
os diagramas de Lewis também podem ser usados para prever as valências dos elementos. Lewis sugeriu que o número de valências de um átomo era igual ao número de elétrons em sua concha de Valência ou ao número de elétrons que teriam que ser adicionados à concha de Valência para alcançar a estrutura de concha eletrônica do próximo gás nobre. Como um exemplo desta ideia, considere os elementos serem E O. seus diagramas de Lewis e aqueles dos gases nobres que ele e Ne são

comparando Be Com He, vemos que o primeiro tem mais dois elétrons e, portanto, deve ter uma valência de 2. Pode—se esperar que o elemento O tenha uma valência de 6 ou uma valência de 2, uma vez que tem seis elétrons de Valência-dois a menos que o Ne. Usando regras de Valência desenvolvidas desta forma, Lewis foi capaz de explicar o aumento regular e a diminuição dos índices dos compostos na tabela encontrada na seção de Valência, e reproduzida aqui. Além disso, ele foi capaz de explicar mais de 50 por cento das fórmulas na tabela. (Aqueles que concordam com suas idéias são sombreados em cor na mesa. Você pode querer se referir a essa tabela agora e verificar que algumas das fórmulas indicadas seguem as regras de Lewis. O sucesso de Lewis nesta conexão deu uma clara indicação de que os elétrons eram o fator mais importante para manter os átomos juntos quando as moléculas se formavam.apesar destes sucessos, existem também dificuldades nas teorias de Lewis, em particular para os elementos além do cálcio na tabela periódica. O elemento Br (Z = 35), por exemplo, tem mais 17 elétrons do que o gás nobre Ar (Z = 18). Isto nos leva a concluir que Br tem 17 elétrons de Valência, o que torna estranho explicar por que Br se assemelha tanto a Cl E F, Mesmo que estes dois átomos tenham apenas sete elétrons de Valência.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff e Adam Hahn.