Chemistry for Non-Majors
How does this worker’s energy change as he climbs up and down the ladder?subir uma escada requer energia. A cada passo, você está se empurrando contra a gravidade, e acumulando energia potencial. Voltar a descer liberta essa energia potencial à medida que desces passo a passo. Se você não tiver cuidado, você pode liberar essa energia potencial de uma só vez quando você cair da escada (nunca uma boa idéia). Além disso, você sobe ou desce em degraus. Não existe uma posição “in-between” na escada – seu pé ou bate um degrau ou atinge o espaço vazio e você está em apuros até que você encontrar um degrau para ficar.


Após as descobertas de hidrogênio espectros de emissão e o efeito fotoelétrico, o físico dinamarquês Niels Bohr (1885-1962), propôs um novo modelo de átomo, em 1915. Bohr propôs que os elétrons não irradiam energia à medida que orbitam o núcleo, mas existem em estados de energia constante que ele chamou de estados estacionários. Isto significa que os elétrons orbitam a distâncias fixas do núcleo (ver Figura abaixo). Bohr’s work was primarily based on the emission spectra of hydrogen. Isto também é referido como o modelo planetário do átomo. Explicou o funcionamento interno do átomo de hidrogénio. Foi agraciado com o Nobel de física de 1922.
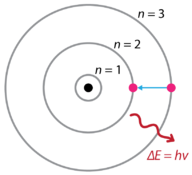
Figure 1. Bohr’s atomic model hydrogen emission spectra.
Bohr explicou que os elétrons podem ser movidos para diferentes órbitas com a adição de energia. Quando a energia é removida, os elétrons retornam ao seu estado de terra, emitindo uma quantidade correspondente de energia – um quântico de luz, ou fóton. Esta foi a base para o que mais tarde ficou conhecido como teoria quântica . Esta é uma teoria baseada no princípio de que matéria e energia têm as propriedades de partículas e ondas. É responsável por uma ampla gama de fenômenos físicos, incluindo a existência de pacotes discretos de energia e matéria, o princípio da incerteza e o princípio da exclusão.
de acordo com o modelo de Bohr, muitas vezes referido como um modelo planetário, os elétrons cercam o núcleo do átomo em caminhos específicos permitidos chamados órbitas. Quando o elétron está em uma dessas órbitas, sua energia é fixa. O estado do solo do átomo de hidrogênio, onde sua energia é mais baixa, é quando o elétron está na órbita mais próxima ao núcleo. As órbitas que estão mais longe do núcleo são todas de energia sucessivamente maior. O elétron não pode ocupar nenhum dos espaços entre as órbitas. Uma analogia diária ao modelo de Bohr são os degraus de uma escada. À medida que você sobe ou desce uma escada, você só pode ocupar degraus específicos e não pode estar nos espaços entre degraus. Subir a escada aumenta a sua energia potencial, enquanto descer a escada diminui a sua energia.o trabalho de Bohr teve uma forte influência na nossa compreensão moderna do funcionamento interno do átomo. Entretanto, seu modelo trabalhou bem para uma explicação para as emissões do átomo de hidrogênio, mas foi seriamente limitado quando aplicado a outros átomos. Pouco depois de Bohr publicar seu modelo planetário do átomo, várias novas descobertas foram feitas, o que resultou em, mais uma vez, uma visão revisada do átomo.
resumo
- o modelo de Bohr postula que os elétrons orbitam o núcleo em níveis de energia fixos.
- órbitas mais distantes do núcleo existem em níveis de energia mais elevados.quando os elétrons retornam a um nível de energia mais baixo, eles emitem energia na forma de luz.
prática
Use a ligação abaixo para responder às seguintes perguntas:
- Como é que uma órbita de alteração de electrões?em que se baseava o modelo de Bohr?o que Bohr acreditava sobre as órbitas?o modelo de Bohr funciona para todos os átomos?quando Bohr propôs o seu modelo de átomo?o que é um estado estacionário?qual é o estado de base?o elétron pode ocupar qualquer espaço entre as órbitas?
glossário
- modelo planetário: uma forma de descrever o modelo atómico de Bohr.teoria quântica: matéria e energia têm as propriedades de partículas e ondas.estado estacionário: os electrões orbitam a uma distância fixa do núcleo.