dê uma olhada nos artigos recentes
Abstrato
insuficiência cardíaca de baixa potência (LoHF) é uma forma incomum de insuficiência cardíaca (HF), mas que sinaliza HF muito avançada. Está associado ao prognóstico sinistro, bem como à morbilidade e mortalidade substanciais. No entanto, LoHF continua em grande parte sub-pesquisado. A descrição tradicional do FH centrou-se na insuficiência cardíaca congestiva (ICC), marcada por baixa potência Cardíaca e acompanhada por congestão pulmonar/periférica. Este foco contribuiu para a sub-apreciação dos pacientes do LoHF que têm pouca ou nenhuma evidência de congestão. Além disso, os doentes com LoHF não têm terapêutica comprovada e a selecção do tratamento apropriado depende da fisiopatologia individual e da etiologia subjacente. Os pacientes do LoHF têm etiologia heterogênea e fisiopatologia destacando a importância da compreensão profunda de suas características clínicas, diagnóstico e gestão clínica, que constitui a base da presente revisão.
palavras-chave
síndrome cardíaca de baixa potência, insuficiência cardíaca de baixa potência, estado de baixa potência
introdução
apesar dos notáveis avanços nas terapias médicas e cirúrgicas, a gestão eficaz da insuficiência cardíaca (HF) continua a colocar desafios significativos aos prestadores de cuidados de saúde. O desafio é refletido por altas taxas de readmissões hospitalares relacionadas com HF, juntamente com o aumento da mortalidade e morbilidade . Parte do desafio é a etiologia muito heterogênea, a fisiopatologia e apresentações clínicas de diferentes formas de HF, nas quais algumas formas de HF têm uma escassez de dados de ensaios clínicos e, consequentemente, uma compreensão limitada. Em particular, a descrição tradicional de HF tem sido quase sinônimo de insuficiência cardíaca congestiva (CHF), mas o termo CHF exclui uma minoria de pacientes com HF que têm poucos ou nenhuns sintomas demonstráveis de congestão pulmonar e/ou periférica . HF de baixa produção (LoHF) também tem sido ligado a um prognóstico ominoso e sinais muito avançados HF. Além disso, as diferenças sintomáticas e fisiopatológicas na ICC e no LoHF suportam a necessidade de diferentes abordagens de gestão clínica . Apesar destas diferenças, as terapias tradicionais de HF têm sido generalizadas a todas as formas de HF, incluindo CHF e LoHF, criando uma necessidade clínica para entender a fisiopatologia, diagnóstico e gestão clínica do LoHF. Neste artigo, agregamos evidências publicadas sobre LoHF em termos de epidemiologia, etiologia, fisiopatologia, diagnóstico e gestão clínica. A intenção é renovar o conhecimento do estado clínico do LoHF, bem como melhorar a gestão clínica do HF em geral.
definição
insuficiência cardíaca é uma síndrome clínica complexa marcada por defeitos do miocárdio estruturais e / ou funcionais que conduzem a uma diminuição do enchimento ou ejecção ventriculares . A complexidade da síndrome é evidente nas suas classificações heterogéneas: direita, esquerda ou bi-ventricular com base na localização de defeitos; aguda ou crónica com base no momento do início; fracção de ejecção preservada, limítrofe ou reduzida com base no estado funcional; baixa ou alta potência com base no débito cardíaco (CO), e falha para a frente ou para trás com base na direção do fluxo sanguíneo. Cada uma destas classificações é significativa para o diagnóstico e tratamento de HF . Apesar das várias classificações, o termo CHF tem sido tradicionalmente usado intercambiavelmente com HF, mas que não descreve suficientemente LoHF por causa de várias diferenças sintomáticas e fisiopatológicas.
LoHF, também conhecido como co baixo em HF descompensado agudo, descreve uma forma de HF de alta acuidade caracterizada por co dianteiro diminuído (índice cardíaco < 2.0 L / min / m2 e pressão arterial sistólica < 90 mmHg) e hipoperfusão de órgãos finais com pouca ou nenhuma evidência de congestão pulmonar . O LoHF é distinto da CHF, que descreve a HF caracterizada por uma redução da CO causando congestão pulmonar e periférica, conduzindo a dispneia e edema periférico, respectivamente . As diretrizes da Sociedade Europeia de Cardiologia (ESC) de 2005 sobre o diagnóstico e gestão de HF sugerem um continuum da síndrome de baixa potência cardíaca (LCOS) ao LoHF para choque cardiogénico. As diretrizes da ESC definir choque cardiogênico como prova de perfusão tecidual induzida por HF após a correção da pré-carga caracterizada por sistólica BP < 90 mmHg ou queda de pressão arterial média > 30 mmHg; diurese < 0,5 ml/kg/h; a taxa de pulso > 60 batimentos por minuto (bpm), com ou sem evidências de congestão . Por outro lado, os LCOS são comuns em doentes pós-operatórios com HF e definidos como a necessidade de bomba intra-aórtica pós-operatória ou de suporte inotrópico durante mais de 30 minutos num ambiente de cuidados agudos .
Epidemiologia
a prevalência exacta e a incidência de LoHF na população em geral é completamente desconhecida. Actualmente, não existem dados epidemiológicos baseados na população específicos do LoHF. Os únicos dados disponíveis são de ensaios clínicos num único centro que investigam uma população seleccionada de doentes com HF que foram submetidos a cirurgia cardíaca. Em 1975, Parr et al. fez a descrição seminal da entidade clínica da OCL e relatou uma incidência de 25% em crianças que tinham sido submetidas a cirurgia cardíaca com base na CO diminuída definida como IC < 2, 0 L/min/m2. Duas décadas depois, Wernovsky et al. demonstrou a mesma incidência de ABC pós-operatória em doentes que tinham sido submetidos a comutação arterial e que ocorreram entre 6-18 horas após a cirurgia. Muitos ensaios clínicos recentes relatam uma grande variação na prevalência, de 3,6% (homens) e 5,9% (mulheres) para 9,1% e para 41% e uma incidência de 14,7% . A longo prazo (vinte anos): 1990-2009) ensaio clínico prospectivo envolvendo 25. 176 doentes cirúrgicos com enxerto by-pass consecutivo a artérias coronárias (CABG), Algarni et al. a prevalência de OCL pós-operatórios diminuiu significativamente de 9,1% (1990-1994) para 2,4% (2005-2009) .
etiologia
a etiologia do LoHF é multi-factorial. Geralmente, é uma consequência da disfunção do ventrículo esquerdo (LV), ventrículo direito (RV) ou ventrículo sistêmico (anatomia do ventrículo único) e pode incluir tanto ou sistólica e/ou disfunção diastólica . Perturbações no enchimento ventricular ou ejecção levam a LoHF, o que é uma complicação frequente em doentes que foram submetidos a cirurgia cardíaca ou que estão em choque cardiogénico . Pode apresentar-se como deterioração aguda em doentes com HF crónica ou como episódio transitório e reversível com resolução do gatilho agudo. É uma síndrome clínica considerada a via final de uma multiplicidade de doenças que afectam a função cardíaca. Não é suficiente fazer o diagnóstico de LoHF, a causa subjacente ou gatilho também deve ser determinado, e se possível, tratado . O quadro 1 apresenta um resumo das condições que causam um estado de baixa potência nos doentes com HF.Tabela 1. A etiologia da baixa-saída do estado fisiopatologia
|
Mecanismos |
Causador Condições |
|
a Perda da contratilidade miocárdica |
a doença arterial Coronariana, miocardiopatia, miocardite, IC crônica descompensada, pós-operatório de cirurgia cardíaca, toxinas, nutrição (obesidade)m infiltrativos doenças, fase final de insuficiência renal, doença de Chagas, HIV ou infecção |
|
Deficiência de enchimento ventricular ou ejectar |
Pericardite, derrame pericárdico, tamponamento cardíaco, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
a compreensão actual da fisiopatologia do LoHF baseia-se, em grande parte, na evidência dos ensaios clínicos em doentes com CABG pós-operatórios . A marca de identificação patológica está excessivamente deprimida CO acompanhada por hipoperfusão de órgão final. Fisiologicamente, o coração funciona como uma bomba para distribuir sangue oxigenado em quantidades suficientes para satisfazer as necessidades metabólicas dos tecidos. Uma vez que as necessidades metabólicas variam em situações normais e estressantes, CO também varia para satisfazer esta demanda dinâmica . A fase diastólica do ciclo cardíaco é crítica nos doentes com LoHF porque é durante o relaxamento ventricular que o enchimento coronário ocorre para proporcionar oxigenação do miocárdio . A frequência cardíaca (HR) é também significativa no diastol porque a HR demasiado rápida impede o coração de alcançar relaxamento e perfusão do miocárdio completos. Assim, a disfunção cardíaca resulta de uma perturbação cardíaca estrutural (anomalia cardíaca residual) ou funcional (perturbações no enchimento ou esvaziamento ventricular, ou aumento da resistência vascular sistémica ).
Patofisiologicamente, CO é dependente da HR e do volume do curso (SV) (CO = HR * SV). Volume de curso por sua vez é o produto líquido de três variáveis de circulação inter-relacionadas: preload, afterload e contractilidade. Se um ou mais destes componentes for afectado, pode desenvolver-se um estado de baixa potência cardíaca . Além disso, estes componentes afectam as fases sistólica e diastólica do ciclo cardíaco, causando disfunção sistólica LV/RV e/ou disfunção diastólica também conhecida como HF com fracção de ejecção preservada (Figura 1). Outras condições tais como doença cardíaca valvular, hipertensão pulmonar (PH), disfunção da válvula mecânica e insuficiência respiratória podem precipitar ou agravar o desenvolvimento de LoHF .
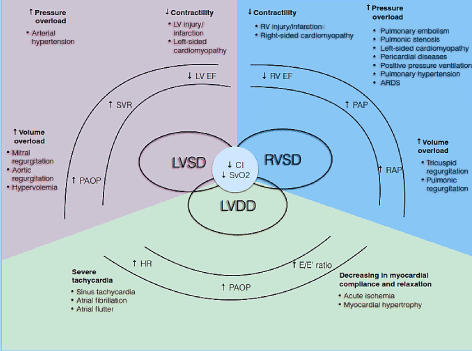
Figura 1. Mecanismos fisiopatológicos de insuficiência cardíaca de baixa potência
causas comuns e típicas; os sintomas de LoHF estão incluídos. O principal mecanismo fisiopatológico do LoHF é a disfunção ventricular.: Disfunção sistólica e/ou diastólica LV e disfunção sistólica RV, todas com características patológicas comuns de índice cardíaco reduzido (IC) e redução da saturação mista de oxigénio venoso (SvO2). A disfunção sistólica LV e RV resulta de sobrecarga de pressão aumentada, sobrecarga de volume aumentada e diminuição da contractilidade, enquanto a disfunção diastólica LV resulta de taquicardia grave e diminuição da conformidade e relaxamento do miocárdio. Adaptado de Lomivorotov et al. 7. 293
disfunção ystólica LV
disfunção sistólica ventricular esquerda (LV) (ou fracção de ejecção LV deprimida ) é o mecanismo fisiopatológico mais comum observado em doentes com LoHF. Variáveis de circulação que afetam a função sistólica LV são pré-carga, após carga e contractilidade . Geralmente, a disfunção sistólica da LV é uma consequência da perda ou redução dos cardiomiócitos funcionais resultantes da necrose devida a diminuição da circulação coronária e isquemia, lesão por reperfusão ou o fenómeno natural menos conhecido da apoptose cardiomiocitária . A perda de cardiomiócitos funcionais pode ser transitória, como observado durante o atordoamento do miocárdio, definido como um miocárdio viável salvo por reperfusão coronária, que apresenta disfunção pós-isquémica prolongada após a reperfusão . A perda funcional cardiomyocyte também pode ser refratária à reversão em condições tais como a infecção; taquicardia; doença valvular; distúrbios metabólicos como acidose, hipoglicemia, hipocalcemia; exposição ambiental cardíaca toxinas e produtos químicos; cardiomiopatia dilatada idiopática (DCM); e doenças genéticas como DCM familiar, cardiomiopatia hipertrófica e distrofias musculares . A resposta cardíaca diminuída à pré-carga causa uma diminuição drástica no fornecimento de CO e oxigénio a outros órgãos-chave do corpo, pressão Auricular elevada, pressão capilar e edema pulmonar cardiogénico. Embora as alterações compensatórias no LV se adaptem a uma pressão arterial sistêmica relativamente alta, um aumento significativo na carga pós-carga pode induzir disfunção sistólica LV .
disfunção diastólica LV
apesar de pouco frequente, o LoHF pode desenvolver-se em doentes com disfunção diastólica LV com FEVE preservada. A condição resulta da incapacidade da Câmara ventricular para encher com volume adequado de sangue, apesar da pré-carga normal, que apresenta como disfunção diastólica . Condições subjacentes, tais como taquicardia grave, diminuição da conformidade do miocárdio ou relaxamento ventricular anormal, prejudicam o relaxamento e enchimento do LV durante a fase diastólica do ciclo cardíaco. No nível cardiomiocitário, estas condições estão associadas à remoção de cálcio da homeostase do citosol e do cálcio, à adequação do desapego cruzado e à perturbação funcional intrínseca do elemento citoesqueleto . O descolamento de ponte pode contribuir para o tempo de relaxamento isovolúmico atrasado, o que resulta em diminuição do volume de acidente vascular cerebral LV, especialmente em HR mais elevado . O relaxamento do LV também depende da recaptação reticular do ião cálcio sarcoplásmico e da sinalização do óxido nítrico, o que também facilita o descolamento transversal. Uma vez que o processo de desapego cruzado consome energia, pode causar um déficit de energia no miocárdio e, consequentemente, desacelerar o relaxamento do miocárdio LV .apesar da disfunção diastólica ser um fenómeno generalizado observado em até 70% dos doentes cardíacos pós-operatórios , a disfunção diastólica por si só é insuficiente para explicar o desenvolvimento de HF aguda. Na definição de outras condições clínicas, tais como fibrilação atrial (FA), comprometimento da circulação coronária, hipertensão arterial, disfunção diastólica pode resultar em descompensada estado, e, portanto, acredita-se ser um sinal precoce de isquemia miocárdica . A relação dinâmica entre as funções sistólica e diastólica LV também contribui para a disfunção diastólica em doentes com LoHF. A estimulação da catecolamina inotrópica afeta tanto o diastol como o sistol, e pode aumentar a disfunção diastólica. A FEVE deprimida conduz a um aumento do volume sistólico terminal e prolonga a fase diastólica do ciclo cardíaco .
disfunção RV
No LoHF, particularmente após cirurgia da artéria coronária, os principais mecanismos fisiopatológicos da disfunção RV incluem aumento da pré-carga, aumento da carga, insuficiência da perfusão da artéria coronária direita e diminuição da contractilidade . Em contraste com a artéria coronária esquerda, a perfusão da artéria coronária direita ocorre durante a diastole e sistole. A presença de PH causa um aumento na pressão RV levando à diminuição da perfusão da artéria coronária direita, o que explica a importância para proporcionar a circulação coronária esquerda e direita ideal . Em pacientes que foram submetidos a cirurgia da artéria coronária, disfunção RV pode desenvolver-se como resultado de uma combinação de mecanismos. Isquemia perioperativa RV e enfarte são as principais causas de diminuição da contractilidade RV. As causas comuns de aumento da pré-carga de volume enquanto doença valvular do lado esquerdo ou cardiomiopatia, embolia do PH ou pulmonar (EP), síndrome de dificuldade respiratória aguda e ventilação de pressão positiva elevada são causas comuns de sobrecarga de pressão . Uma vez que o RV normalmente permite a perfusão de baixa pressão da vasculatura pulmonar, é altamente sensível até mesmo a aumentos moderados na pressão arterial pulmonar (PAP). A falha RV pode desenvolver-se no ajuste do PH ou da contractilidade diminuída associada a uma progressão rápida da dilatação RV levando ao aumento da pressão RV end-diastólica . Estas alterações fisiológicas podem causar uma deslocação inter-ventricular do septo para uma câmara LV já sub-cheia e, consequentemente, causar uma redução na pré-carga LV e uma diminuição na CO .factores de risco
factores de risco
factores de risco para o LoHF continua a ser uma área sub-investigada. No entanto, poucos dados disponíveis de ensaios clínicos sobre HF e de doentes com OCL pós-operatórios fornecem informações valiosas sobre factores de risco e indicadores de LoHF. Na análise de 452 pacientes hospitalizados com IC descompensada e baixo débito cardíaco, importantes fatores de risco para LoHF foram a doença de Chagas (risco Relativo : 3.66), deprimido (a fração de ejeção (RR: 2.41), hiponatremia (RR: 1.62) e disfunção renal (RR: 1.92) . Os factores de risco para o LoHF pós-operatório incluem compromisso da função LV (< 50%), cirurgia de bypass de emergência ou cardiopulmonar (CPB), revascularização incompleta, idade > 65 anos, e uma presença combinada de diabetes mellitus e disfunção renal pré-operatória . Para além dos factores de risco do doente e da operação, os predicadores bioquímicos do LoHF em doentes pós-operatórios são baixos níveis de hemoglobina , contagem total de linfócitos < 2000 células/µL e níveis pré-operatórios de peptídeos natriuréticos séricos . Ao longo das últimas duas décadas, registaram-se alterações nas tendências de alguns factores de risco reconhecidos. Factores como a hipertensão, o sexo feminino, a doença dos vasos triplos e a doença principal esquerda já não são estatisticamente significativos, enquanto o risco associado à depressão da fracção de ejecção pré-operatória duplicou .diagnóstico
diagnóstico
não existem directrizes consensuais ou critérios de diagnóstico comprovados para doentes com LoHF. Além disso, os sinais e sintomas clínicos não são específicos. Na ausência de diretrizes padronizadas, o diagnóstico geralmente se baseia em uma coleção Aceita de aberrações hemodinâmicas e fisiológicas úteis para levantar suspeitas clínicas de LoHF . O diagnóstico de LoHF por si só muitas vezes não é suficiente. A causa do Estado de baixa produção também tem de ser estabelecida. Em algumas causas de Estado de baixa produção, como PE ou MI, tratar a causa subjacente é a consideração mais importante e, portanto, é imperativo fazer o diagnóstico. Uma vez que os doentes com LoHF são frequentemente instáveis, é também comum que a avaliação clínica, o diagnóstico e o tratamento ocorram simultaneamente mais em situações de cuidados agudos .
Sinais e sintomas
Baixo débito cardíaco como a característica de apresentação de IC descompensada aguda é rara, afetando apenas de 8,9 9,6% dos hospitalizados com IC pacientes . LoHF pode compartilhar muitas características clínicas com CHF, mas há diferenças notáveis que podem apoiar ou orientar decisões diagnósticas subsequentes. Fadiga excessiva e aumento da intolerância ao exercício são sinais iniciais importantes observados pelos doentes com LoHF mesmo antes do diagnóstico . Além disso, LoHF pacientes comumente apresentam com agitação, confusão e/ou a diminuição do nível de consciência; frio/vasoconstricted periferias ou atraso de tempo de reposição capilar; hipotensão; taquicardia ou bradicardia; thready pulso; levantou pressão jugular; falta de ar e hypoxaemia; e oligúria/anúria . Estes sinais e sintomas podem diferir entre perfusão baixa e congestão nos doentes com HF (Tabela 2).
Tabela 2. Sintomas e sinais de perfusão baixa vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: As Diretrizes ESC 2016 sobre diagnóstico e gestão de HF enfatizam a importância da obtenção de histórico detalhado do paciente e exame físico em todos os pacientes suspeitos de ter HF . História detalhada do paciente, ou parente e amigos se o paciente estiver muito mal, deve se concentrar na obtenção de informações sobre sintomas, condições cardíacas e extra-cardíacas anteriores e atuais capazes de precipitar ou agravar HF, exposição a fatores de risco de HF ou de Estado de baixa saída, e histórico de medicação para condições médicas anteriores e atuais . Para além da história do doente, recomenda-se o exame físico a todos os doentes com LoHF para avaliação de indicadores clínicos para hemodinâmica, perfusão periférica, congestão, etiologia subjacente e patologia valvular. Os parâmetros hemodinâmicos de interesse incluem pressão arterial, ritmo cardíaco e HR, ritmo de galope, saturação de oxigênio e frequência respiratória . Os testes para perfusão periférica devem incluir Níveis de consciência, temperatura periférica da pele/central, tempo de recarga capilar e saída de urina. Os testes de congestão incluem pressão venosa jugular elevada, edema periférico/pulmonar, hepatomegalia, ascite e efusões pleurais. Os testes para a etiologia subjacente devem incorporar exame cardiovascular, som cardíaco e murmúrios. Por último, a evidência de disfunção valvular deve incluir rub pericárdico e evidência de efusão pericárdica com ou sem tamponamento cardíaco .
A combinação da história do doente e do exame físico revelou-se inestimável na avaliação do estado hemodinâmico e no reconhecimento do LoHF . Em 1976, Forrester et al. realizou-se um exame físico em doentes com enfarte agudo do miocárdio e identificou quatro perfis hemodinâmicos (A, B, L E C), conforme ilustrado na Figura 2. Os perfis hemodinâmicos baseiam-se na presença ou ausência de congestão pulmonar (pressão da Cunha capilar pulmonar> ou ≤ 18 mmHg) e na adequação da perfusão (CI > 2,2 L/min/m2). O perfil a não representa congestionamento/hipoperfusão; o perfil B congestão sem hipoperfusão; o perfil C hipoperfusão sem congestionamento; e o perfil L congestão e hipoperfusão . Os doentes com LoHF estão abrangidos pelos perfis L E C (hipoperfusão ± congestionamento com base no Nohria et al. demonstração de que os perfis L E C têm um IC médio de 1, 6 L/min/m2 e 1, 9 L/min/m2, respectivamente.
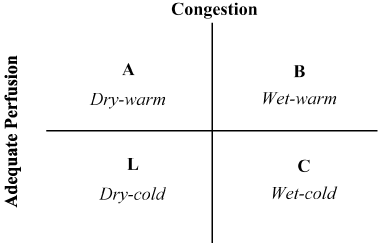
Figura 2. Apresentação esquemática do perfil clínico de insuficiência cardíaca aguda descompensada
a congestão é avaliada pela presença de ortopneia, distensão venosa jugular, rales pulmonares, refluxo hepatojúgular, ascite, edema periférico, refluxo abdominal e onda quadrada de Valsalva. A perfusão baixa foi avaliada pela presença de uma pressão de pulso estreita, alterações pulsares, extremidades frias, talvez sonolentos, níveis séricos de sódio decrescentes e agravamento da função renal. Adaptado de nohria, et al.
electrocardiograma (ECG): tanto AHA como o ESC recomendam que o electrocardiograma (ECG) seja realizado o mais cedo possível em todos os doentes suspeitos de HF. O ECG pode demonstrar uma variedade de anomalias e é muito improvável que seja normal em doentes com HF. Pode também evidenciar uma etiologia subjacente da disfunção cardíaca incluindo bradicardia, bloqueio auriculoventricular, taquicardia sinusal, taquiarritmia auricular ou ventricular, isquémia, hipertrofia LV e complexos de baixa tensão .testes laboratoriais Básicos: as normas orientadoras AHA e ESC HF também recomendam testes laboratoriais básicos na avaliação clínica inicial para apoiar o diagnóstico de HF ou da causa do Estado de baixa produção. Devem ser realizadas análises ao sangue em todos os doentes suspeitos de HF. Hemoglobina (Hb> 10 g/dL) indica o fornecimento óptimo de oxigénio aos tecidos), a anemia crónica é comum em HF crónica e os glóbulos brancos acentuadamente aumentados levantam a suspeita de diagnóstico alternativo. Testes de electrólito sérico para determinar os níveis de potássio, magnésio e cálcio. Testes de ureia e creatinina para avaliar a hipoperfusão renal e disfunção frequentes em HF. Testes para diminuição da função hepática, o que sugere insuficiência RV e/ou congestão hepática. Teste de Glucose para avaliar a hipoglicemia que pode afectar a função cardíaca. Testes da função tiroideia para hipo ou hiper – tiroidismo que pode causar enfarte intrínseco do miocárdio. Finalmente, testes para peptídeos natriuréticos séricos cujos níveis elevados indicam um aumento da tensão na parede ventricular, mas que não detecta alterações abruptas na pressão de enchimento ventricular devido à sua longa semi-vida .testes de imagem cardíaca: a imagem cardíaca desempenha um papel central no diagnóstico de HF, bem como na monitorização e orientação da terapêutica. A ecocardiografia é a modalidade preferida por razões de precisão, disponibilidade, segurança e relação custo-eficácia . Pode ser complementada por outras modalidades de imagiologia selecionadas com base na capacidade de responder a questões clínicas específicas, considerando as contra-indicações e os riscos .Ecocardiografia: a ecocardiografia é fortemente recomendada para todos os doentes suspeitos devido à sua capacidade de confirmar ou excluir o diagnóstico clínico do LoHF, avaliar a SV e as suas variações e determinar a causa do Estado de baixa potência . A ecocardiografia transhorácica deve ser realizada o mais rapidamente possível após o diagnóstico clínico de débito cardíaco baixo. Não só mede a extensão da disfunção sistólica e diastólica, como também fornece informações valiosas sobre morfologia ventricular, disfunção valvular, doença do miocárdio e pericárdica e anomalias regionais do movimento da parede . A ecocardiografia avalia a função sistólica medindo LEVF, onde> 45-50% é considerado normal. Por outro lado, a função diastólica é avaliada usando mitral em padrões de fluxo, fluxo da veia pulmonar e Doppler de tecido no anel mitral, enquanto CO e SV são avaliados usando o princípio Doppler. A pressão arterial pulmonar (PAP) pode ser estimada medindo a velocidade do jacto regurgitar. Alta PAP na presença de RV dilatado com achatamento septal ou curvando-se para o LV indicando aumento agudo da pressão RV aumentando a suspeita clínica de PE como a causa de baixo estado de saída .raio-X torácico: o raio-X torácico pode ser considerado em doentes suspeitos de LoHF. Indicadores importantes que devem ser considerados para avaliação incluem aumento do coração indicando cardiomegalia ou hipertrofia LV; congestão venosa pulmonar Indicando Pressão de enchimento LV elevada; e derrame pleural Indicando Pressão LV elevada, embolia pulmonar ou cirurgia pós-cardíaca( .angiografia coronária: as indicações para angiografia coronária nos doentes com LoHF devem estar de acordo com a recomendação de directrizes de consenso relevantes para HF . Em doentes com HF que apresentem dor torácica e evidência de enfarte do miocárdio com elevação do ST (STEMI) com ECG, deve efectuar-se a revascularização utilizando intervenção coronária percutânea primária o mais rapidamente possível. Angiografia coronária também deve ser considerada em doentes com paragem pós-cardíaca de etiologia isquémica, quando há evidência de HF e em doentes que recuperaram do Estado de baixa potência quando a causa não foi determinada .
Gestão Clínica
a presença de LoHF representa uma condição de risco muito elevado que requer tratamento imediato, mas carece de orientações padronizadas para a gestão clínica . Consequentemente, os médicos normalmente consideram a fisiopatologia individual como a estratégia de tratamento mais adequada . Em pacientes agudos com LoHF, as Diretrizes ESC HF de 2016 recomendam o uso de perfis hemodinâmicos (com base na presença ou ausência de congestão e adequação da perfusão) para orientar a gestão clínica . Para os doentes com LoHF no perfil L (sem congestão, mas hipoperfusionados) e no perfil C (ambos com congestão e hipoperfusionados) que estão em estado de descompensação aguda, os objetivos do tratamento de emergência podem incluir ressuscitação de doentes, restauração da oxigenação, melhoria da perfusão de órgãos e otimização hemodinâmica (volume de acidente vascular cerebral e CO), e resolução de sintomas. Outros objetivos subsequentes incluem a monitorização óptima e o estabelecimento da causa subjacente de baixa potência Cardíaca e o tratamento da causa se reversível . Actualmente, os objectivos terapêuticos disponíveis para o LoHF são a optimização da oxigenação dos tecidos, a estabilização da circulação e o tratamento de causas reversíveis de Estado de baixa produção (Figura 3).
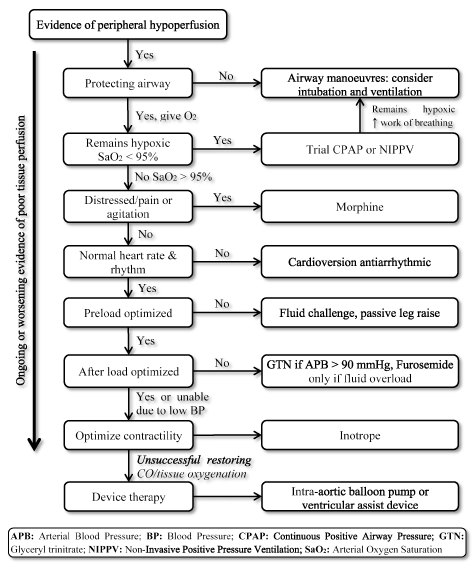
Figura 3. Treatment algorithm for low-output heart failure
Treatment of LoHF targets improving tissue oxigenation and stabilizing circulation based on ongoing or working symptom of tissue perfusion. O tratamento começa por melhorar a ventilação utilizando oxigénio de alto fluxo, pressão contínua positiva das vias aéreas (CPAP) ou ventilação de pressão positiva não invasiva (NIPPV). Se forem administrados medicamentos sem sucesso, cardioversão ou antiarrítmicos para normalizar a frequência cardíaca, desafio fluido para otimizar a pré-carga e/ou vasodilatadores e inotrópicos para manipular e melhorar a contractilidade, respectivamente. Se anterior, a ventilação e a medicação não for bem sucedido em restaurar o débito cardíaco e/ou oxigenação do tecido, dispositivo de terapia utilização de balão intra-aórtico bomba ou os dispositivos de assistência ventricular pode ser considerada
Otimizar a oxigenação do tecido (ventilatório estratégias)
a gestão Clínica da LoHF pacientes, muitas vezes, começa com a avaliação das vias aéreas, a respiração e a circulação de evidências de hipoperfusão periférica. Estratégias de ventilação, tais como as vias aéreas orofaríngeas ou nasofaríngeas, são adjuntos comuns usados para restaurar ou manter a patência das vias aéreas em doentes com LoHF com níveis de consciência diminuídos devido à diminuição da perfusão cerebral. Deve considerar-se a intubação endotraqueal adicional se o doente ficar com as vias respiratórias comprometidas . Se os doentes continuarem a ser hipóxicos (SaO2 < 95%), pode considerar-se a maximização do fornecimento de oxigénio utilizando oxigénio de alto fluxo, pressão contínua positiva das vias respiratórias (CPAP) ou ventilação de pressão positiva não invasiva (NIPPV). Em doentes sem melhoria, pode considerar-se intubação ou ventilação .
estabilizar a circulação
saída cardíaca (CO) é uma função da HR e SV. Por sua vez, SV depende de quatro variáveis de circulação – frequência cardíaca, pré-carga, contractilidade e pós-carga. Otimizar todas estas variáveis melhorará o CO em pacientes LoHF . No contexto clínico, estratégias para aumentar CO dependem da causa subjacente e da variável de circulação afetada . As intervenções clínicas incluem ajuste de volume, suporte farmacológico e terapia com o dispositivo.
frequência cardíaca / ritmo cardíaco: Como parte da resposta fisiológica do organismo, o aumento da HR aumenta a CO. A HR demasiado rápida ou lenta tem um efeito prejudicial sobre o CO. Em LoHF pacientes com taquicardia (muito rápido FC de repouso > 100 bpm), que são angustiado, inquieto e dispneia, a morfina pode ser administrado para aliviar a dispneia, dor e agitação, bem como é um leve venodilator para reduzir a pós-carga, especialmente em CPAP ou NIPPV pacientes . Se HR < 40 bpm com evidência de compromisso hemodinâmico e/ou CO diminuída, devem ser realizados medicamentos que aumentem a HR (atropina e anticolinérgicos ) ou intervenções tais como ritmo transcutâneo/transvenoso. Deve ser considerada cardioversão Eléctrica urgente em LoHF seleccionado com taquicardia ventricular / supraventricular ou AF rápida com evidência de compromisso cardiovascular .
Optimize a pré-carga( ajustes de Volume): A Medição da pré-carga é essencial para a sua optimização. Recomenda-se em doentes com evidência clínica de insuficiência da perfusão periférica. Um desafio de fluido deve ser realizado para avaliar a capacidade de resposta pré-carga. Administrar rapidamente 250 ml de líquido (cristalóide ou colóide) durante mais de cinco minutos e avaliar objectivamente o efeito na SV. Se o efeito for um aumento ou diminuição > 10%, o doente deve continuar a receber bolus de fluidos para optimizar a pré-carga até deixar de responder aos fluidos . Para os doentes com sinais de congestão e edema pulmonar que não necessitam de bólus fluido, pode ser feito um aumento passivo da perna – elevando a perna do doente para 45 graus para excluir a necessidade de provocação de fluidos. Se a resposta for favorável, pode ser dado um desafio com fluído real .
manipular pós-carga (suporte farmacológico): a pós-carga é a resistência contra a qual o ventrículo está a ejectar sangue, por vezes estimada como RVM. A carga pós-carga deve ser reduzida em doentes com LoHF que apresentem uma carga pós-carga elevada, CO baixa, evidência de má perfusão periférica e edema pulmonar. Deve ser dado apoio farmacológico utilizando vasodilatadores a doentes com LoHF com pressão arterial sistólica ≥110 mmHg. Em pacientes com pressão sistólica BP < 90 mmHG e pressão arterial média < 65 mmHg, vasodilatadores não são recomendados, devido ao risco de hipotensão, que pode complicar a perfusão de órgãos. Nestes doentes, recomenda-se a utilização de inotrópicos como primeira linha de tratamento .melhorar a contractilidade (suporte farmacológico): Se o doente persistir com evidência de hipoperfusão tecidular ou fornecimento reduzido de oxigénio apesar das intervenções para a frequência cardíaca, pré-carga e pós-carga, deve considerar-se o tratamento para melhorar a contractilidade. Entretanto, a otimização do fornecimento de oxigénio deve continuar a apontar para a hemoglobina ≥10 g/dl e assegurar uma saturação óptima de oxigénio (SaO2). Os factores que afectam adversamente a contractilidade do miocárdio são a hipercaliemia, hipomagnesemia, hipocalcemia, acidose grave, hipoxia e hipoglicemia, que devem ser corrigidos. Recomenda-se a utilização de inotrópicos para melhorar a contractilidade e, subsequentemente, CO em doentes com baixa TA e/ou baixa IC na presença de sinais de perfusão periférica ou congestionamento . Contudo, o suporte farmacológico que utiliza Dobutamina (um inotrópico) deve ser utilizado com precaução em doentes com taquicardia ou AF porque aumenta a condução dos nódulos AV e pode precipitar ritmos ventriculares rápidos . Por outro lado, o levosimendano é recomendado em doentes com isquémia do miocárdio aguda ou pós-cirurgia cardíaca com LoHF, uma vez que não aumenta a procura de oxigénio do miocárdio . O efeito a longo prazo dos inotrópicos pode ser prejudicial, pelo que a sua utilização deve ser interrompida logo que a estabilidade seja alcançada. Os vasopressores não devem ser a medicação de primeira linha em estados de baixa produção, uma vez que aumentam a RVM e, subsequentemente, prejudicam a CO. No entanto, recomenda-se uma terapêutica dupla de vasopressores e inotrópicos em doentes com sépsis como causa subjacente de um estado de baixa produção .terapêutica com dispositivo: a terapêutica com dispositivo deve ser considerada em doentes com LoHF quando as terapêuticas médicas óptimas não foram bem sucedidas no restabelecimento da CO e oxigenação dos tecidos. As terapias de dispositivos comuns incluem bomba de balão intra-aórtica (IABP) e dispositivo de assistência ventricular (VAD). A utilização de IABP é frequente em doentes com doença cardíaca isquémica, intervenção pré ou pós-percutânea ou cirurgia pós-cardíaca. O IABP é composto por um balão inserido na aorta através da artéria femoral. O balão inflaciona durante o diastol e deflaciona durante a sistole para aumentar a BP diastólica e consequentemente a perfusão coronária, e reduz a afterload aumentando assim o CO . Por outro lado, o uso de VAD é incomum. Só pode ser utilizado em centros especializados. É comumente usado como uma ponte para o transplante cardíaco em pacientes com qualidade de vida favorável ou para a recuperação em pacientes com miocardite aguda .
tratamento de causas subjacentes
algumas causas de Estado de baixa produção em doentes com LoHF podem ser revertidas com terapêuticas específicas. As causas reversíveis devem ser identificadas precocemente durante a avaliação clínica inicial. Estas causas incluem enfarte agudo do miocárdio, tamponamento cardíaco, pneumotórax de tensão, embolia pulmonar e insuficiência da válvula aguda . (Quadro 3).
Meta-análise do diagnóstico e do tratamento clínico
a base do diagnóstico clínico de LoHF tem sido evidência ecocardiográfica de disfunção sistólica LV/RV e/ou disfunção diastólica LV acompanhada de evidência de CO e SvO2 reduzidos . Os perfis hemodinâmicos baseados em medidas de congestão e perfusão foram utilizados para classificar os doentes agudos com HF em quatro perfis: seco-quente (a), húmido-quente (b), seco-frio (L) e húmido-frio (C) e útil na identificação dos doentes com LoHF . Os doentes com LoHF foram classificados em perfis (L) E (C) com base na presença/ausência de congestionamento e/ou na inadequação da perfusão periférica . Estes dois perfis hemodinâmicos formaram a base para a seleção de pacientes com LoHF em ensaios clínicos, bem como fornecer cabeceira simples avaliação para ajudar a classificar os pacientes, no momento da apresentação e para guiar a seleção inicial de terapias . O objetivo da meta-análise atual é agregar evidências publicadas de características comuns de diagnóstico e resultados de tratamento para pacientes com LoHF.
estratégia de pesquisa
três principais bases de dados online (PubMed, EMBASE e Cochrane) foram sistematicamente pesquisadas desde o início até dezembro de 2018 para estudos que investigam o diagnóstico e a gestão clínica do LoHF. Para evitar ignorar estudos que não mencionaram LoHF no título ou abstrato, os primeiros 200 artigos classificados com relevância recuperados com um texto completo do Google Scholar search foram incluídos. Não foi aplicado nenhum tempo de publicação ou restrições linguísticas. Estudos adicionais foram identificados através de uma pesquisa manual da lista de referências dos estudos incluídos, bem como de artigos de revisão relevantes, que foram então submetidos aos critérios de inclusão. Os critérios de pesquisa incluíram população de interesse (pacientes com LoHF ou LCOS), testes de diagnóstico de interesse (ecocardiografia e perfis hemodinâmicos), e intervenção de interesse (estratégias do ventilador, ajuste de volume, suporte farmacológico e terapia do dispositivo). Os estudos foram incluídos se satisfizessem os seguintes critérios: a) incluíram doentes com LoHF; B) diagnosticados utilizando ecocardiografia e perfis hemodinâmicos; c) doentes tratados para estabilização hemodinâmica; e d) relataram resultados do tratamento. Em casos de estudos que reportaram dados duplicados, apenas foi incluído o estudo que forneceu o maior número de doentes. Foram excluídos resumos de conferências, relatórios de casos e artigos de revisão.a figura 4 ilustra o processo de pesquisa e triagem utilizado para incluir estudos elegíveis. Dois revisores de forma independente rastrearam todos os títulos e resumos recuperados a partir da pesquisa on-line sistemática. Resumos que incluíam população, intervenção e resultados de interesse foram incluídos para pesquisa de texto completo. Posteriormente, os dois revisores também revisaram de forma independente artigos de texto integral contra os critérios de inclusão. Em casos de discrepância, foi resolvido através de discussão e consenso.

Figura 4. Diagrama de fluxo do processo de pesquisa e inclusão da literatura
recolha de dados
dois revisores extraíram independentemente os dados dos estudos incluídos e qualquer discrepância Foi resolvida através do consenso. Os principais dados extraídos foram dados de perfil ecocardiográfico e hemodinâmico, e tratamento usado e resultado do tratamento em hemodinâmica (índice cardíaco, PCWP) e mortalidade. Além destes dados principais, os dois revisores também extraíram dados sobre as características do estudo, as características dos doentes e a duração de seguimento (Quadro 4).
análise estatística
os resultados de interesse notificados em mais de um estudo são índice cardíaco, PCWP e mortalidade. Para cada resultado, foram extraídas estatísticas sucintas (média ± desvio-padrão) antes e depois da intervenção ou a diferença entre a linha de base e após o tratamento. Estas estatísticas resumidas foram extraídas separadamente para os grupos de tratamento e controlo/placebo. Os resultados diagnósticos e os efeitos do tratamento foram medidos pela diferença nos meios antes e depois da intervenção e pelo intervalo de confiança de 95% associado. As parcelas florestais foram utilizadas para examinar visualmente a heterogeneidade (I2) entre os estudos. O efeito de diagnóstico e tratamento combinado e o intervalo de confiança associado a 95% foram estimados utilizando um efeito fixo (I2 < 49%) ou um modelo de efeito aleatório (I2 > 50%). O valor de P > 0,05 foi considerado estatístico significativo.os resultados das características do estudo
12 (12) ensaios controlados aleatorizados (RCTs) satisfizeram os critérios de inclusão. Sete (7) estudos incluíram doentes com LoHF e os restantes cinco (5) incluíram doentes com HF que foram submetidos a cirurgia cardíaca com débito cardíaco baixo. A maioria dos ensaios clínicos publicados (10) investigaram a medicação comparando o efeito de diferentes tipos de inotrópicos sobre a hemodinâmica e prevenção da morte: apenas dobutamina , dobutamina e dopamina ; levosimendano e dobutamina , levosimendano e placebo . Dos restantes dois ensaios clínicos, cada um investigou vasodilatador (nitroprussido) e placebo , e terapia com dispositivo (IABP) e inotrópico (levosimendano) isoladamente ou em combinação com IAPB . No total, os 12 ensaios clínicos incluíram 3.738 doentes, média de idade de 64 anos (intervalo = 55-74 anos), sendo a maioria do sexo masculino (78%).
síntese dos resultados
dados de diagnóstico sobre LoHF foi inconsistente. Nos doze ensaios clínicos, não surgiu uma definição comum de LoHF que fosse útil para orientar o diagnóstico. Hemodinâmica critérios utilizados para inclusão de pacientes em ensaios incluídos CI < 2,0 L/min/m2 , CI < 2,2 L/min/m2 ou CI < 2,5 L/min/m2 e PCWP > 15 mmHg ou ≥18 mmHg . A definição também variava de estudos – pós-operatório de condições com hipotensão (sistólica BP < 90 mm hg para > 30 minutos) ou a necessidade de suporte inotrópico para manter sistólica BP > 90 mm hg e de fim-de órgãos hipoperfusão (frio periferias, da produção de urina < 30 ml/hora) . O choque cardiogénico foi descrito como uma síndrome complexa que envolve uma cascata de disfunção LV aguda, diminuição da CO, hipotensão e hipoperfusão tecidular .as figuras 5 e 6 mostram parcelas florestais para a média padronizada do índice cardíaco no início e após a terapêutica inotrópica ou vasodilatadora, respectivamente. O índice cardíaco inicial aumentou de uma média de 1, 93 (95% IC: 1, 91-1, 95) para uma média de 2, 82 após o tratamento (95% IC: 2, 80-2, 84). A figura 7 mostra uma parcela florestal para a diferença média padrão (DME) do índice cardíaco após tratamento com levosimendano e dobutamina. O levosimendano atinge um índice cardíaco mais elevado em comparação com a dobutamina (DME: 2, 82; 95% IC: 2, 54-3, 10). Como um profilático contra a LoHF no pós-operatório de pacientes, a infusão de levosimendan após a anestesia alcançado um maior índice cardíaco (2.57) em relação ao pré-operatório IABP (2.3) ou com uma combinação de levosimendan (2.4). A figura 8 mostra uma parcela florestal da taxa de mortalidade entre o levosimendano e o placebo. Levosimendan tiveram menor taxa de mortalidade em comparação com o placebo (Odds Ratio : de 0,83; IC 95%: 0.59-1.18), mas a diferença não foi estatisticamente significativa (p=0,30). Final, a Figura 9 mostra ainda que o Levosimendano tem uma taxa de mortalidade mais baixa em comparação com a dobutamina (ou: 0, 65; 95% IC: 0, 39-1.08) but the difference was not statistically significant (p=0.10).
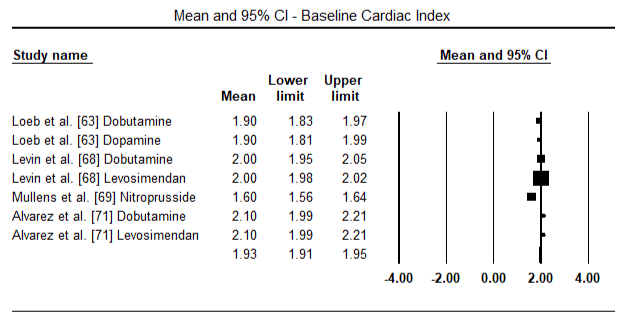
Figure 5. Mean baseline cardiac index
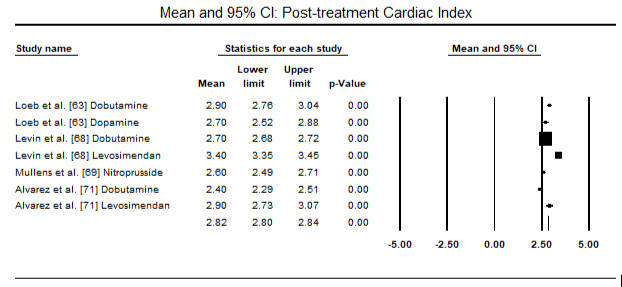
Figure 6. Mean post-treatment cardiac index
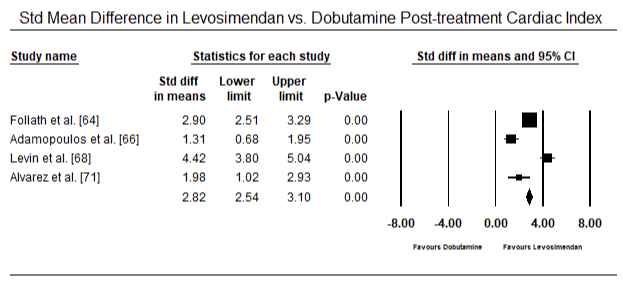
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
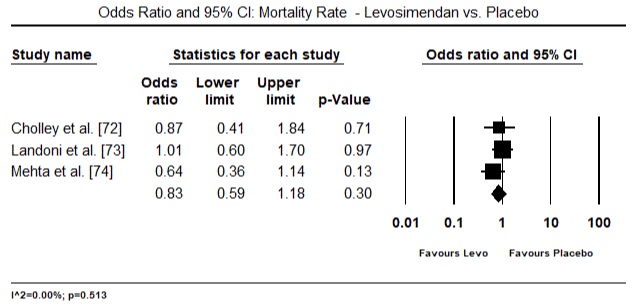
Figure 8. Mortality rate between levosimendan and placebo
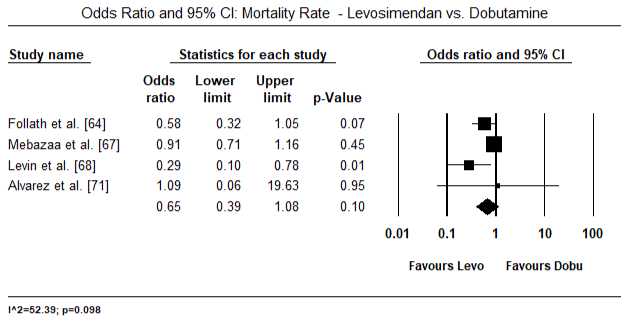
Figure 9. Taxa de mortalidade entre levosimendano e dobutamina
discussão dos resultados
Esta revisão sistemática e meta-análise avaliaram características comuns de diagnóstico e resultados de tratamento da terapêutica médica e com dispositivos (IABP) em doentes com LoHF. Os resultados indicam que os pacientes do LoHF não possuem características de diagnóstico amplamente aceitas ou padronizadas. Embora os doentes com LoHF possam apresentar várias características incluindo índice cardíaco, PCWP, BP sistólica e SvO2 para sugerir ou apoiar o diagnóstico clínico, todas estas características têm valores-limite diferentes entre os estudos. Índice cardíaco, que é a forma clínica mais comum o recurso, demonstrando a baixa-saída do estado na LoHF, tem três valores de cut-off: < 2,0 L/min/m2 , < 2,2 L/min/m2 ou < 2,5 L/min/m2 . O suporte inotrópico emergiu como uma intervenção muito comum para melhorar a perfusão e normalizar o débito cardíaco em pacientes com LoHF.medicamentos inotrópicos tais como levosimendano, dobutamina, dopamina, vasodilatador (nitroprussido) e IABP melhoraram significativamente o IC entre a linha de base e o pós-tratamento. Em termos de inotrópicos, o levosimendano é mais eficaz na melhoria da estabilidade hemodinâmica e numa melhor profilaxia contra a morte a curto prazo (mortalidade de 30 dias) do que a dobutamina. Além disso, os inotropos podem atuar como profilaxia contra o desenvolvimento do LoHF pós-operatório. Por outro lado, enquanto os inotrópicos melhoram a hemodinâmica e normalizam o débito cardíaco, eles não fornecem qualquer proteção significativamente melhor contra a mortalidade, independentemente do tipo de inotrópio utilizado.
o papel dos inotropos no tratamento do LoHF tem sido apoiado por uma revisão prévia de agentes inotrópicos e estratégias vasodilatadoras para o tratamento de choque cardiogénico e CSO . A revisão relatada melhora a hemodinâmica, os eventos adversos em OCP pós-operatório e a mortalidade reduzida. Inotropos mais recentes como o levosimendano (um sensibilizador de cálcio e inodilatador) é um inótropo positivo que tem algumas propriedades vasodilatadoras . Também pode ser considerado como um vasodilatador hepático selectivo, que pode melhorar o fluxo venoso portal através da artéria hepática e fluxo venoso portal em comparação com dobutamina que só pode melhorar o fluxo venoso portal sem vasodilatar a artéria hepática . O levosimendano também não aumenta a procura de oxigénio do miocárdio e recomenda-se a administração de dobutamina em doentes com isquémia do miocárdio aguda ou pós-cirurgia cardíaca . Para o LoHF pós-operatório, o efeito protector dos inotropos contra a taxa de mortalidade a curto prazo (mortalidade de 30 dias) permanece insignificante em comparação com o placebo .a presente revisão sistemática e meta-análise tem algumas limitações importantes. O LoHF pode ocorrer em situações secundárias à doença cardíaca subjacente, tais como enfarte agudo do miocárdio ou pós-operatório. A maioria dos estudos incluiu investigado LoHF pós-operatório com menos apresentação de LoHF de outras causas. A maioria dos estudos centrou-se em dois inotrópicos (Levosimendano e dobutamina), limitando a compreensão de outros inotrópicos, bem como outras terapias, tais como terapias de dispositivos. Em alguns ensaios, a análise estava em risco de erro de classificação devido a um número significativo de pacientes perdidos no seguimento. Uma vez que a maioria dos ensaios não relatam a diferença de pré e pós-intervenção par com o desvio padrão associado, a diferença pré e pós – intervenção com o desvio padrão, as medidas de resultados pré e pós-intervenção como independentes, isto obtendo intervalos de confiança mais siderais para o efeito do tratamento com um desvio padrão associado.
conclusão
insuficiência cardíaca de baixa potência (LoHF) é uma síndrome clínica caracterizada por diminuição da capacidade cardíaca acompanhada por hipoperfusão em órgãos terminais. É uma forma pouco frequente de insuficiência cardíaca na população em geral, mas prevalente em doentes com HF pós-operação. Sua etiologia é heterogênea, consistindo de várias condições causando estado de baixa saída e cirurgia cardíaca. Os principais mecanismos fisiopatológicos são a disfunção sistólica e/ou diastólica LV, e a disfunção RV causada por alterações na frequência cardíaca, pré-carga, pós-carga e/ou contractilidade. Os factores de risco gerais para o LoHF incluem a doença de Chagas, fracção de ejecção deprimida e disfunção renal, enquanto em doentes pós-operatórios incluem compromisso da função LV, revascularização incompleta, idade mais avançada e presença de diabetes e disfunção renal. O diagnóstico carece de diretrizes padronizadas e depende da coleção Aceita de aberrações hemodinâmicas e fisiológicas, incluindo condições que causam um estado de baixa produção. A história do paciente e o exame físico ajudam a avaliar o estado hemodinâmico e reconhecer o estado de baixa potência, enquanto a ecocardiografia confirma disfunção ventricular (HF) e baixa potência cardíaca. Outros testes para apoiar o diagnóstico ou estabelecer a causa do Estado de baixa produção incluem electrocardiograma e testes laboratoriais básicos (sangue, electrólito sérico, ureia e creatinina, teste hepático, função da tiróide e peptídeos natriuréticos séricos) e imagiologia cardíaca (raio-X torácico ou angiografia coronária). O tratamento carece de orientações estabelecidas, mas depende da avaliação da fisiopatologia individual para seleccionar a estratégia de tratamento mais adequada. O tratamento inclui ventilador de estratégias para melhorar a frequência e o ritmo cardíaco; ajuste de volume para otimizar a pré-carga; suporte farmacológico (inotropes e vasodilatadores) para manipular pós-carga e melhorar a contratilidade; e dispositivo de terapia (balão intra-aórtico uma bomba ou de um dispositivo de assistência ventricular) quando estas estratégias não restaurar o débito cardíaco. Em pacientes selecionados, terapias para reverter a doença subjacente, pode restaurar a saída cardíaca.Inamdar A, Inamdar a (2016) diagnóstico, gestão e utilização de insuficiência cardíaca. J Clin Med 5: 62. Dassanayaka s, Jones SP (2015) desenvolvimentos recentes na insuficiência cardíaca. Res 117: E58-63. McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, et al. (2012) Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Desenvolvido em colaboração com a Associação de insuficiência cardíaca (HFA) do CES. Eur J Falha Cardíaca 14: 803-869.Yancy CW, Jessup M, Bozkurt B, Butler J, Casey de, et al. (2013) 2013 ACCF/aha guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 62: e147-239.Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, et al. (2016) 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: A Task Force para o diagnóstico e tratamento da insuficiência cardíaca aguda e crónica da Sociedade Europeia de Cardiologia (ESC) desenvolveu-se com a contribuição especial da Associação de insuficiência cardíaca (HFA) da CES. Eur Heart J 37: 2129-2200.