Entalpia e reacções químicas
7.3 entalpia e reacções químicas
objectivos de aprendizagem
- Define entalpia.expressa adequadamente a mudança de entalpia das reacções químicas.
- explique como as mudanças de entalpia são medidas experimentalmente.
Agora que temos mostrado como a energia, o trabalho e o calor estão relacionados, estamos prontos para considerar mudanças de energia nas reações químicas. Um conceito fundamental é que cada reação química ocorre com uma mudança concorrente na energia. Agora precisamos aprender como expressar adequadamente essas mudanças de energia.o nosso estudo de gases no Capítulo 6 ” Gases “e a nossa definição de trabalho na secção 7.2″ trabalho e calor ” indicam que condições como pressão, volume e temperatura afetam o conteúdo energético de um sistema. O que precisamos é de uma definição de energia que se mantenha quando algumas destas condições são especificadas (algo semelhante à nossa definição de temperatura e pressão padrão em nosso estudo de gases). Nós definimos a entalpia muda o calor de um processo a pressão constante; denotamos ΔH. (ΔH) como o calor de um processo em que a pressão é mantida constante:
ΔH≡qat pressão constante
a letra H significa entalpia, um tipo de energia, enquanto O Δ implica uma mudança na quantidade. Estaremos sempre interessados na mudança em H, e não no valor absoluto de H em si.quando ocorre uma reação química, há uma mudança característica na entalpia. A mudança de entalpia para uma reação é tipicamente escrita após uma equação química equilibrada e na mesma linha. Por exemplo, quando dois moles de hidrogênio reagem com um mole de oxigênio para fazer dois moles de água, a mudança de entalpia característica é 570 kJ. Podemos escrever a equação como:
2H2(g) + O2(g) → 2H2O(ℓ) ΔH = -570 kJ
Uma equação química que inclui uma mudança de entalpia é chamado de um termoquímicos equationA equação química que inclui uma entalpia de mudança.. Uma equação termoquímica é assumida para se referir à equação em quantidades molares, o que significa que ela deve ser interpretada em termos de moles, não moléculas individuais.
exemplo 5
Write the thermochemical equation for the reaction of PCl3 (g) with Cl2(g) to make PCl5(g), which has an enthalpy change of -88 kJ.
Solução
O termoquímicos equação é
PCl3(g) + Cl2(g) → PCl5(g) ΔH = -88 kJ
faça o Teste
Escrever o termoquímicos equação para a reação N2(g) O2(g) para fazer o 2º classificado(g), que tem uma entalpia de mudança de 181 kJ.
Resposta
N2(g) + O2(g) → 2NO(g) ΔH = 181 kJ
pode ter notado que a ΔH para uma reacção química pode ser positiva ou negativa. O número é assumido como positivo se não tem sinal; um sinal + pode ser adicionado explicitamente para evitar confusão. Uma reação química que tem um ΔH positivo é dita ser uma reação química endotérmica que tem uma mudança positiva na entalpia., while a chemical reaction that has a negative ΔH is said to be exothermicA chemical reaction that has a negative change in entalpy..
O que significa se o ΔH de um processo é positivo? Significa que o sistema em que a reação química está ocorrendo está ganhando energia. Se considerarmos a energia de um sistema como sendo representada como uma altura em um gráfico de energia vertical, a mudança de entalpia que acompanha a reação pode ser diagramada como em parte (a) Na Figura 7.3 “energia de reação”: a energia dos reagentes tem alguma energia, e o sistema aumenta sua energia à medida que vai para os produtos. Os produtos são mais elevados na escala vertical do que os reagentes. Endotérmico, então, implica que o sistema ganha, ou absorve, energia.
Existe uma situação oposta para um processo exotérmico, como mostrado na Parte b) da figura 7.3 “energia de reacção”. Se a mudança de entalpia de uma reação é negativa, o sistema está perdendo energia, então os produtos têm menos energia do que os reagentes, e os produtos são mais baixos na escala de energia vertical do que os reagentes são. Exotérmico, então, implica que o sistema perde, ou emite, energia.
figura 7.3 energia de reacção
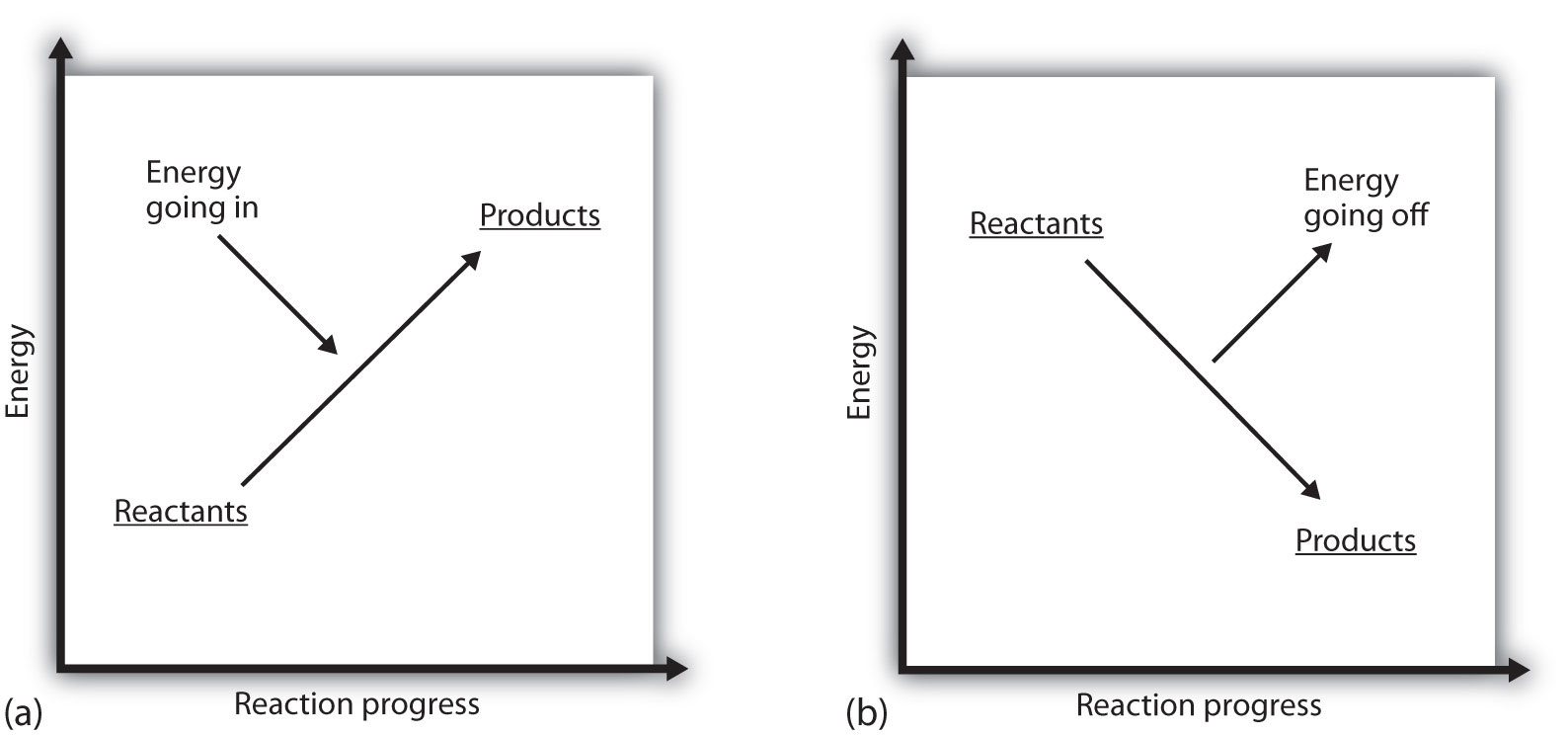
(a) numa reacção endotérmica, a energia do sistema aumenta (isto é, move-se mais alto na escala vertical de energia). (b) em uma reação exotérmica, a energia do sistema diminui (isto é, se move mais baixo na escala vertical de energia).
exemplo 6
considere esta equação termoquímica.
2CO(g) + O2(g) → 2CO2 (g) ΔH = -565 kJ
é exotérmica ou endotérmica? Quanta energia é dada ou absorvida?
solução
Por definição, uma reação química que tem um ΔH negativo é exotérmica, o que significa que esta quantidade de energia—neste caso, 565 kJ—é dada pela reação.considere esta equação termoquímica.
CO2(g) + H2(g) → CO(g) + H2O (g) ΔH = 42 kJ
é exotérmica ou endotérmica? Quanta energia é dada ou absorvida?
Resposta
endotérmica; 42 kJ são absorvidos.como é que os valores ΔH são medidos experimentalmente? Na verdade, ΔH não é medido; q é medido. Mas as medições são realizadas sob condições de pressão constante, de modo que ΔH é igual ao q medido.
experimentalmente, q é medido aproveitando a equação
q = mcΔT
premeia-se a massa dos produtos químicos num sistema. Então deixamos a reação química ocorrer e medimos a mudança na temperatura (ΔT) do sistema. Se nós conhecemos o calor específico dos materiais no sistema (tipicamente, nós sabemos), nós podemos calcular Q. esse valor de q é numericamente igual ao ΔH do processo, que nós podemos escalar até uma escala molar. O recipiente no qual o sistema reside é tipicamente isolado, de modo que qualquer mudança de energia vai para mudar a temperatura do sistema, em vez de ser vazado do sistema. O recipiente é referido como um recipiente calorimeterA utilizado para medir o calor de uma reacção química., and the process of measuring changes in entalpy is called calorimetry process of measuring entalpy changes for chemical reactions..
figura 7.4 calorímetros
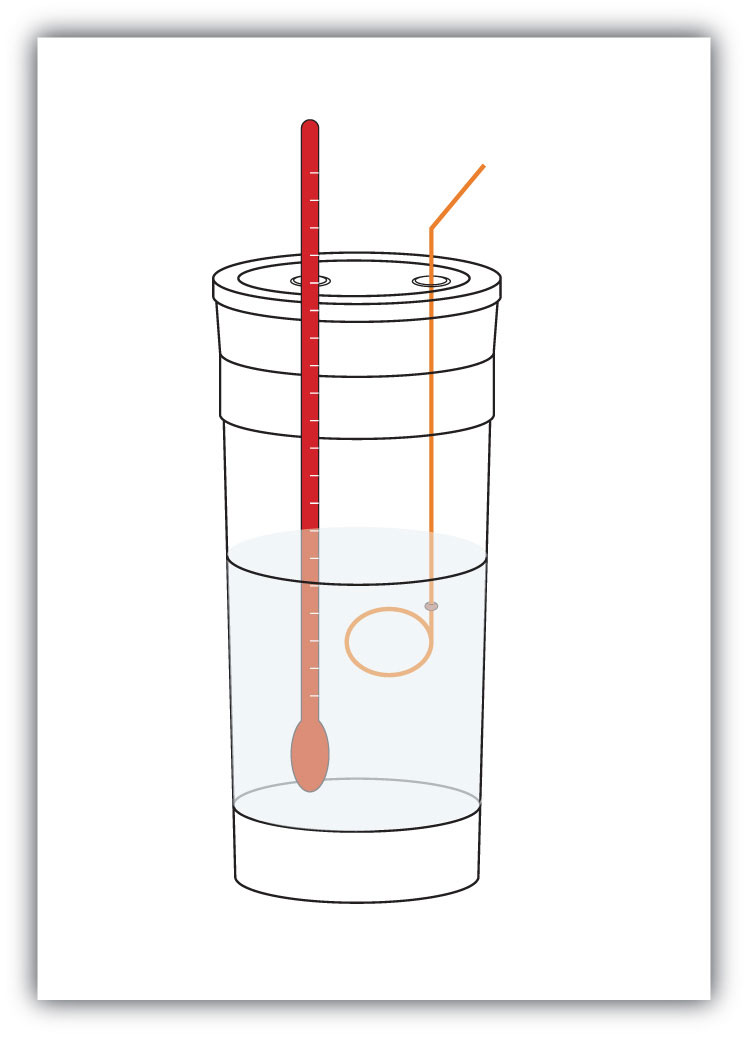
um simples calorímetro pode ser construído a partir de algumas xícaras de café de espuma aninhadas, uma capa, um termómetro e um agitador.
Por exemplo, suponha 4.0 g de NaOH, ou 0,10 mol de NaOH, são dissolvidos para fazer 100.0 mL de solução aquosa, enquanto que de 3,65 g de HCl, ou 0,10 mol de HCl, são dissolvidos para fazer outra 100.0 mL de uma solução aquosa. As duas soluções são misturadas em um calorímetro isolado, um termômetro é inserido, e o calorímetro é coberto (ver Figura 7.4 “calorímetros” para uma configuração de exemplo). O termômetro mede a temperatura mudar conforme a seguinte reação química:
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ)
Um observador observa que o aumento da temperatura de 22,4°C a 29.1°C. Supondo que o calor capacidades e as densidades das soluções são as mesmas de água pura, agora temos a informação de que precisamos para determinar a mudança de entalpia de uma reação química. A quantidade total de solução é de 200, 0 mL, e com uma densidade de 1, 00 g/mL, temos assim 200, 0 g de solução. Usando a equação para q, temos substituto para os nossos experimentais de medidas e o calor específico da água (Tabela 7.1 “Calores Específicos de Várias Substâncias”):
q=(200.0 g)(4.184 J g⋅°C)(6.7°C)
a Solução para q, obtemos
q=5,600 J≡ΔH para a reação
O calor q é igual o ΔH para a reação, porque a reação química ocorre à pressão constante. No entanto, a reação está dando essa quantidade de energia, então o sinal real em ΔH é negativo:
ΔH = -5,600 J para a reação
Assim, temos o seguinte termoquímicos equação para a reação química que ocorreu no calorímetro:
110 NaOH(aq)+110 HCl(aq)→110 NaCl(aq)+110 H2O(ℓ)ΔH=-5,600 J
1/10 de coeficientes estão presentes para nos lembrar que nós começamos com um décimo de mol de cada reagente, assim, podemos fazer um décimo de mol de cada produto. Tipicamente, no entanto, relatamos equações termoquímicas em termos de moles, não um décimo de um mole. Para aumentar as quantidades molares, devemos multiplicar os coeficientes por 10. No entanto, quando fazemos isso, temos 10 vezes mais energia. Assim, temos
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 J
O ΔH pode ser convertido em kJ unidades, para que o nosso final termoquímicos equação é
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
temos apenas de nossos dados experimentais a partir de calorimetria e determinou a mudança de entalpia de uma reação química. Medições semelhantes em outras reações químicas podem determinar os valores ΔH de qualquer reação química que você quer estudar.
exemplo 7
uma solução de 100 mL de 0.25 mol de Ca2+(aq) foi misturado com 0,50 mol de F−(aq) os íons, e CaF2 foi precipitado:
Ca2+(aq) + 2F−(aq) → CaF2(s)
A temperatura da solução aumentou de 10,5°C. Qual foi a mudança de entalpia para a reação química? Qual foi a mudança de entalpia para a produção de 1 mol de CaF2? Suponha que a solução tem a mesma densidade e calor específico que a água.
Solução
Porque nos é dado ΔT diretamente, podemos determinar o calor da reação, que é igual a ΔH:
q=(100 g)(4.184 J g⋅°C)(10.5°C)
resolvendo para q, obtemos
q = 4,400 J
portanto, ΔH = -4,400 J.
de acordo com a estequiometria da reação, exatamente 0,25 mol de CaF2 se formará, então esta quantidade de calor é de 0,25 mol. Para 1 mol de CaF2, precisamos dimensionar o calor por um fator de quatro:
q = 4,400 J × 4 = 17,600 J, para 1 mol de CaF2
Em um molar base, a variação de entalpia é
ΔH = -17,600 J = -17.6 kJ
faça o Teste
Em um calorímetro a pressão constante, de 0,10 mol de CH4(g) e 0,20 mol de O2(g) são reagiu.
CH4(g) + 2O2(g) → CO2(g) + 2H2O (ℓ)
a reação aquece 750.0 g de H2O por 28,4°C. O que é ΔH para a reacção numa escala molar?
resposta
-891 kJ
Takeways
- Cada reacção química ocorre com uma mudança concomitante de energia.a variação da entalpia é igual ao calor a uma pressão constante.as mudanças de entalpia podem ser expressas usando equações termoquímicas.as mudanças de entalpia são medidas usando Calorimetria.exercícios
-
em que circunstâncias é q e ΔH o mesmo?
-
em que circunstâncias são q e ΔH diferentes?
hidrogénio gas e cloro gas reagem para fazer cloreto de hidrogénio gas com uma mudança de entalpia de -184 kJ. Escreva uma equação termoquímica equilibrada para este processo.
-
-
o metal de sódio pode reagir com azoto para fazer azida de sódio (NaN3) com ΔH de 21,72 kJ. Este processo é exotérmico ou endotérmico?
-
desenhar um diagrama do nível de energia para a reacção química no exercício 8. (Ver Figura 7.3 “energia de reacção”, por exemplo.)
-
desenhar um diagrama do nível de energia para a reacção química no exercício 9. (Ver Figura 7.3 “energia de reacção”, por exemplo.)
-
numa solução de 250 mL, são combinados 0, 25 mol de KOH(aq) e 0, 25 mol de HNO3(aq). A temperatura da solução aumenta de 22,5°C para 35,9°C. Assume-se que a solução tem a mesma densidade e capacidade térmica de água. Qual é o calor da reação, e qual é o ΔH da reação em uma base molar?
-
numa solução de 600 mL, 0.50 mol de Ca (OH)2 (aq) e 0,50 mol de H2SO4(aq) são combinados. A temperatura da solução aumenta em 22,3°C. Qual é o calor da reação, e qual é o ΔH da reação em uma base molar? Suponha que a solução tem a mesma densidade e capacidade de calor da água.
-
para aquecer 400, 0 g de H2O, queimam-se 0, 050 mol de etanol (C2H5OH). A água aquece de 24,6°C a 65,6°C. Qual é o calor da reação, e qual é o ΔH da reação em uma base molar?
-
para aquecer 100, 0 g de H2O, queima-se 0, 066 moles de cera de abelhas. A água aquece de 21,4°C a 25,5°C. Qual é o calor da reação, e qual é o ΔH da reação em uma base molar?
propano (C3H8) reage com gás oxigenado elementar para produzir dióxido de carbono e água líquida com uma mudança de entalpia de -2,220 kJ. Escreva uma equação termoquímica equilibrada para este processo.
o gás nitrogénio reage com o gás oxigenado, absorvendo 180 kJ. Escreva uma equação termoquímica equilibrada para este processo.
sódio sólido reage com cloro gasoso produzindo cloreto de sódio sólido, libertando 772 kJ. Escreva uma equação termoquímica equilibrada para este processo.
hidrogénio gas e cloro gas reagem para fazer cloreto de hidrogénio gas com uma mudança de entalpia de -184 kJ. Este processo é endotérmico ou exotérmico?
propano (C3H8) reage com gás oxigenado elementar para produzir dióxido de carbono, libertando 2,220 kJ de energia. Este processo é endotérmico ou exotérmico?
o gás nitrogénio reage com o gás oxigenado, absorvendo 180 kJ. Este processo é exotérmico ou endotérmico?
Respostas
-
sob condições de pressão constante
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2º classificado(g) ΔH = 180 kJ
-
exotérmica
-
endothermic
-
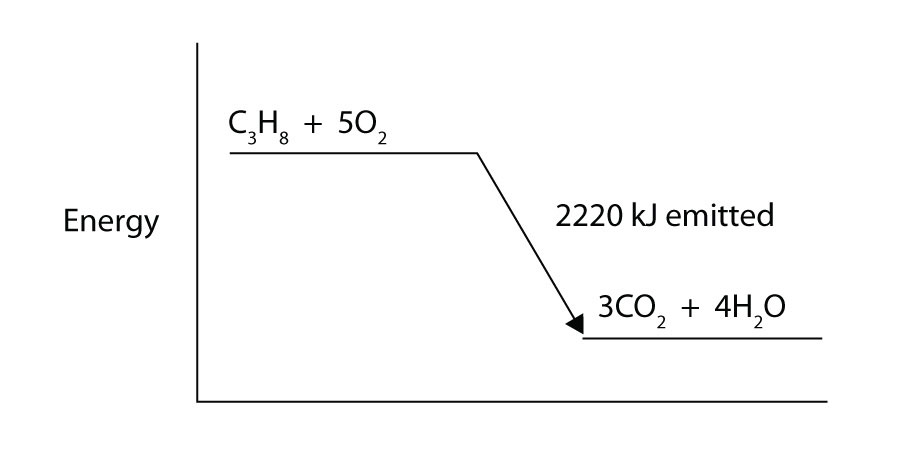
-
calor de reação = -14.0 kJ; ΔH = -56.0 kJ/mol dos reagentes
-
calor de reação = -68.6 kJ; ΔH = -1,370 kJ/mol de etanol