Introductory Chemistry-1st Canadian Edition
Learning Objectives
- Define buffer.identificar correctamente os dois componentes de um tampão.como indicado na secção 12.4 “ácidos e Bases fortes e fracos e seus sais”, os ácidos fracos são relativamente comuns, mesmo nos alimentos que comemos. Mas ocasionalmente encontramos um ácido forte ou base, como ácido estomacal,que tem um pH fortemente ácido de 1,7. Por definição, ácidos e bases fortes podem produzir uma quantidade relativamente grande de H+ ou OH− ions e, consequentemente, têm atividades químicas marcadas. Além disso, quantidades muito pequenas de ácidos fortes e bases podem mudar o pH de uma solução muito rapidamente. Se 1 mL de ácido estomacal foram adicionados à corrente sanguínea e nenhum mecanismo de correção estavam presentes, o pH do sangue diminuiria de cerca de 7,4 para cerca de 4,7—um pH que não é conducente à continuação da vida. Felizmente, o corpo tem um mecanismo para minimizar tais mudanças dramáticas de pH.
O mecanismo envolve um tampão, uma solução que resiste a mudanças drásticas no pH. Buffers de fazê-lo por ser composto de certos pares de solutos: um ácido fraco mais um sal derivado do ácido fraco ou uma base fraca, além de um sal de base fraca. Por exemplo, um buffer pode ser composto de HC2H3O2 dissolvido (um ácido fraco) e NaC2H3O2 dissolvido (o sal derivado desse ácido fraco). Outro exemplo de buffer é uma solução contendo NH3 (uma base fraca) e NH4Cl (um sal derivado dessa base fraca).usemos um tampão HC2H3O2/NaC2H3O2 para demonstrar como funcionam os tampões. Se uma base forte—uma fonte de OH−(aq) os íons—é adicionado à solução tampão, aqueles OH− íons reagem com o HC2H3O2 ácido-base reação:
HC2H3O2(aq) + OH−(aq) → H2O(ℓ) + C2H3O2−(aq)
em Vez de alterar o pH drasticamente, tornando a solução básica, a mais-OH− íons reagem para fazer H2O, assim, o pH não muda muito.se um ácido forte—uma fonte de H+ iões—for adicionado à solução tampão, Os iões h+ reagirão com o ânion a partir do sal. Como HC2H3O2 é um ácido fraco, não é ionizado muito. Isso significa que, se grandes quantidades de H+ íons e C2H3O2− íons estão presentes na mesma solução, eles vão se reunir para fazer HC2H3O2:
H+(aq) + C2H3O2−(aq) → HC2H3O2(aq)
em Vez de alterar o pH drasticamente e tornando a solução ácida adicionado H+ íons reagem para formar moléculas de um ácido fraco. A figura 12.2″ as acções dos amortecedores ” ilustra ambas as acções de um amortecedor.
figura 12.2 as acções dos tampões de choque
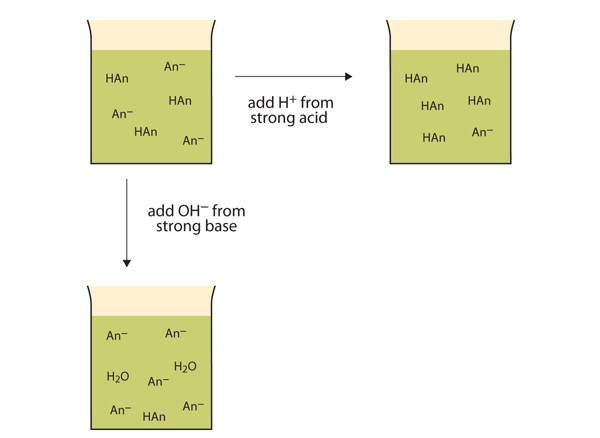
tampões podem reagir com ácidos fortes (topo) e bases fortes (lado) para minimizar grandes alterações no pH.tampões de choque fabricados a partir de bases fracas e sais de bases fracas actuam da mesma forma. Por exemplo, em um tampão contendo NH3 e NH4Cl, moléculas de NH3 pode reagir com qualquer excesso de H+ íons introduzido por ácidos fortes:
NH3(aq) + H+(aq) → NH4+(aq)
enquanto o NH4+(aq) íon pode reagir com qualquer OH− íons introduzido por bases fortes:
NH4+(aq) + OH−(aq) → NH3(aq) + H2O(ℓ)
Exemplo 15
as combinações de compostos pode fazer uma solução tampão?
- HCHO2 e NaCHO2
- HCl e NaCl
- CH3NH2 e CH3NH3Cl
- NH3 e NaOH
Solução
- HCHO2 é ácido fórmico, um ácido fraco, enquanto NaCHO2 é o sal feita a partir do ânion do ácido fraco (o formato de íons ). A combinação destes dois solutos faria uma solução tampão.
- HCl é um ácido forte, não um ácido fraco, então a combinação destes dois solutos não faria uma solução tampão.
- CH3NH2 é metilamina, que é como NH3 com um dos seus átomos H substituídos por um grupo CH3. Porque não está listado na Tabela 12.2 “Ácidos fortes e Bases”, podemos assumir que é uma base fraca. O composto CH3NH3Cl é um sal feito a partir dessa base fraca, então a combinação destes dois solutos faria uma solução tampão.
- NH3 é uma base fraca, mas NaOH é uma base forte. A combinação destes dois solutos não faria uma solução tampão.que combinações de compostos podem constituir uma solução-tampão?
- NaHCO3 e NaCl
- H3PO4 e NaH2PO4
- NH3 e (NH4)3PO4
- NaOH e NaCl
Respostas
- não
- sim
- sim
- não
Buffers funcionam bem apenas para uma quantidade limitada de adicionado ácido forte ou base forte. Uma vez que o soluto é completamente reagido, a solução não é mais um buffer, e mudanças rápidas no pH podem ocorrer. Dizemos que um amortecedor tem uma certa capacidade. Os Buffers que têm mais soluto dissolvido neles para começar têm maiores capacidades, como seria de esperar.
o sangue humano tem um sistema tampão para minimizar alterações extremas no pH. um tampão no sangue é baseado na presença de HCO3− e H2CO3 . Com este tampão presente, mesmo se algum ácido estomacal fosse encontrar seu caminho diretamente na corrente sanguínea, a mudança no pH do sangue seria mínima. Dentro de muitas das células do corpo, há um sistema de tamponamento baseado em íons de fosfato.
aplicação de alimentos e bebidas: O Ácido Que Alivia a Dor
Embora os medicamentos não são exatamente “comida e bebida” nós fazemos ingeri-los, então vamos dar uma olhada em um ácido que é, provavelmente, o mais comum medicina: ácido acetilsalicílico, também conhecido como aspirina. A aspirina é bem conhecida como um analgésico e antipirético (redutor de febre).
A estrutura da aspirina é mostrada na figura que a acompanha. A parte ácida é circulada; é o átomo H nessa parte que pode ser doado como aspirina atua como um ácido Brønsted-Lowry. Como não é dado na tabela 12.2 “ácidos fortes e Bases”, ácido acetilsalicílico é um ácido fraco. No entanto, ainda é um ácido, e dado que algumas pessoas consomem quantidades relativamente grandes de aspirina diariamente, sua natureza ácida pode causar problemas no revestimento do estômago, apesar das defesas do estômago contra seu próprio ácido do estômago.
Figura 12.3 A Estrutura Molecular da Aspirina

O círculo átomos são o ácido parte da molécula.como as propriedades ácidas da aspirina podem ser problemáticas, muitas marcas de aspirina oferecem uma forma de “aspirina tamponada” do medicamento. Nestes casos, a aspirina também contém um agente tampão-geralmente MgO-que regula a acidez da aspirina para minimizar os seus efeitos secundários ácidos.
tão útil e comum como a aspirina é, foi formalmente comercializado como um medicamento a partir de 1899. A Food and Drug Administration (FDA) DOS EUA, a agência governamental encarregada de supervisionar e aprovar drogas nos Estados Unidos, não foi formada até 1906. Alguns argumentaram que se a FDA tivesse sido formada antes da aspirina ser introduzida, a aspirina pode nunca ter obtido aprovação devido ao seu potencial para efeitos colaterais—hemorragia gastrointestinal, zumbidos nos ouvidos, síndrome de Reye (um problema de fígado), e algumas reações alérgicas. No entanto, recentemente a aspirina tem sido elogiada por seus efeitos em diminuir os ataques cardíacos e derrames, por isso é provável que a aspirina está aqui para ficar.
Takeaways chave
- um buffer é uma solução que resiste a alterações súbitas no pH.
Exercícios
-
Definir buffer. Que dois componentes químicos relacionados são necessários para fazer um buffer?pode fazer-se um tampão combinando um ácido forte com uma base forte? Porquê ou porque não?que combinações de compostos podem constituir um tampão? Suponha soluções aquosas.
a) HCl e NaCl
b) HNO2 e NaNO2
c) NH4NO3 e HNO3
d) NH4NO3 e NH3
4. Que combinações de compostos podem fazer um tampão? Suponha soluções aquosas.
a) H3PO4 e Na3PO4
b) NaHCO3 e Na2CO3
c) NaNO3 e Ca(NO3)2
d) HN3 e NH3
5. Para cada combinação no exercício 3 que é um buffer, escreva as equações químicas para as reações dos componentes do buffer quando um ácido forte e uma base forte é adicionado.
6. Para cada combinação no exercício 4 que é um buffer, escreva as equações químicas para as reações dos componentes do buffer quando um ácido forte e uma base forte é adicionado.
7. O sistema de tampão fosfato completo baseia-se em quatro substâncias: H3PO4, H2PO4 -, HPO42−, e PO43 -. Que diferentes soluções-tampão podem ser feitas a partir destas substâncias?
8. Explique por que o NaBr não pode ser um componente em um tampão ácido ou básico.
9. Duas soluções são feitas contendo as mesmas concentrações de solutos. Uma solução é composta por H3PO4 e Na3PO4, enquanto a outra é composta por HCN e NaCN. Que solução deve ter a maior capacidade como tampão?
10. Duas soluções são feitas contendo as mesmas concentrações de solutos. Uma solução é composta por NH3 e NH4NO3, enquanto a outra é composta por H2SO4 e Na2SO4. Que solução deve ter a maior capacidade como tampão?
respostas
um tampão é a combinação de um ácido fraco ou base e um sal desse ácido fraco ou base.
a) no
B) yes
c) no
D) yes
3b: strong acid: NO2− + H+ → HNO2; strong base: HNO2 + OH− → NO2− + H2O; 3d: strong base: NH4+ + OH− → NH3 + H2O; strong acid: NH3 + h+ → NH4+7.os tampões de choque podem ser feitos a partir de três combinações.: (1) H3PO4 e H2PO4−, (2) H2PO4− e HPO42−, e (3) HPO42− e PO43−. (Tecnicamente, um buffer pode ser feito a partir de quaisquer dois componentes.)
O tampão fosfato deve ter a maior capacidade.