2.1: evoluția teoriei atomice
Teoria atomică după secolul al XIX-lea
dacă materia ar fi compusă din atomi, din ce ar fi compuși atomii? Au fost cele mai mici particule sau a existat ceva mai mic? La sfârșitul anilor 1800, un număr de oameni de știință interesați de astfel de întrebări au investigat descărcările electrice care ar putea fi produse în gazele de joasă presiune, cu cea mai semnificativă descoperire făcută de fizicianul englez J. J. Thomson folosind un tub cu raze catodice. Acest aparat consta dintr-un tub de sticlă sigilat din care fusese îndepărtat aproape tot aerul; tubul conținea doi electrozi metalici. Când s-a aplicat tensiune înaltă peste electrozi, între ei a apărut un fascicul vizibil numit rază catodică. Acest fascicul a fost deviat spre sarcina pozitivă și departe de sarcina negativă și a fost produs în același mod cu proprietăți identice atunci când au fost utilizate metale diferite pentru electrozi. În experimente similare, raza a fost deviată simultan de un câmp magnetic aplicat, iar măsurătorile gradului de deformare și intensitatea câmpului magnetic i-au permis lui Thomson să calculeze raportul sarcină-masă al particulelor de raze catodice. Rezultatele acestor măsurători au indicat că aceste particule erau mult mai ușoare decât atomii (figura \(\PageIndex{1}\)).
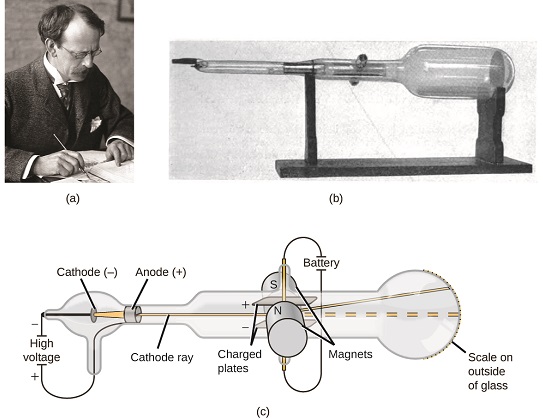
figura \(\PageIndex{5}\): (a) J. J. Thomson a produs un fascicul vizibil într-un tub catodic. (b) acesta este un tub catodic timpuriu, inventat în 1897 de Ferdinand Braun. (c) în raza catodică, fasciculul (prezentat în galben) provine de la catod și este accelerat dincolo de anod spre o scară fluorescentă la capătul tubului. Deformările simultane prin câmpuri electrice și magnetice aplicate i-au permis lui Thomson să calculeze raportul masă-încărcare a particulelor care compun raza catodică. (credit a: modificarea lucrărilor de către Fundația Nobel; credit b: modificarea lucrărilor de Eugen Nesper; credit c: modificarea lucrărilor de către „Kurzon”/Wikimedia Commons).
pe baza observațiilor sale, iată ce a propus Thomson și de ce: particulele sunt atrase de sarcini pozitive (+) și respinse de sarcini negative ( − ), deci trebuie să fie încărcate negativ (cum ar fi sarcinile resping și spre deosebire de sarcinile care atrag); sunt mai puțin masive decât atomii și indistinguizabile, indiferent de materialul sursă, deci trebuie să fie constituenți fundamentali, subatomici ai tuturor atomilor. Deși controversată la acea vreme, ideea lui Thomson a fost acceptată treptat, iar particula sa cu raze catodice este ceea ce numim acum un electron, o particulă subatomică încărcată negativ, cu o masă de peste o mie de ori mai mică decât cea a unui atom. Termenul ” electron „a fost inventat în 1891 de fizicianul irlandez George Stoney, din „ion electric”.”
în 1909, mai multe informații despre electron au fost descoperite de fizicianul american Robert A. Millikan prin experimentele sale de” picătură de ulei”. Millikan a creat picături microscopice de ulei, care ar putea fi încărcate electric prin frecare pe măsură ce s-au format sau prin utilizarea razelor X. Aceste picături au căzut inițial din cauza gravitației, dar progresul lor descendent ar putea fi încetinit sau chiar inversat de un câmp electric mai mic în aparat. Prin ajustarea intensității câmpului electric și efectuarea unor măsurători atente și calcule ADECVATE, Millikan a reușit să determine sarcina pe picături individuale (figura \(\PageIndex{2}\)).
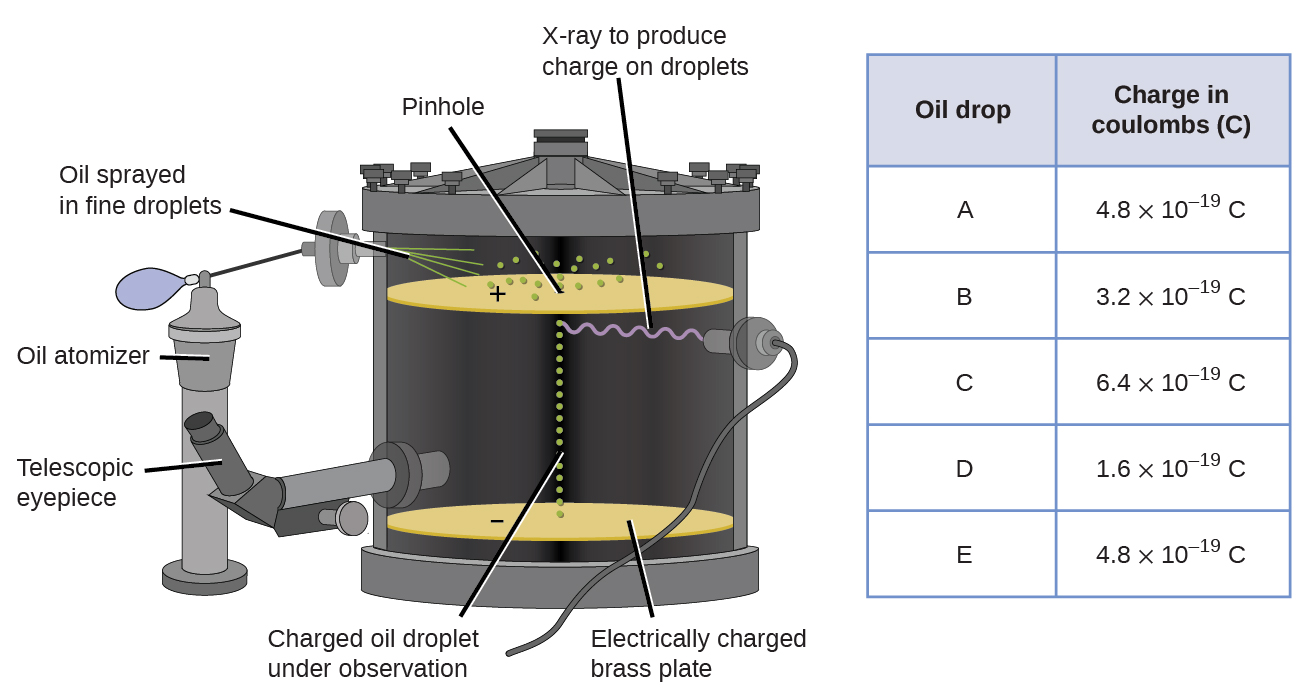
figura \(\PageIndex{6}\): experimentul lui Millikan a măsurat sarcina picăturilor individuale de ulei. Datele tabelate sunt exemple de câteva valori posibile.
privind datele de încărcare pe care Millikan le—a adunat, este posibil să fi recunoscut că sarcina unei picături de ulei este întotdeauna un multiplu al unei sarcini specifice, de 1,6 \(\ori\) 10-19 C. Millikan a concluzionat că această valoare trebuie să fie, prin urmare, o sarcină fundamentală—sarcina unui singur electron-cu sarcinile sale măsurate datorită unui exces de un electron (de 1 ori 1.6\ (\ori\) 10-19 C), doi electroni (de 2 ori 1,6 \(\ori\) 10-19 C), trei electroni (de 3 ori 1,6 \(\ori\) 10-19 C) și așa mai departe, pe o picătură de ulei dată. Deoarece sarcina unui electron era acum cunoscută datorită cercetării lui Millikan, iar raportul sarcină-masă era deja cunoscut datorită cercetării lui Thomson (1,759 \(\times\) 1011 C/kg), a necesitat doar un calcul simplu pentru a determina și masa electronului.
\
oamenii de știință stabiliseră acum că atomul nu era indivizibil așa cum credea Dalton și, datorită muncii lui Thomson, Millikan și a altora, sarcina și masa particulelor subatomice negative—electronii—erau cunoscute. Cu toate acestea, partea încărcată pozitiv a unui atom nu a fost încă bine înțeleasă. În 1904, Thomson a propus modelul de atomi „budincă de prune”, care a descris o masă încărcată pozitiv cu o cantitate egală de sarcină negativă sub formă de electroni încorporați în ea, deoarece toți atomii sunt neutri din punct de vedere electric. Un model concurent fusese propus în 1903 de Hantaro Nagaoka, care postula un atom asemănător lui Saturn, format dintr-o sferă încărcată pozitiv înconjurată de un halou de electroni (figura \(\PageIndex{3}\)).
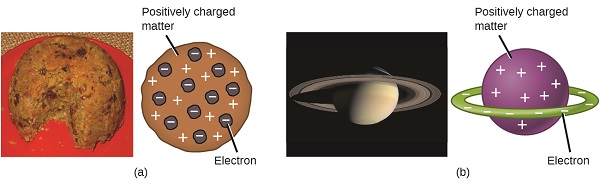
figura \(\PageIndex{7}\): (a) Thomson a sugerat că atomii seamănă cu budinca de prune, un desert englezesc format din tort umed cu stafide încorporate („prune”). (B) Nagaoka a propus că atomii seamănă cu planeta Saturn, cu un inel de electroni care înconjoară o „planetă pozitivă”.”(credit a: modificarea lucrării de către „Man vyi”/Wikimedia Commons; credit b: modificarea lucrării de către „NASA”/Wikimedia Commons).
următoarea dezvoltare majoră în înțelegerea atomului a venit de la Ernest Rutherford, un fizician din Noua Zeelandă care și-a petrecut în mare parte cariera științifică în Canada și Anglia. El a efectuat o serie de experimente folosind un fascicul de particule alfa de mare viteză, încărcate pozitiv (particule de la sută), care au fost produse de dezintegrarea radioactivă a radiului; particulele de la sută constau din doi protoni și doi neutroni (veți afla mai multe despre dezintegrarea radioactivă în capitolul despre chimia nucleară). Rutherford și colegii săi Hans Geiger (mai târziu faimos pentru contorul Geiger) și Ernest Marsden au vizat un fascicul de particule de la centimetrii, a cărui sursă a fost încorporată într-un bloc de plumb pentru a absorbi cea mai mare parte a radiației, la o bucată foarte subțire de folie de aur și au examinat împrăștierea rezultată a particulelor de la centimetrii folosind un Ecran luminescent care strălucea pentru scurt timp în cazul în care a fost lovit de o particulă de la centimetrii.
ce au descoperit? Majoritatea particulelor au trecut prin folie fără a fi deviate deloc. Cu toate acestea, unele au fost deviate ușor, iar un număr foarte mic au fost deviate aproape direct înapoi spre sursă (figura \(\PageIndex{4}\)). Rutherford a descris găsirea acestor rezultate: „a fost cel mai incredibil eveniment care mi s-a întâmplat vreodată în viața mea. A fost aproape la fel de incredibil ca și cum ai fi tras o coajă de 15 inci la o bucată de hârtie absorbantă și s-a întors și te-a lovit”1 (p. 68).
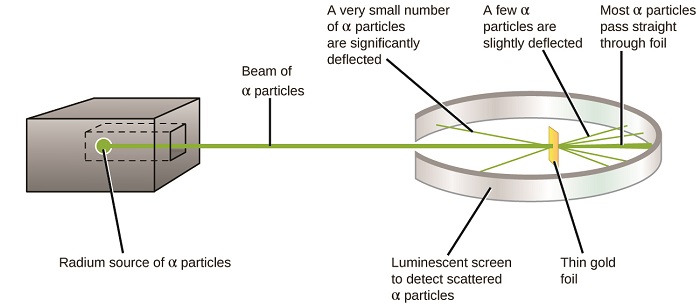
Figure \(\PageIndex{8}\): Geiger și Rutherford au tras particule de la o bucată de folie de aur și au detectat unde s-au dus acele particule, așa cum se arată în această diagramă schematică a experimentului lor. Majoritatea particulelor au trecut direct prin folie, dar câteva au fost deviate ușor și un număr foarte mic a fost deviat semnificativ.
Iată ce a dedus Rutherford: pentru că majoritatea particulelor cu mișcare rapidă în mișcare au trecut prin atomii de aur nedeflectați, trebuie să fi călătorit prin spațiul esențial gol din interiorul atomului. Particulele alfa sunt încărcate pozitiv, astfel încât devierile au apărut atunci când au întâlnit o altă sarcină pozitivă (cum ar fi încărcăturile se resping reciproc). Deoarece încărcăturile asemănătoare se resping una pe cealaltă, cele câteva particule încărcate pozitiv care și-au schimbat brusc căile trebuie să fi lovit sau să se apropie îndeaproape de un alt corp care avea, de asemenea, o sarcină pozitivă foarte concentrată. Deoarece devierile au avut loc o mică parte din timp, această încărcare a ocupat doar o cantitate mică din spațiul din folia de aur. Analizând în detaliu o serie de astfel de experimente, Rutherford a tras două concluzii:
- volumul ocupat de un atom trebuie să constea dintr-o cantitate mare de spațiu gol.
- un corp mic, relativ greu, încărcat pozitiv, nucleul, trebuie să fie în centrul fiecărui atom.
această analiză l-a determinat pe Rutherford să propună un model în care un atom constă dintr-un nucleu foarte mic, încărcat pozitiv, în care cea mai mare parte a masei atomului este concentrată, înconjurată de electronii încărcați negativ, astfel încât atomul să fie neutru din punct de vedere electric (figura \(\PageIndex{5}\)).
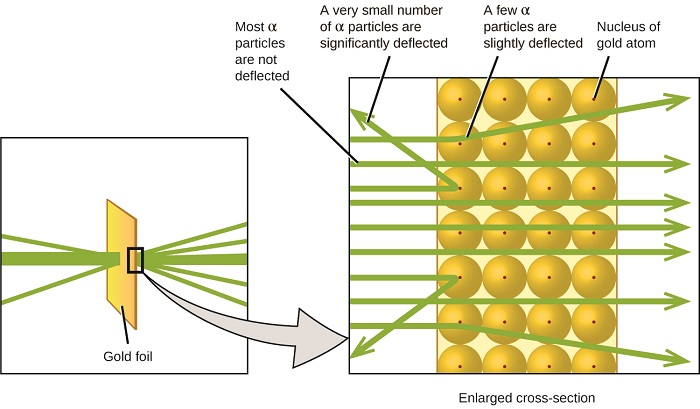
figura \(\PageIndex{9}\): particulele inqq sunt deviate numai atunci când se ciocnesc sau trec aproape de nucleul de aur mult mai greu, încărcat pozitiv. Deoarece nucleul este foarte mic în comparație cu dimensiunea unui atom, foarte puține particule de centimetrie sunt deviate. Majoritatea trec prin regiunea relativ mare ocupată de electroni, care sunt prea ușori pentru a devia particulele în mișcare rapidă.după mai multe experimente, Rutherford a descoperit, de asemenea, că nucleele altor elemente conțin nucleul de hidrogen ca „element de construcție” și a numit această particulă mai fundamentală protonul, particula subatomică încărcată pozitiv Găsită în nucleu. Cu un plus, pe care îl veți învăța în continuare, acest model nuclear al atomului, propus acum peste un secol, este folosit și astăzi.
o altă descoperire importantă a fost descoperirea izotopilor. La începutul anilor 1900, oamenii de știință au identificat mai multe substanțe care păreau a fi elemente noi, izolându-le de minereurile radioactive. De exemplu, un” element nou ” produs de dezintegrarea radioactivă a toriului a primit inițial numele de mesothorium. Cu toate acestea, o analiză mai detaliată a arătat că mezotoriul era identic din punct de vedere chimic cu radiul (un alt produs de descompunere), în ciuda faptului că avea o masă atomică diferită. Acest rezultat, împreună cu descoperiri similare pentru alte elemente, l-au determinat pe chimistul englez Frederick Soddy să realizeze că un element ar putea avea tipuri de atomi cu mase diferite care nu se disting chimic. Aceste tipuri diferite se numesc izotopi-atomi ai aceluiași element care diferă în masă. Soddy a primit Premiul Nobel pentru Chimie în 1921 pentru această descoperire.
a rămas un puzzle: se știa că nucleul conține aproape toată masa unui atom, numărul de protoni furnizând doar jumătate sau mai puțin din acea masă. Au fost făcute diferite propuneri pentru a explica ce a constituit masa rămasă, inclusiv existența particulelor neutre în nucleu. După cum v-ați putea aștepta, detectarea particulelor neîncărcate este foarte dificilă și abia în 1932 James Chadwick a găsit dovezi ale neutronilor, particule subatomice neîncărcate, cu o masă aproximativ aceeași cu cea a protonilor. Existența neutronului a explicat și izotopii: diferă în masă deoarece au un număr diferit de neutroni, dar sunt identici din punct de vedere chimic, deoarece au același număr de protoni. Acest lucru va fi explicat mai detaliat mai târziu în această unitate.