5.3: Lewis Diagrams
Lewis a folosit diagrame simple (numite acum diagrame Lewis) pentru a urmări câți electroni au fost prezenți în învelișul exterior sau valență al unui atom dat. Nucleul atomului, adică nucleul împreună cu electronii interiori, este reprezentat de simbolul chimic și numai electronii de valență sunt desenați ca puncte care înconjoară simbolul chimic. Astfel, cei trei atomi prezentați în Figura 1 din electroni și valență pot fi reprezentați de următoarele diagrame Lewis:
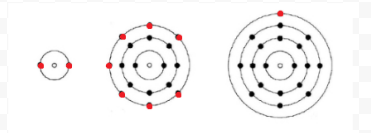

dacă atomul este un atom de gaz nobil, sunt posibile două proceduri alternative. Fie putem considera atomul ca având electroni de valență zero, fie putem considera învelișul exterior umplut ca fiind învelișul de valență. Primele trei gaze nobile pot fi astfel scrise ca:
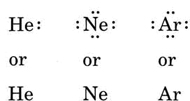
exemplu \(\PageIndex{1}\): structuri Lewis
desenați diagrame Lewis pentru un atom al fiecăruia dintre următoarele elemente: Li, N, F, Na
soluție
aflăm din tabelul periodic din interiorul capacului frontal că Li are un număr atomic de 3. Astfel, conține trei electroni, unul mai mult decât gazul nobil He. Aceasta înseamnă că învelișul exterior sau valența conține un singur electron, iar diagrama Lewis este
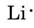
urmând același raționament, N are șapte electroni, cu cinci mai mulți decât el, în timp ce F are nouă electroni, cu șapte mai mulți decât el, dând
![]()
Na are nouă mai mulți electroni decât el, dar opt dintre ei sunt în kernel, corespunzând celor opt electroni din învelișul exterior al Ne. Deoarece Na are doar 1 electron mai mult decât Ne, diagrama sa Lewis este
![]()
observați din exemplul precedent că diagramele Lewis ale metalelor alcaline sunt identice, cu excepția simbolurilor lor chimice. Acest lucru este de acord frumos cu comportamentul chimic foarte similar al metalelor alcaline. În mod similar, diagramele Lewis pentru toate elementele din alte grupuri, cum ar fi pământurile alcaline sau halogeni, arată la fel.
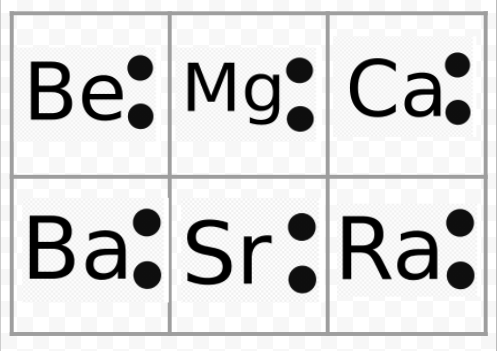
diagramele Lewis pot fi de asemenea folosite pentru a prezice valențele elementelor. Lewis a sugerat că numărul de valențe ale unui atom era egal cu numărul de electroni din învelișul său de valență sau cu numărul de electroni care ar trebui adăugați la învelișul de valență pentru a realiza structura învelișului electronic al următorului gaz nobil. Ca exemplu al acestei idei, luați în considerare elementele Be și O. diagramele lor Lewis și cele ale gazelor nobile He și Ne sunt

comparând Be cu He, vedem că primul are încă doi electroni și, prin urmare, ar trebui să aibă o valență de 2. Elementul O ar putea fi de așteptat să aibă o valență de 6 sau o valență de 2, deoarece are șase electroni de valență—doi mai puțin decât Ne. Folosind regulile de valență dezvoltate în acest fel, Lewis a putut explica creșterea și scăderea regulată a indicilor compușilor din tabelul găsit în secțiunea de valență și reprodus aici. În plus, el a fost capabil să reprezinte mai mult de 50 la sută din formulele din tabel. (Cei care sunt de acord cu ideile sale sunt umbrite în culori în tabel. Poate doriți să consultați acel tabel acum și să verificați dacă unele dintre formulele indicate respectă regulile lui Lewis.) Succesul lui Lewis în acest sens a dat un indiciu clar că electronii au fost cel mai important factor în menținerea atomilor împreună atunci când s-au format molecule.
În ciuda acestor succese, există și dificultăți în teoriile lui Lewis, în special pentru elementele dincolo de calciu din tabelul periodic. Elementul Br (Z = 35), de exemplu, are cu 17 mai mulți electroni decât gazul nobil Ar (Z = 18). Acest lucru ne conduce la concluzia că Br are 17 electroni de valență, ceea ce face ciudat să explicăm de ce Br seamănă atât de strâns cu Cl și F, chiar dacă acești doi atomi au doar șapte electroni de valență.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. De asemenea, este foarte important să vă asigurați că nu aveți nevoie de ajutor pentru a vă asigura că aveți nevoie de ajutor.