aruncați o privire la articolele recente
rezumat
insuficiența cardiacă cu ieșire redusă (lohf) este o formă mai puțin frecventă de insuficiență cardiacă (HF), dar care semnalează HF foarte avansat. Este asociat cu prognostic amenințător, precum și cu morbiditate și mortalitate substanțiale. Cu toate acestea, LoHF rămâne în mare parte sub-cercetat. Descrierea tradițională a HF s-a axat pe insuficiența cardiacă congestivă (CHF) marcată de debitul cardiac scăzut și însoțită de congestie pulmonară/periferică. Acest accent a contribuit la subaprecierea pacienților cu LoHF care au puține sau deloc dovezi de congestie. Mai mult, pacienții cu LoHF nu au o terapie dovedită, iar selecția tratamentului adecvat depinde de fiziopatologia individuală și de etiologia subiacentă. Pacienții cu LoHF au etiologie și fiziopatologie eterogene, subliniind importanța înțelegerii aprofundate a caracteristicilor sale clinice, a diagnosticului și a managementului clinic, care constituie baza prezentei revizuiri.
cuvinte cheie
sindrom cardiac cu ieșire redusă, insuficiență cardiacă cu ieșire redusă, stare cu ieșire redusă
Introducere
În ciuda progreselor remarcabile în terapiile medicale și chirurgicale, gestionarea eficientă a insuficienței cardiace (HF) continuă să reprezinte provocări semnificative pentru furnizorii de asistență medicală. Provocarea este reflectată de ratele ridicate ale readmisiilor spitalicești legate de HF, împreună cu creșterea mortalității și morbidității . O parte a provocării este etiologia foarte eterogenă, fiziopatologia și prezentările clinice ale diferitelor forme de HF, în care unele forme de HF au o cantitate mică de date din studiile clinice și, prin urmare, o înțelegere limitată. În special, descrierea tradițională a HF a fost aproape sinonimă cu insuficiența cardiacă congestivă (CHF), cu toate acestea, termenul CHF exclude o minoritate de pacienți cu HF care au simptome puțin sau deloc demonstrabile de congestie pulmonară și/sau periferică . HF cu ieșire redusă (LoHF) a fost, de asemenea, legat de un prognostic amenințător și semnalează HF foarte avansat. Mai mult, diferențele simptomatice și patofiziologice în CHF și LoHF susțin necesitatea unor abordări diferite de management clinic . În ciuda acestor diferențe, terapiile tradiționale HF au fost generalizate la toate formele de HF, inclusiv CHF și LoHF, creând o nevoie Clinică de a înțelege fiziopatologia, diagnosticul și managementul clinic al lohf. În acest articol, agregăm dovezi publicate despre LoHF în ceea ce privește epidemiologia, etiologia, fiziopatologia, diagnosticul și managementul clinic. Intenția este de a reînnoi cunoștințele despre starea clinică a LoHF, precum și de a îmbunătăți managementul clinic al HF în general.
definiție
insuficiența cardiacă este un sindrom clinic complex marcat de defecte miocardice structurale și / sau funcționale care duc la umplerea sau ejecția ventriculară afectată . Complexitatea sindromului este evidentă în clasificările sale eterogene: dreapta, stânga sau bi-ventricular pe baza localizării defectului; acută sau cronică pe baza timpului de debut; fracție de ejecție conservată, limită sau redusă pe baza stării funcționale; ieșire scăzută sau ridicată bazată pe debitul cardiac (CO) și insuficiență înainte sau înapoi bazată pe direcția fluxului sanguin. Fiecare dintre aceste clasificări este semnificativă pentru diagnosticul și tratamentul HF . În ciuda mai multor clasificări, termenul CHF a fost folosit în mod tradițional interschimbabil cu HF, dar care nu descrie suficient LoHF din cauza mai multor diferențe simptomatice și fiziopatologice.
LoHF, cunoscut și sub numele de co scăzut în HF decompensat acut, descrie o formă de HF cu acuitate ridicată caracterizată prin scăderea Co înainte (indicele cardiac< 2.0 L / min / m2 și tensiunea arterială sistolică< 90 mmHg) și hipoperfuzia organului final cu puține sau deloc dovezi de congestie pulmonară . LoHF este diferit de CHF, care descrie HF caracterizat prin reducerea CO care provoacă congestie pulmonară și periferică care duce la dispnee și, respectiv, edem periferic . Liniile directoare ale Societății Europene de Cardiologie (ESC) din 2005 privind diagnosticul și gestionarea HF sugerează un continuum de la sindromul debitului cardiac scăzut (LCOS) la lohf până la șocul cardiogen. Ghidurile ESC definesc șocul cardiogen ca dovadă a perfuziei tisulare induse de HF după corectarea preîncărcării caracterizată prin BP sistolică < 90 mmHg sau o scădere a presiunii arteriale medii > 30 mmHg; producția de urină < 0,5 ml/kg/h; rata pulsului > 60 bătăi pe minut (BPM) cu sau fără semne de congestie . LCOS, pe de altă parte, este frecvent la pacienții cu HF postoperator și este definit ca necesitatea unei pompe cu balon intra-aortic postoperator sau a unui suport inotrop pentru mai mult de 30 de minute într-un cadru de îngrijire acută .
Epidemiologie
prevalența și incidența exactă a LoHF în populația generală sunt complet necunoscute. În prezent, nu există date epidemiologice bazate pe populație specifice LoHF. Singurele date disponibile provin din studii clinice cu un singur centru care investighează o populație selectă de pacienți cu HF care au fost supuși unei intervenții chirurgicale cardiace. În 1975, Parr și colab. a făcut descrierea seminală a entității clinice a LCO și a raportat o incidență de 25% la copiii care au suferit o intervenție chirurgicală cardiacă bazată pe scăderea CO definită ca CI < 2, 0 L/min/m2. Două decenii mai târziu, Wernovsky și colab. a demonstrat aceeași incidență a OCL postoperatorie la pacienții care au suferit o operație de comutare arterială care a avut loc în 6-18 ore post-intervenție chirurgicală. Multe studii clinice recente raportează o variație largă a prevalenței, de la 3,6% (bărbați) și 5,9% (femei) la 9,1% și la 41% și o incidență de 14,7% . Pe termen lung recent (douăzeci de ani: 1990-2009) studiu clinic prospectiv care a implicat 25.176 pacienți consecutivi de chirurgie by-pass a arterei coronare (CABG), Algarni și colab. raportat prevalența LCO postoperatorii a scăzut semnificativ de la 9,1% (1990-1994) la 2,4% (2005-2009) .
etiologia
etiologia LoHF este multi-factorială. În general, este o consecință a ventriculului stâng (LV), a ventriculului drept (RV) sau a ventriculului sistemic (anatomia ventriculului unic) disfuncție și poate include una sau ambele disfuncții sistolice și/sau diastolice . Perturbațiile în umplerea sau ejectarea ventriculară duc la LoHF, care este o complicație frecventă la pacienții care au suferit o intervenție chirurgicală cardiacă sau sunt în șoc cardiogen . Se poate prezenta ca o deteriorare acută la pacienții cu insuficiență cardiacă cronică sau poate fi un episod tranzitoriu și reversibil cu rezoluția declanșatorului acut. Este un sindrom clinic considerat calea finală a unei multitudini de boli care afectează funcția cardiacă. Nu este suficient să se facă diagnosticul de LoHF, cauza principală sau declanșatorul trebuie, de asemenea, determinată și, dacă este posibil, tratată . Tabelul 1 oferă un rezumat al condițiilor care determină o stare de ieșire scăzută la pacienții cu HF.
Tabelul 1. Etiologia stării de ieșire scăzută prin Fiziopatologie
|
mecanisme |
condiții cauzale |
|
pierderea contractilității miocardice |
boli coronariene, cardiomiopatie, miocardită, HF cronică decompensată, chirurgie post-cardiacă, toxine, nutriție (obezitate)m boli infiltrative, insuficiență renală în stadiu final, boala Chagas sau infecție cu HIV |
|
umplerea sau ejectarea ventriculară afectată |
pericardită, efuziune pericardică, tamponadă cardiacă, tension pneumothorax, pulmonary embolism, valvular disease, hypertension, volume overload, cardiomyopathy (hypertrophic/restrictive) |
|
Abnormal Signalling |
Tachyarrhythmia, bradyarrhythmia, |
|
Non-cardiovascular factors |
Infection, sepsis, major surgery, asthma, severe brain injury |
|
High output states |
Thyrotoxicosis (hyperthyroidism), sepsis, anaemia, arteriovenous shunting |
Pathophysiology
înțelegerea actuală a fiziopatologiei LoHF se bazează în mare măsură pe dovezile din studiile clinice efectuate pe pacienți cu CABG postoperator . Semnul distinctiv patologic este co deprimat excesiv însoțit de hipoperfuzia organului final. Fiziologic, inima funcționează ca o pompă pentru a distribui sânge oxigenat în cantități suficiente pentru a satisface nevoile metabolice ale țesuturilor. Deoarece nevoile metabolice variază în situații normale și stresante, CO variază, de asemenea, pentru a satisface această cerere dinamică . Faza diastolică a ciclului cardiac este critică la pacienții cu LoHF, deoarece în timpul relaxării ventriculare apare umplerea coronariană pentru a asigura oxigenarea miocardului . Ritmul cardiac (HR) este, de asemenea, semnificativ în diastolă, deoarece HR prea rapid împiedică inima să obțină relaxare miocardică completă și perfuzie. Astfel, disfuncția cardiacă rezultă din tulburări structurale (anomalii cardiace reziduale) sau tulburări cardiace funcționale (tulburări de umplere sau golire ventriculară sau rezistență vasculară sistemică crescută ).
fiziopatologic, CO depinde de HR și de volumul cursei (SV) (CO = HR * SV). Volumul cursei la rândul său este produsul net al a trei variabile de circulație inter-legate: preîncărcare, postîncărcare și contractilitate. Dacă una sau mai multe dintre aceste componente sunt afectate, se poate dezvolta o stare de ieșire cardiacă scăzută . Mai mult, aceste componente afectează atât fazele sistolice, cât și diastolice ale ciclului cardiac, provocând disfuncție sistolică LV/RV și/sau disfuncție diastolică cunoscută și sub denumirea de HF cu fracție de ejecție conservată (Figura 1). Alte afecțiuni precum boala cardiacă valvulară, hipertensiunea pulmonară (PH), disfuncția mecanică a valvei și insuficiența respiratorie pot precipita sau agrava dezvoltarea LoHF .
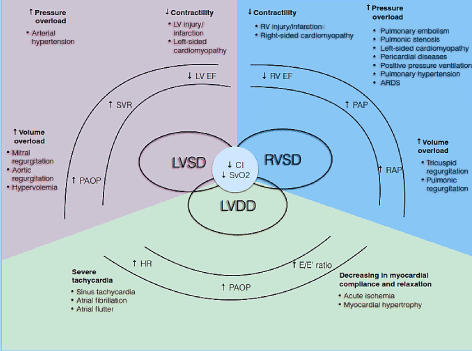
Figura 1. Mecanisme fiziopatologice ale insuficienței cardiace cu ieșire redusă
cauze comune și tipice; sunt incluse simptomele LoHF. Mecanismele patofiziologice majore ale LoHF sunt disfuncția ventriculară: Disfuncție sistolică și / sau diastolică LV și disfuncție sistolică RV, toate având caracteristici patologice comune ale indicelui cardiac redus (CI) și saturației venoase mixte reduse de oxigen (SvO2). Disfuncția sistolică LV și RV rezultă din supraîncărcarea crescută a presiunii, supraîncărcarea crescută a volumului și scăderea contractilității, în timp ce disfuncția diastolică LV rezultă din tahicardie severă și scăderea conformității și relaxării miocardice. Adaptat de la Lomivorotov și colab. 2017, p. 293
LV disfuncția ystolică
disfuncția sistolică a ventriculului stâng (LV) (sau fracția de ejecție LV deprimată ) este cel mai frecvent mecanism fiziopatologic observat la pacienții cu LoHF. Variabilele de circulație care afectează funcția sistolică LV sunt preîncărcarea, după încărcare și contractilitatea . În general, disfuncția sistolică LV este o consecință a pierderii sau reducerii cardiomiocitelor funcționale rezultate din necroza datorată circulației coronariene afectate și ischemiei, leziunilor de reperfuzie sau fenomenului natural mai puțin înțeles al apoptozei cardiomiocitelor . Pierderea cardiomiocitelor funcționale poate fi tranzitorie, așa cum se vede în timpul asomării miocardice definite ca un miocard viabil salvat prin reperfuzie coronariană, care prezintă disfuncție post-ischemică prelungită după reperfuzie . Pierderea cardiomiocitelor funcționale poate fi, de asemenea, refractară la inversare în condiții precum infecția; tahicardie; boala valvulară; tulburări metabolice precum acidoza, hipoglicemia, hipocalcemia; expunerea la toxine cardiace și substanțe chimice din mediu; cardiomiopatie dilatativă idiopatică (DCM); și tulburări genetice, cum ar fi DCM familial, cardiomiopatie hipertrofică și distrofii musculare . Răspunsul cardiac afectat la preîncărcare determină o scădere dramatică a CO și a furnizării de oxigen către alte organe cheie ale corpului, presiune atrială crescută, presiune capilară și edem pulmonar cardiogen. Deși modificările compensatorii ale LV se adaptează la presiunea arterială sistemică relativ ridicată, creșterea semnificativă a postîncărcării poate induce disfuncția sistolică a LV .
disfuncție diastolică LV
deși mai puțin frecventă, LoHF se poate dezvolta la pacienții cu disfuncție diastolică LV cu FEVS conservat. Condiția rezultă din incapacitatea camerei ventriculare de a se umple cu un volum adecvat de sânge, în ciuda preîncărcării normale, care se prezintă ca disfuncție diastolică . Condițiile subiacente, cum ar fi tahicardia severă, scăderea conformității miocardice sau relaxarea ventriculară anormală afectează relaxarea și umplerea LV în timpul fazei diastolice a ciclului cardiac. La nivelul cardiomiocitelor, aceste afecțiuni sunt asociate cu îndepărtarea calciului din citosol și homeostazia calciului, adecvarea detașării punții încrucișate și tulburarea elementului citoscheletal funcțional intrinsec . Detașarea podului transversal poate contribui la întârzierea timpului de relaxare izovolumic, ceea ce duce la scăderea volumului cursei LV, în special la HR mai mare . Relaxarea LV depinde, de asemenea, de recaptarea ionului de calciu reticular sarcoplasmic și de semnalizarea oxidului nitric, care facilitează, de asemenea, detașarea punții transversale. Deoarece procesul de detașare a podului transversal consumă energie, poate provoca un deficit de energie miocardică și, prin urmare, poate încetini relaxarea miocardică LV .
în ciuda faptului că disfuncția diastolică este un fenomen răspândit observat la până la 70% dintre pacienții cardiaci postoperatori , disfuncția diastolică singură este insuficientă pentru a explica dezvoltarea HF acută. În stabilirea altor afecțiuni clinice, cum ar fi fibrilația atrială (AF), circulația coronariană afectată și hipertensiunea arterială, disfuncția diastolică poate duce la starea decompensată și, prin urmare, se crede că este un semn precoce al ischemiei miocardice . Relația dinamică dintre funcțiile diastolice și sistolice ale vs contribuie, de asemenea, la disfuncția diastolică la pacienții cu LoHF. Stimularea catecolaminei inotrope afectează atât diastolul, cât și sistolul și poate spori disfuncția diastolică. LVEF deprimat duce la o creștere a volumului sistolic final și prelungește faza diastolică a ciclului cardiac .
disfuncția RV
în LoHF, în special după intervenția chirurgicală a arterei coronare, mecanismele patofiziologice principale ale disfuncției RV includ preîncărcarea crescută, postîncărcarea crescută, perfuzia arterei coronare drepte afectată și contractilitatea scăzută . Spre deosebire de artera coronară stângă, perfuzia arterei coronare drepte apare atât în timpul diastolului, cât și al sistolului. Prezența PH-ului determină o creștere a presiunii RV care duce la scăderea perfuziei arterei coronare drepte, ceea ce explică importanța asigurării circulației coronare stângi și drepte optime . La pacienții care au suferit o intervenție chirurgicală coronariană, disfuncția RV se poate dezvolta ca urmare a unei combinații de mecanisme. Ischemia RV perioperatorie și infarctul sunt cauzele majore ale contractilității RV afectate. Regurgitarea tricuspidă sau pulmonică re cauze comune ale preîncărcării volumului crescut în timp ce boala valvulară stângă sau cardiomiopatia, pH-ul sau embolia pulmonară (PE), sindromul de detresă respiratorie acută și ventilația cu presiune pozitivă ridicată sunt cauze comune ale supraîncărcării presiunii . Deoarece RV permite în mod normal perfuzia de joasă presiune a vasculaturii pulmonare, este foarte sensibilă chiar și la creșteri moderate ale presiunii arterei pulmonare (PAP). Eșecul RV se poate dezvolta în stabilirea PH-ului sau a contractilității afectate asociată cu o progresie rapidă a dilatării RV care duce la creșterea presiunii RV diastolice finale . Aceste modificări fiziologice pot determina deplasarea septului inter-ventricular către o cameră LV deja subumplută și, în consecință, pot determina o reducere a preîncărcării LV și o scădere a CO .
factorii de risc
factorii de risc pentru LoHF rămân o zonă sub-cercetată. Cu toate acestea, puține date disponibile din studiile clinice privind HF și de la pacienții cu LCO postoperator oferă informații valoroase despre factorii de risc și predictorii LoHF. În analiza a 452 de pacienți spitalizați cu HF decompensată și debit cardiac scăzut, factorii de risc semnificativi pentru LoHF au fost Boala Chagas (risc relativ : 3,66), fracția de ejecție deprimată (RR: 2,41), hiponatremia (RR: 1,62) și disfuncția renală (RR: 1,92) . Factorii de risc pentru lohf postoperator includ afectarea funcției LV (< 50%), CABG la pompă, chirurgie de urgență sau bypass cardiopulmonar (CPB), revascularizare incompletă, vârsta> 65 de ani și o prezență combinată a diabetului zaharat și a disfuncției renale preoperatorii . În plus față de factorii de risc pentru pacient și operație, predictorii biochimici ai LoHF la pacienții postoperatori sunt nivelurile scăzute ale hemoglobinei , numărul total de limfocite < 2000 celule/unktil și nivelurile preoperatorii ale peptidelor natriuretice serice . În ultimele două decenii, au existat schimbări în tendințele anumitor factori de risc recunoscuți. Factori precum hipertensiunea arterială, sexul feminin, boala triplă a vaselor și boala principală stângă nu mai sunt semnificative statistic, în timp ce riscul asociat cu fracția de ejecție preoperatorie deprimată s-a dublat .
diagnostic
nu există orientări consensuale sau criterii de diagnostic dovedite pentru pacienții cu LoHF. În plus, semnele și simptomele clinice sunt nespecifice. În absența unor orientări standardizate, diagnosticul se bazează de obicei pe colectarea acceptată a aberațiilor hemodinamice și fiziologice utile pentru creșterea suspiciunii clinice de LoHF . Diagnosticul de LoHF singur nu este adesea suficient. De asemenea, trebuie stabilită cauza stării de ieșire redusă. În unele cauze ale stării de ieșire scăzută, cum ar fi PE sau MI, tratarea cauzei care stă la baza este cel mai important aspect și, prin urmare, este imperativ să se facă diagnosticul. Deoarece pacienții cu LoHF sunt adesea instabili, este, de asemenea, obișnuit ca evaluarea clinică, diagnosticul și tratamentul să apară simultan mai mult în setările de îngrijire acută .
semne și simptome
debitul cardiac scăzut, deoarece caracteristica prezentă a HF decompensată acută este mai puțin frecventă, afectând doar 8, 9 până la 9, 6% dintre pacienții HF spitalizați . LoHF poate împărtăși multe caracteristici clinice cu CHF, dar există diferențe notabile care pot sprijini sau ghida deciziile de diagnostic ulterioare. Oboseala excesivă și intoleranța crescută la efort sunt semne inițiale importante observate de pacienții cu LoHF chiar înainte de diagnostic . În plus, pacienții cu LoHF prezintă frecvent agitație, confuzie și/sau niveluri reduse de conștiență; periferice reci/vasoconstrictate sau timp de reumplere capilară întârziat; hipotensiune arterială; tahicardie sau bradicardie; puls filiform; presiune venoasă jugulară crescută; respirație și hipoxemie; și oligurie/anurie . Aceste semne și simptome pot diferi între perfuzie scăzută și congestie la pacienții cu HF (Tabelul 2).
Tabelul 2. Simptome și semne de perfuzie scăzută vs. congestion in heart failure patients
|
Low Perfusion |
Congestion |
|
Fatigue |
Fatigue |
|
Confusion |
Tachycardia |
|
Agitation |
Raised jugular venous pressure |
|
Low level of consciousness |
Breathlessness and hypoxemia |
|
Cold peripheries |
Pulmonary oedema |
|
Delayed capillary refill time |
Lowe extremities oedema |
|
Thready pulse |
Hepatic congestion |
|
Hypotension |
|
|
Tachycardia |
|
|
Oliguria or anuria |
|
|
Metabolic acidosis |
|
|
SvO2 < 65% |
Initial clinical evaluation
History and physical examination: Orientările ESC din 2016 privind diagnosticul și gestionarea HF subliniază importanța obținerii istoricului detaliat al pacientului și a examinării fizice la toți pacienții suspectați de HF . Istoricul detaliat de la pacient sau rudă și prieteni dacă pacientul este prea rău, ar trebui să se concentreze pe obținerea de informații despre simptome, afecțiuni cardiace și extra-cardiace anterioare și actuale capabile să precipite sau să agraveze HF, expunerea la factorii de risc ai HF sau a stării de ieșire scăzută și istoricul medicamentelor pentru afecțiuni medicale anterioare și actuale . În plus față de istoricul pacientului, examenul fizic este recomandat tuturor pacienților cu LoHF pentru a evalua indicatorii clinici pentru hemodinamică, perfuzie periferică, congestie, etiologie subiacentă și patologie valvulară. Parametrii hemodinamici de interes includ tensiunea arterială, HR și ritmul cardiac, ritmul galopului, saturația oxigenului și ritmul respirator . Testele pentru perfuzia periferică trebuie să includă nivelurile de conștiență, temperatura periferică a pielii/centrală, timpul de reumplere capilară și cantitatea de urină. Testele pentru congestie includ creșterea presiunii venoase jugulare, edem periferic/pulmonar, hepatomegalie, ascită și revărsări pleurale. Testele pentru etiologia subiacentă ar trebui să includă examinarea cardiovasculară și sunetul inimii și murmurele. În cele din urmă, dovezile pentru disfuncția valvulară ar trebui să includă frecarea pericardică și dovezile de efuziune pericardică cu sau fără tamponadă cardiacă .combinația dintre istoricul pacientului și examenul fizic s-a dovedit neprețuită în evaluarea stării hemodinamice și recunoașterea LoHF . În 1976, Forrester și colab. a efectuat examinarea fizică a pacienților cu infarct miocardic acut și a identificat patru profiluri hemodinamice (A, B, L și C) așa cum este ilustrat în Figura 2. Profilele hemodinamice se bazează pe prezența sau absența congestiei pulmonare (presiunea capilară pulmonară > sau 18 mmHg) și adecvarea perfuziei (CI > 2,2 L/min/m2). Profilul A nu reprezintă congestie/hipoperfuzie; profilul B congestie fără hipoperfuzie; profilul C hipoperfuzie fără congestie; și profilul L congestie și hipoperfuzie . Pacienții cu LoHF se încadrează în profilurile L și C (hipoperfuzia congestiei de la nohria și colab. demonstrarea faptului că profilul L și C au o IÎ medie de 1,6 L/min/m2 și, respectiv, 1,9 l/min/m2.
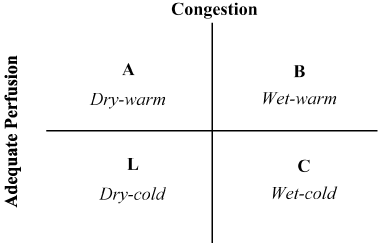
Figura 2. Prezentarea schematică a profilului clinic al insuficienței cardiace decompensate acute
congestia este evaluată prin prezența ortopneei, distensiei venoase jugulare, raluri pulmonare, refluxului hepatojugular, ascitei, edemului periferic, refluxului abdominal și Valsalva pătrată. Perfuzia scăzută a fost evaluată prin prezența unei presiuni pulsate înguste, modificări ale pulsului, extremități reci, poate somnoros, scăderea nivelului seric de sodiu și agravarea funcției renale. Adaptat din Nohria și colab.
electrocardiogramă (ECG): atât ghidurile AHA, cât și ESC privind HF recomandă ca electrocardiograma (ECG) să fie efectuată cât mai curând posibil la toți pacienții suspectați de HF. ECG poate demonstra o varietate de anomalii și este foarte puțin probabil să fie normal la pacienții cu HF. De asemenea, poate furniza dovezi ale unei etiologii subiacente a disfuncției cardiace, inclusiv bradicardie, bloc atrioventricular, tahicardie sinusală, tahiaritmie atrială sau ventriculară, ischemie, hipertrofie LV și complexe de joasă tensiune .
teste de laborator de bază: ghidurile AHA și ESC HF recomandă, de asemenea, teste de laborator de bază în evaluarea clinică inițială pentru a sprijini diagnosticul de HF sau a cauzei stării de ieșire redusă. Testele de sânge trebuie efectuate la toți pacienții suspectați de HF. Hemoglobina (Hb > 10 g/dL) indică o livrare optimă de oxigen în țesuturi), anemia cronică este frecventă în HF cronică și creșterea semnificativă a globulelor albe din sânge ridică suspiciunea de diagnostic alternativ. Teste pentru electrolitul seric pentru a determina nivelurile de potasiu, magneziu și calciu. Teste de uree și creatinină pentru evaluarea hipoperfuziei renale și a disfuncției frecvente în HF. Teste pentru afectarea funcției hepatice, care sugerează afectarea RV și / sau congestia hepatică. Test de glucoză pentru evaluarea hipoglicemiei care poate afecta funcția cardiacă. Teste ale funcției tiroidiene pentru hipo – sau hiper-tiroidism care poate provoca infarct miocardic intrinsec. În cele din urmă, testele pentru peptidele natriuretice serice ale căror niveluri ridicate indică creșterea stresului peretelui ventricular, dar care nu detectează modificări abrupte ale presiunilor de umplere ventriculară din cauza timpului de înjumătățire lung .
teste imagistice cardiace: imagistica cardiacă joacă un rol central în diagnosticul HF, precum și în monitorizarea și ghidarea terapiei. Ecocardiografia este modalitatea preferată din motive de precizie, disponibilitate, siguranță și rentabilitate . Acesta poate fi completat de alte modalități imagistice selectate pe baza capacității de a răspunde la întrebări clinice specifice, luând în considerare contraindicațiile și riscurile .
ecocardiografie: ecocardiografia este recomandată tuturor pacienților suspectați datorită capacității sale de a confirma sau exclude diagnosticul clinic al LoHF, de a evalua SV și variațiile sale și de a determina cauza stării de ieșire scăzută . Ecocardiografia transtoracică trebuie efectuată cât mai curând posibil după diagnosticul clinic al debitului cardiac scăzut. Nu numai că măsoară amploarea disfuncției sistolice și diastolice, ci oferă și informații valoroase despre morfologia ventriculară, disfuncția valvulară, boala miocardică și pericardică și anomaliile regionale ale mișcării peretelui . Ecocardiografia evaluează funcția sistolică prin măsurarea LEVF, unde > 45-50% este considerată normală. Pe de altă parte, funcția diastolică este evaluată folosind modele de flux mitral, fluxul venei pulmonare și Doppler tisular la inelul mitral, în timp ce CO și SV sunt evaluate folosind principiul Doppler. Presiunea arterei pulmonare (PAP) poate fi estimată prin măsurarea vitezei jetului de regurgitare. PAP ridicat în prezența RV dilatat cu aplatizare septală sau înclinare în LV, indicând o creștere acută a presiunii RV care crește suspiciunea clinică a PE ca cauză a stării de ieșire scăzute .
radiografia toracică: radiografia toracică poate fi luată în considerare la pacienții suspectați de LoHF. Indicatorii importanți care ar trebui luați în considerare pentru evaluare includ inima mărită care indică cardiomegalie sau hipertrofie LV; congestie venoasă pulmonară care indică o presiune crescută de umplere a LV; și revărsat pleural care indică o presiune crescută a LV, embolie pulmonară sau chirurgie post-cardiacă( .
angiografia coronariană: indicațiile pentru angiografia coronariană la pacienții cu LoHF trebuie să fie în concordanță cu recomandarea ghidurilor consensuale relevante pentru HF . La pacienții cu HF care prezintă dureri toracice și semne de infarct miocardic cu supradenivelare de St (STEMI) pe ECG, revascularizarea prin intervenție coronariană percutanată primară trebuie efectuată cât mai curând posibil. Angiografia coronariană trebuie, de asemenea, luată în considerare la pacienții cu stop cardiac post-cardiac de etiologie ischemică, atunci când există dovezi de HF și la pacienții care s-au recuperat din starea de ieșire scăzută atunci când cauza nu a fost determinată .
managementul clinic
prezența LoHF reprezintă o afecțiune cu risc foarte ridicat care necesită tratament prompt, dar nu are orientări standardizate pentru managementul clinic . În consecință, clinicienii consideră în mod normal fiziopatologia individuală pentru a selecta cea mai potrivită strategie de tratament . La pacienții cu lohf acut, ghidurile ESC HF din 2016 recomandă utilizarea profilurilor hemodinamice (bazate pe prezența sau absența congestiei și adecvarea perfuziei) pentru a ghida managementul clinic . Pentru pacienții cu LoHF din Profilul L (fără congestie, dar hipoperfuzat) și profilul C (atât congestie, cât și hipoperfuzat) care se află în stare de decompensare acută, obiectivele tratamentului de urgență pot include resuscitarea pacienților, restabilirea oxigenării, îmbunătățirea perfuziei organelor și optimizarea hemodinamică (volumul accidentului vascular cerebral și CO) și rezolvarea simptomelor. Alte obiective ulterioare includ monitorizarea optimă și stabilirea cauzei subiacente a debitului cardiac scăzut și tratarea cauzei dacă este reversibilă . În prezent, țintele terapeutice disponibile pentru LoHF sunt optimizarea oxigenării țesuturilor, stabilizarea circulației și tratarea cauzelor reversibile ale stării de ieșire redusă (Figura 3).
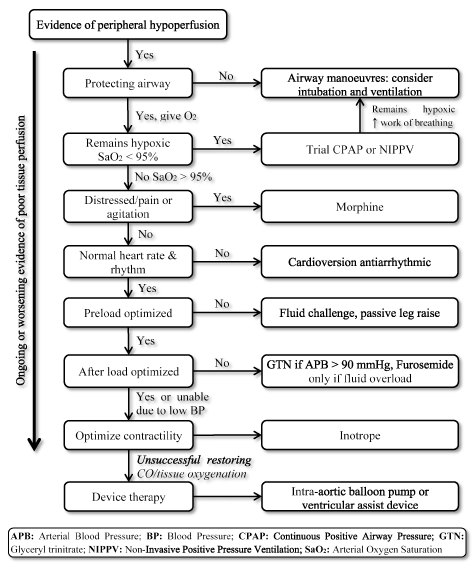
Figura 3. Algoritmul de tratament pentru insuficiența cardiacă cu ieșire redusă
tratamentul obiectivelor LoHF îmbunătățirea oxigenării țesuturilor și stabilizarea circulației pe baza simptomului continuu sau agravant al perfuziei tisulare. Tratamentul începe prin îmbunătățirea ventilației folosind furnizarea de oxigen cu debit mare, presiune continuă pozitivă a căilor respiratorii (CPAP) sau ventilație cu presiune pozitivă neinvazivă (NIPPV). Dacă nu reușește, cardioversia sau medicamentele antiaritmice sunt administrate pentru a normaliza ritmul cardiac, provocarea fluidelor pentru a optimiza preîncărcarea și/sau vasodilatatoarele și inotropele pentru a manipula și a îmbunătăți contractilitatea. Dacă ventilația anterioară și medicația nu reușesc să restabilească debitul cardiac și/sau oxigenarea țesuturilor, terapia cu dispozitive care utilizează pompă cu balon intra-aortic sau dispozitive de asistență ventriculară poate fi considerată
Optimizați oxigenarea țesuturilor (strategii ventilatorii)
managementul clinic al pacienților cu LoHF începe adesea cu evaluarea căilor respiratorii, a respirației și a circulației pentru dovezi ale hipoperfuziei periferice. Strategiile ventilatorului, cum ar fi căile respiratorii orofaringiene sau nazofaringiene, sunt adjuvanți obișnuiți utilizați pentru restabilirea sau menținerea permeabilității căilor respiratorii la pacienții cu LoHF cu niveluri scăzute de conștiență datorită scăderii perfuziei cerebrale. Dacă pacientul rămâne cu căile respiratorii compromise, trebuie luată în considerare o intubație endotraheală suplimentară . Dacă pacienții continuă să rămână hipoxici (SaO2 < 95%), poate fi luată în considerare maximizarea furnizării de oxigen folosind oxigen cu debit mare, presiune pozitivă continuă a căilor respiratorii (CPAP) sau ventilație cu presiune pozitivă neinvazivă (NIPPV). La pacienții fără ameliorare, se poate lua în considerare intubația sau ventilația .
stabilizarea circulației
debitul Cardiac (CO) este o funcție a HR și SV. La rândul său, SV depinde de patru variabile de circulație – ritmul cardiac, preîncărcarea, contractilitatea și postîncărcarea. Optimizarea tuturor acestor variabile va îmbunătăți CO la pacienții cu LoHF . În cadrul clinic, strategiile de creștere a CO depind de cauza principală și de variabila de circulație afectată . Intervențiile clinice includ ajustarea volumului, suportul farmacologic și terapia dispozitivului.
ritm cardiac: Ca parte a răspunsului fiziologic al organismului, creșterea HR crește CO. HR prea rapid sau lent are un efect dăunător asupra CO. La pacienții cu lohf cu tahicardie (HR în repaus prea rapid > 100 bpm) care sunt tulburați, neliniștiți și dispnoeici, morfina poate fi administrată pentru ameliorarea dispneei, durerii și agitației, precum și este un venodilatator ușor pentru reducerea sarcinii ulterioare, în special la pacienții cu CPAP sau NIPPV . Dacă HR < 40 bpm cu dovezi de compromis hemodinamic și/sau co afectat, trebuie efectuate medicamente care cresc HR (atropină și anticolinergice ) sau intervenții precum ritmul transcutanat/transvenos. Cardioversia electrică urgentă trebuie luată în considerare în lohf selectat cu tahicardie ventriculară/supraventriculară sau AF rapidă cu dovezi de compromis cardiovascular .
Optimizați preîncărcarea (ajustări de volum): măsurarea preîncărcării este esențială pentru optimizarea acesteia. Se recomandă la pacienții cu dovezi clinice de perfuzie periferică afectată. Trebuie efectuată o provocare fluidă pentru a evalua capacitatea de reacție la preîncărcare. Infuzarea rapidă a 250 ml lichid (cristaloid sau coloid) timp de peste cinci minute și evaluarea obiectivă a efectului asupra SV. Dacă efectul este o creștere sau o scădere > 10%, pacientul trebuie să continue să primească bolusuri lichide pentru a optimiza preîncărcarea până când nu mai răspunde la fluide . Pentru pacienții cu semne de congestie și edem pulmonar care nu necesită bolus lichid, se poate face o ridicare pasivă a piciorului – ridicarea piciorului pacientului la 45 de grade pentru a exclude necesitatea provocării fluidului. Dacă răspunsul este favorabil, se poate da o provocare reală fluidă .
manipularea postîncărcării (suport farmacologic): Postîncărcarea este rezistența împotriva căreia ventriculul ejectează sânge, uneori estimată ca SVR. Postsarcina trebuie redusă la pacienții cu LoHF care prezintă un postsarcină mare, CO scăzut, dovezi de perfuzie periferică slabă și edem pulmonar. Suportul farmacologic care utilizează vasodilatatoare trebuie administrat pacienților cu LOHF cu tensiune arterială sistolică 110 mmHg. La pacienții cu BP sistolică< 90 mmHG și presiunea arterială medie< 65 mmHg, vasodilatatoarele nu sunt recomandate din cauza riscului de hipotensiune arterială, care poate complica perfuzia organelor. La acești pacienți, inotropii sunt recomandați ca primă linie de tratament .
îmbunătățirea contractilității (suport farmacologic): Dacă pacientul persistă cu dovezi de hipoperfuzie tisulară sau eliberare redusă de oxigen în ciuda intervențiilor pentru ritmul cardiac, preîncărcare și postîncărcare, trebuie luat în considerare tratamentul pentru îmbunătățirea contractilității. Între timp, optimizarea furnizării de oxigen ar trebui continuată pentru a viza hemoglobina 10 g/dl și pentru a asigura saturații optime de oxigen (SaO2). Factorii care afectează negativ contractilitatea miocardică sunt hiperkaliemia, hipomagneziemia, hipocalcemia, acidoza severă, hipoxia și hipoglicemia, care trebuie corectate. Inotropele sunt recomandate pentru a îmbunătăți contractilitatea și ulterior CO la pacienții cu LOHF cu BP scăzut și / sau CI scăzut în prezența semnelor de perfuzie periferică slabă sau congestie . Cu toate acestea, suportul farmacologic care utilizează dobutamină (un inotrop) trebuie utilizat cu precauție la pacienții care au tahicardie sau AF, deoarece crește conducerea nodului AV și poate precipita ritmuri ventriculare rapide . Pe de altă parte, levosimendan este recomandat la pacienții cu LoHF cu ischemie miocardică acută sau chirurgie post cardiacă, deoarece nu crește cererea miocardică de oxigen . Efectul pe termen lung al inotropilor ar putea fi dăunător și, prin urmare, utilizarea lor ar trebui oprită odată ce stabilitatea a fost atinsă. Vasopresoarele nu ar trebui să fie medicamentul de primă linie în stările cu ieșire redusă, deoarece cresc SVR și, ulterior, afectează CO. Cu toate acestea, se recomandă o terapie duală a vasopresoarelor și a inotropului la pacienții care au sepsis ca cauză principală a stării de ieșire scăzută .
terapia cu dispozitive: terapia cu dispozitive trebuie luată în considerare la pacienții cu LoHF atunci când terapiile medicale optime nu au reușit să restabilească Co și oxigenarea țesuturilor. Terapiile obișnuite ale dispozitivului includ pompa cu balon intra-aortic (IABP) și dispozitivul de asistență ventriculară (VAD). Utilizarea IABP este frecventă la pacienții cu LoHF cu boală cardiacă ischemică, intervenție pre sau post-percutanată sau chirurgie post-cardiacă. IABP cuprinde un balon introdus în aorta prin artera femurală. Balonul se umflă în timpul diastolului și se dezumflă în timpul sistolului pentru a crește BP diastolic și, în consecință, perfuzia coronariană și reduce sarcina ulterioară, crescând astfel CO . Pe de altă parte, utilizarea VAD este mai puțin frecventă. Poate fi utilizat numai în centre specializate. Este utilizat în mod obișnuit ca punte către transplantul cardiac la pacienții cu o calitate a vieții favorabilă sau către recuperare la pacienții cu miocardită acută .
tratarea cauzelor subiacente
unele cauze ale stării de ieșire scăzută la pacienții cu LoHF pot fi inversate cu terapii specifice. Cauzele reversibile trebuie identificate devreme în timpul evaluării clinice inițiale. Aceste cauze includ infarct miocardic acut, tamponadă cardiacă, pneumotorax de tensiune, embolie pulmonară și insuficiență acută a valvei . (Tabelul 3).
Meta-analiza diagnosticului și managementului clinic
baza diagnosticului clinic al LoHF a fost dovada ecocardiografică a disfuncției sistolice LV/RV și / sau a disfuncției diastolice LV însoțită de dovezi ale CO și SvO2 reduse . Profilele hemodinamice bazate pe măsuri de congestie și perfuzie au fost utilizate pentru a clasifica pacienții cu HF acut în patru profiluri: uscat-cald (a), umed-cald (B), uscat-rece (L) și umed-rece (C) și util în identificarea pacienților cu LoHF . Pacienții cu LoHF au fost clasificați în profiluri (L) și (C) pe baza prezenței/absenței congestiei și/sau inadecvării perfuziei periferice . Aceste două profiluri hemodinamice au constituit baza pentru selectarea pacienților cu LoHF în studiile clinice, precum și pentru a oferi o evaluare simplă a patului pentru a ajuta la clasificarea pacienților în momentul prezentării și pentru a ghida selecția terapiilor inițiale . Scopul prezentei meta-analize este de a agrega dovezi publicate privind caracteristicile comune de diagnostic și rezultatele tratamentului pentru pacienții cu LoHF.
strategia de căutare
trei baze de date online majore (PubMed, EMBASE și Cochrane) au fost căutate sistematic de la începuturile până în decembrie 2018 pentru studii care investighează diagnosticul și managementul clinic al LoHF. Pentru a evita ignorarea studiilor care nu au menționat LoHF în titlu sau rezumat, au fost incluse primele 200 de articole clasate în funcție de relevanță preluate cu o căutare Google Scholar cu text complet. Nu s-au aplicat restricții privind timpul de publicare sau limba. Studii suplimentare au fost identificate printr-o căutare manuală a listei de referințe din studiile incluse, precum și din articolele de revizuire relevante, care au fost apoi supuse criteriilor de includere. Criteriile de căutare au inclus populația de interes (pacienți cu LoHF sau LCOS), teste de diagnostic de interes (ecocardiografie și profiluri hemodinamice) și intervenția de interes (strategii de ventilator, ajustarea volumului, suport farmacologic și terapie cu dispozitive). Studiile au fost incluse dacă au îndeplinit următoarele criterii: (a) au inclus pacienți cu LoHF; (b) diagnosticat folosind ecocardiografie și profiluri hemodinamice; (c) pacienții tratați pentru stabilizare hemodinamică; și (d) rezultatele tratamentului raportate. În cazul studiilor care raportează date duplicate, a fost inclus doar studiul care a furnizat cel mai mare număr de pacienți. Rezumatele conferinței, rapoartele de caz și articolele de revizuire au fost excluse.
selecția studiului
Figura 4 ilustrează procesul de căutare și screening utilizat pentru a include studii eligibile. Doi recenzori au analizat în mod independent toate titlurile și rezumatele preluate din Căutarea sistematică online. Rezumate care au inclus populația, intervenția și rezultatele de interes au fost incluse pentru căutarea în text complet. Ulterior, cei doi recenzori au revizuit, de asemenea, în mod independent articole cu text integral în raport cu criteriile de includere. În caz de discrepanță, a fost rezolvată prin discuții și consens.

Figura 4. Diagrama de flux a procesului de căutare și includere a literaturii
colectarea datelor
doi recenzori au extras în mod independent date din studiile incluse și orice discrepanță a fost rezolvată prin consens. Principalele date extrase au fost datele profilului ecocardiografic și hemodinamic, iar tratamentul utilizat și rezultatul tratamentului asupra hemodinamicii (indicele cardiac, PCWP) și mortalității. În plus față de aceste date principale, cei doi recenzori au extras, de asemenea, date privind caracteristicile studiului, caracteristicile pacienților și durata urmăririi (Tabelul 4).
analiza statistică
rezultatele de interes raportate în mai multe studii sunt indicele cardiac, PCWP și mortalitatea. Pentru fiecare rezultat, s-au extras statistici sumare (media deviației standard a numărului de procente) înainte și după intervenție sau diferența dintre momentul inițial și după tratament. Aceste statistici sumare au fost extrase separat pentru grupurile de tratament și de control/placebo. Rezultatele diagnosticului și efectele tratamentului au fost măsurate prin diferența de mijloace înainte și după intervenție și au asociat un interval de încredere de 95%. Parcelele forestiere au fost utilizate pentru a examina vizual eterogenitatea (I2) în cadrul studiilor. Efectul combinat de diagnostic și tratament și intervalul de încredere asociat de 95% au fost estimate utilizând efectul fix (I2 < 49%) sau modelul cu efect aleatoriu (I2 > 50%). Valoarea P> 0,05 a fost considerată semnificativă statistic.
rezultate
caracteristicile studiului
douăsprezece (12) studii randomizate controlate (TCR) au îndeplinit criteriile de includere. Șapte (7) studii au înrolat pacienți cu LoHF, iar restul de cinci (5) pacienți cu HF înrolați care au suferit intervenții chirurgicale cardiace cu debit cardiac scăzut. Majoritatea studiilor clinice publicate (10) au investigat medicația comparând efectul diferitelor tipuri de inotropi asupra hemodinamicii și prevenirii decesului: numai dobutamină , dobutamină și dopamină ; levosimendan și dobutamină și levosimendan și placebo . Dintre cele două studii clinice rămase, fiecare vasodilatator investigat (nitroprusid) și placebo și terapia cu dispozitive (IABP) și inotrop (levosimendan) singur sau în asociere cu IAPB . În total, cele 12 studii clinice au înrolat 3738 pacienți, vârsta medie 64 ani (Interval = 55-74 ani), majoritatea fiind bărbați (78%).
sinteza rezultatelor
datele de diagnostic privind LoHF au fost inconsistente. De-a lungul celor douăsprezece studii clinice, nu a apărut o definiție comună a LoHF care ar fi fost utilă pentru a ghida diagnosticul. Criteriile hemodinamice utilizate pentru includerea pacienților în studii au inclus IÎ < 2 , 0 L/min/m2, IÎ < 2, 2 L/min/m2 sau IÎ < 2, 5 L/min/m2 și PCWP > 15 mmHg sau 18 mmHg de la 0CT . Definiția a variat, de asemenea, între studii – starea postoperatorie cu hipotensiune arterială (BP sistolică < 90 mmHg pentru > 30 minute) sau necesitatea suportului inotropic pentru menținerea BP sistolică > 90 mmHg și hipoperfuzia organelor finale (periferice reci, ieșire de urină < 30 ml/oră) . Șocul cardiogen a fost descris ca un sindrom complex care implică o cascadă de disfuncție acută a VS, scăderea CO, hipotensiune arterială și hipoperfuzie tisulară .
figurile 5 și 6 prezintă parcele forestiere pentru media standardizată a indicelui cardiac la momentul inițial și, respectiv, după terapia cu inotrop sau vasodilatator. Indicele cardiac inițial a crescut de la o medie de 1,93 (IÎ 95%: 1,91-1,95) la o medie post-tratament de 2,82 (IÎ 95%: 2,80-2,84). Figura 7 prezintă un teren forestier pentru diferența medie standard (SMD) a indicelui cardiac după tratamentul cu levosimendan și dobutamină. Levosimendanul atinge un indice cardiac mai mare comparativ cu dobutamina (SMD: 2,82; IÎ 95%: 2,54-3,10). Ca profilactic împotriva LoHF la pacienții postoperatori, perfuzia cu levosimendan după anestezie a obținut un indice cardiac mai mare (2, 57) comparativ cu IABP preoperator (2, 3) sau cu o combinație de levosimendan (2, 4). Figura 8 prezintă o parcelă forestieră a ratei mortalității între levosimendan și placebo. Levosimendanul a avut o rată a mortalității mai mică comparativ cu placebo (raportul Odds : 0,83; IÎ 95%: 0,59-1,18), dar diferența nu a fost semnificativă statistic (p=0,30). În Final, Figura 9 arată în continuare că Levosimendanul are o rată de mortalitate mai mică comparativ cu dobutamina (OR: 0,65; IÎ 95%: 0,39-1.08) but the difference was not statistically significant (p=0.10).
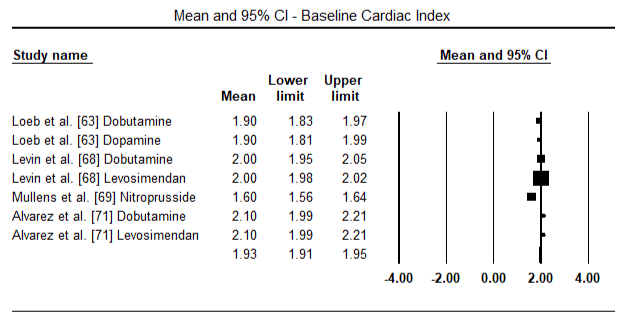
Figure 5. Mean baseline cardiac index
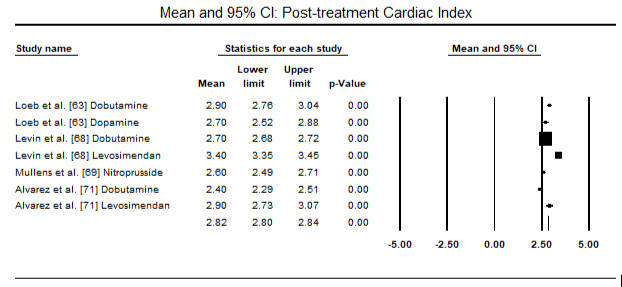
Figure 6. Mean post-treatment cardiac index
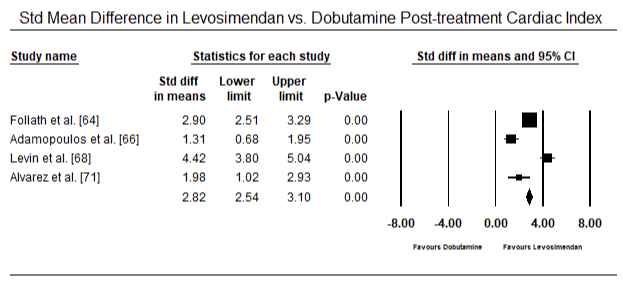
Figure 7. Mean difference in cardiac index between levosimendan and dobutamine
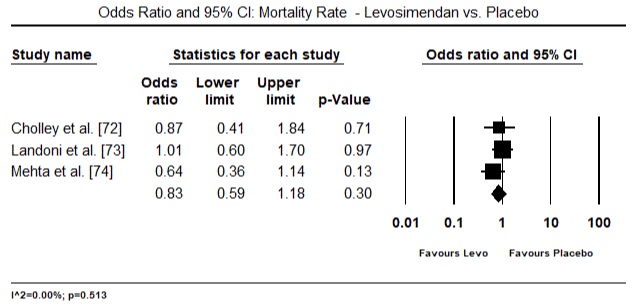
Figure 8. Mortality rate between levosimendan and placebo
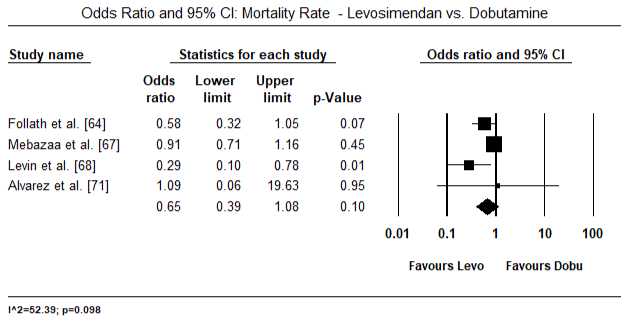
Figure 9. Rata mortalității între levosimendan și dobutamină
Discutarea constatărilor
această revizuire sistematică și meta-analiză au evaluat caracteristicile comune de diagnostic și rezultatele tratamentului terapiei medicale și a dispozitivelor (IABP) la pacienții cu LoHF. Rezultatele indică faptul că pacienții cu LoHF nu au caracteristici de diagnostic larg acceptate sau standardizate. Deși pacienții cu LoHF ar putea prezenta mai multe caracteristici, inclusiv indicele cardiac, PCWP, BP sistolic și SvO2 pentru a sugera sau susține diagnosticul clinic, toate aceste caracteristici au valori limită diferite în cadrul studiilor. Indicele Cardiac, care este cea mai comună caracteristică clinică care demonstrează starea de ieșire scăzută în LoHF, are trei valori limită: < 2,0 l/min/m2 , < 2,2 L/min/m2 sau < 2,5 L/min/m2 . Suportul Inotropic a apărut ca o intervenție foarte frecventă pentru îmbunătățirea perfuziei și normalizarea debitului cardiac la pacienții cu LoHF.
medicamentele inotrope, cum ar fi levosimendan, dobutamină, dopamină, vasodilatator (nitroprussid) și IABP au îmbunătățit semnificativ IÎ între momentul inițial și post-tratament. În ceea ce privește inotropii, levosimendanul este mai eficient în îmbunătățirea stabilității hemodinamice și un profilactic mai bun împotriva morții pe termen scurt (mortalitate de 30 de zile) decât dobutamina. În plus, inotropii pot acționa ca profilactici împotriva dezvoltării lohf postoperator. Pe de altă parte, în timp ce inotropii îmbunătățesc hemodinamica și normalizează debitul cardiac, acestea nu oferă o protecție semnificativ mai bună împotriva mortalității, indiferent de tipul de inotrop utilizat.
rolul inotropilor în tratamentul LoHF a fost susținut de o revizuire anterioară a agenților inotropi și a strategiilor vasodilatatoare pentru tratamentul șocului cardiogen și LCO . Revizuirea a raportat inotropi îmbunătăți hemodinamice, evenimente adverse în LCO post-operatorie și mortalitate redusă. Inotropi mai noi, cum ar fi levosimendan (un sensibilizant de calciu și inodilatator) este un inotrop pozitiv are unele proprietăți vasodilatatoare . De asemenea, poate fi considerat un vasodilatator hepatic selectiv, care poate îmbunătăți fluxul venos portal prin artera hepatică și fluxul venos portal în comparație cu dobutamina care poate îmbunătăți doar fluxul venos portal fără vasodilatația arterei hepatice . Levosimendan, de asemenea, nu crește cererea de oxigen miocardic și a recomandat peste dobutamină la pacienții cu LoHF cu ischemie miocardică acută sau post-chirurgie cardiacă . Pentru lohf postoperator, efectul protector al inotropilor împotriva ratei mortalității pe termen scurt (mortalitate de 30 de zile) rămâne nesemnificativ în comparație cu placebo .
prezenta analiză sistematică și meta-analiză are câteva limitări importante. LoHF poate să apară în secundar bolii cardiace subiacente, cum ar fi infarctul miocardic acut sau postoperator. Majoritatea studiilor au inclus lohf postoperator investigat, cu o prezentare mai mică a LoHF din alte cauze. Majoritatea studiilor s-au concentrat pe doi inotropi (Levosimendan și dobutamină), limitând înțelegerea altor inotropi, precum și a altor terapii, cum ar fi terapiile cu dispozitive. În unele studii, analiza a fost expusă riscului de părtinire a clasificării greșite din cauza unui număr semnificativ de pacienți pierduți din urmărire. Deoarece majoritatea studiilor nu raportează diferența pre-și post-intervenție în pereche cu deviația standard asociată, diferența pre și post-intervenție cu deviația standard, rezultatele pre – și post-intervenție măsoară ca Independente, acest lucru obținând intervale de încredere sider pentru efectul tratamentului cu o abatere standard asociată.
concluzie
insuficiența cardiacă cu ieșire redusă (LoHF) este un sindrom clinic caracterizat prin scăderea debitului cardiac însoțit de hipoperfuzia organului final. Este o formă mai puțin frecventă de insuficiență cardiacă la populația generală, dar predominantă la pacienții cu insuficiență cardiacă postoperatorie. Etiologia sa este eterogenă, constând în diferite afecțiuni care determină starea de ieșire scăzută și chirurgia cardiacă. Principalele mecanisme fiziopatologice sunt disfuncția sistolică și/sau diastolică LV și disfuncția RV cauzată de modificări ale ritmului cardiac, preîncărcare, postîncărcare și/sau contractilitate. Factorii generali de risc pentru LoHF includ boala Chagas, fracția de ejecție deprimată și disfuncția renală, în timp ce la pacienții postoperatori includ afectarea funcției LV, revascularizarea incompletă, vârsta înaintată și prezența diabetului și a disfuncției renale. Diagnosticul nu are orientări standardizate și depinde de colectarea acceptată a aberațiilor hemodinamice și fiziologice, inclusiv condițiile care cauzează starea de ieșire scăzută. Istoricul pacientului și examenul fizic ajută la evaluarea stării hemodinamice și la recunoașterea stării de ieșire scăzută, în timp ce ecocardiografia confirmă disfuncția ventriculară (HF) și debitul cardiac scăzut. Alte teste pentru a sprijini diagnosticul sau pentru a stabili cauza stării de ieșire scăzută includ electrocardiograma și testele de laborator de bază (sânge, electrolit seric, uree și creatinină, test hepatic, funcția tiroidiană și peptide natriuretice serice) și imagistica cardiacă (radiografie toracică sau angiografie coronariană). Tratamentul nu are orientări stabilite, dar depinde de evaluarea fiziopatologiei individuale pentru a selecta cea mai potrivită strategie de tratament. Tratamentul include strategii de ventilator pentru îmbunătățirea ritmului cardiac și a ritmului; ajustarea volumului pentru optimizarea preîncărcării; suport farmacologic (inotropi și vasodilatatoare) pentru manipularea postîncărcării și îmbunătățirea contractilității; și terapia dispozitivului (pompă cu balon intra-aortic sau dispozitiv de asistență ventriculară) atunci când aceste strategii nu restabilesc debitul cardiac. La pacienții selectați, terapii pentru a inversa boala de bază, poate restabili debitul cardiac.
- Inamdar a, Inamdar A (2016) diagnosticul, gestionarea și utilizarea insuficienței cardiace. J Clin Med 5: 62.
- Dassanayaka s, Jones SP (2015) evoluții recente în insuficiența cardiacă. Res Circ 117: e58-63.
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio a, Bohm M, și colab. (2012) orientări pentru diagnosticul și tratamentul insuficienței cardiace acute și cronice 2012: Grupul de lucru pentru diagnosticul și tratamentul insuficienței cardiace Acute și cronice 2012 al Societății Europene de Cardiologie. Dezvoltat în colaborare cu Asociația de insuficiență cardiacă (HFA) a ESC. Eur J Inima Eșua 14: 803-869.
- Yancy CW, Jessup M, Bozkurt B, Butler J, Casey de, și colab. (2013) 2013 Ghid ACCF/aha pentru gestionarea insuficienței cardiace: un raport al Fundației Colegiului American de Cardiologie/American Heart Association Task Force privind orientările Practice. J Am Coll Cardiol 62: e147-239.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, și colab. (2016) 2016 orientări ESC pentru diagnosticul și tratamentul insuficienței cardiace acute și cronice: Grupul de lucru pentru diagnosticul și tratamentul insuficienței cardiace acute și cronice a Societății Europene de Cardiologie (ESC) dezvoltat cu contribuția specială a Asociației insuficienței cardiace (HFA) a ESC. Eur Inima J 37: 2129-2200.
- Masse l, Antonacci M (2005) sindromul debitului cardiac scăzut: identificare și management. Crit Îngrijire Nurs Clin 17: 375-383.
- Poppas a, Runde S (2002) insuficiență cardiacă congestivă. Am J Respir Crit De Îngrijire Med 165: 4-8.
- Nieminen MS, Bohm M, Cowie MR, Drexler H, Filippatos GS și colab. (2005) rezumat executiv al liniilor directoare privind diagnosticul și tratamentul insuficienței cardiace acute: grupul de lucru pentru insuficiența cardiacă acută al Societății Europene de Cardiologie. Eur Inima J 26: 384-416.
- Parr GV, Blackstone EH, Kirklin JW (1975) performanța cardiacă și mortalitatea la începutul intervenției chirurgicale intracardiace la sugari și copii mici. Circulație 51: 867-874.
- Wernovsky G, Wypij D, Jonas RA, Mayer Jr JE, Hanley FL și colab. (1995) curs postoperator și profil hemodinamic după operația de comutare arterială la nou-născuți și sugari: o comparație între bypass cardiopulmonar cu flux redus și stop circulator. Circulație 92: 2226-2235.
- Hogue CW Jr, Sundt t 3rd, Barzilai B, Schectman KB, D 7cvila-Rom VG (2001) complicațiile cardiace și neurologice identifică riscurile de mortalitate atât pentru bărbații, cât și pentru femeile supuse unei intervenții chirurgicale de bypass coronarian. Anesteziologie 95: 1074-1078.
- Rao V, Ivanov J, Weisel RD, Ikonomidis JS, Christakis GT, și colab. (1996) predictori ai sindromului de debit cardiac scăzut după bypass-ul arterei coronare. J Thorac Cardiovasc Surg 112: 38-51.
- Arribas Leal JM, Pascual DA, Tornel PL, Gutierrez F, Garcia-Puente JJ și colab. (2010) Epidemiologie și noi predictori ai sindromului de debit cardiac scăzut după altoirea izolată a arterei coronare. Eur Inima J 31: 68-69.
- s mp, Nogueira JR, Ferraz PE, Figueiredo OJ, Cavalcante WC și colab. (2012) factori de risc pentru sindromul de debit cardiac scăzut după operația de altoire a bypassului arterei coronare. Braz J Cardiovasc Surg 27: 217-223.
- Algarni KD, Maganti M, Yau TM (2011) predictori ai sindromului de ieșire cardiacă scăzută după operația de bypass coronarian izolată: tendințe de peste 20 de ani. Ann Thorac Surg 92: 1678-1684.
- Chandler HK, Kirsch R (2016) Managementul sindromului debitului cardiac scăzut în urma unei intervenții chirurgicale pentru boli cardiace congenitale. Curr Cardiol Apocalipsa 12: 107-111.
- Lomivorotov VV, Efremov SM, Kirov MY, FOMINSKIY EV, Karaskov Am (2017) sindrom de ieșire cardiacă scăzută după intervenția chirurgicală cardiacă. J Cardiothorac Vasc Anestezi31: 291-308.
- Tibby SM., Murdoch IA (2003) monitorizarea funcției cardiace în terapia intensivă. Arch Dis Copil 88: 46-52.
- Carcillo JA, Field AI (2002) parametrii practicii clinice pentru sprijinul hemodinamic al pacienților pediatrici și neonatali în șoc septic. Crit De Îngrijire Med 30: 1365-1378.
- Chiong M, Wang ZV, Pedrozo Z, cao DJ, Troncoso R, și colab. (2011) moartea cardiomiocitelor: mecanisme și implicații translaționale. Moartea celulară& boala 2: e244.
- Tavernarakis n (2007) necroza cardiomiocitelor: mecanisme alternative, intervenții eficiente. Biochimica et Biophysica Acta(BBA) – cercetarea celulelor moleculare 1773: 480-482.Dorn GW (2008) moartea cardiomiocitelor programate apoptotice și non-apoptotice în remodelarea ventriculară. Res Cardiovasc 81: 465-473.
- Richard Conti C (1991) miocardul uluit și hibernant: o scurtă trecere în revistă. Clin Cardiol 14: 708-712.
- ALSADDIQUE AA, Royse CF, Fouda MA, Royse AG (2012) insuficiență cardiacă diastolică după operație cardiacă. În boala coronariană-concepte actuale în epidemiologie, fiziopatologie, diagnostic și tratament 2012. InTech.
- Kass da, Bronzwaer JG, Paulus WJ (2004) ce mecanisme stau la baza disfuncției diastolice în insuficiența cardiacă? Res Circ 94: 1533-1542.
- Borlaug BA, Paulus WJ (2010) insuficiență cardiacă cu fracție de ejecție conservată: fiziopatologie, diagnostic și tratament. Eur Inima J 32: 670-679.
- Ramirez-Correa GA, Murphy AM (2007) este Fosfolambanul sau troponina I „Prima Donna” în lusitropia indusă de lusitropie indusă de lusitropie indusă de adrenergici? Res Circ 101: 326-327. Paulus WJ, Vantrimpont PJ, Shah AM (1994) efectele Acute ale oxidului nitric asupra relaxării ventriculului stâng și distensibilității diastolice la om. Evaluare prin perfuzie cu nitroprusiat de sodiu bicoronar. Circ 89: 2070-2078.
- Lappas DG, Skubas NJ, Lappas GD, Ruocco E, Tambassis E, și colab. (1999) prevalența Abnorrnalităților de umplere diastolică a ventriculului stâng la pacienții chirurgicali cardiace adulți: Un studiu cardiografic ecou intraoperator. Semin Thorac Cardiovasc Surg 11: 125-133.
- Shi Y, Denault AY, Couture P, Butnaru a, Carrier M, și colab. (2006) modele de umplere diastolică biventriculară după operația de bypass coronarian. J Thorac Cardiovasc Surg 131: 1080-1086.
- Bossone e, Bodini BD, Mazza a, Allegra L (2005) hipertensiunea arterială pulmonară: rolul cheie al ecocardiografiei. Piept 127: 1836-1843.
- Zochios V, Jones n (2014) sindromul cardiac drept acut la pacientul bolnav critic. Vas pulmonar cardiac 6: 157-170.
- Fletcher n, Geisen M, Meeran H, Spray D, Cecconi M (2015) experiență clinică inițială cu o sondă de ecocardiografie transesofagiană miniaturizată într-o unitate de terapie intensivă cardiacă. J Cardiothorac Vasc Anesth 29: 582-587.
- Brooks H, Kirk ES, VOKONAS PS, Urschel CW, Sonnenblick EH (1971) performanța ventriculului drept sub stres: relația cu fluxul coronarian drept. J Clin Invest 50: 2176-2183.
- Price LC, Wort SJ, Finney SJ, Marino PS, Brett SJ (2010) disfuncție pulmonară vasculară și ventriculară dreaptă în îngrijirea critică a adulților: Opțiuni actuale și emergente pentru management: o revizuire sistematică a literaturii. Îngrijire Crit 14: R169. Pfisterer m (2003) implicarea ventriculului drept în infarctul miocardic și șocul cardiogen. Lanceta 362: 392-394.
- Ochiai ME, Cardoso JN, Vieira KR, Lima MV, Brancalhao ce, și colab. (2011) predictori ai debitului cardiac scăzut în insuficiența cardiacă severă decompensată. Clinici 66: 239-244.
- Kim DK, Yoo KJ, Hong YS, Chang BC, Kang MS (2007) rezultatul clinic al grefei de bypass coronarian urgent. J Coreeană Med Sci 22: 270-276.
- Maganti MD, Rao V, Borger MA, Ivanov J, David TE (2005) predictori ai sindromului de debit cardiac scăzut după operația izolată a valvei aortice. Circulație 112: I-448.
- Lomivorotov VV, Efremov SM, Boboshko VA, Nikolaev DA, Vedernikov PE, și colab. (2013) evaluarea instrumentelor de screening nutrițional pentru pacienții programați pentru chirurgie cardiacă. Nutriție 29: 436-442.
- hernia Inktivndez-Leiva e, Dennis R, Isaza D, uma Inktiva JP (2013) valorile preoperatorii ale hemoglobinei și peptidei natriuretice de tip B, dar nu și markerii inflamatori, sunt asociate cu morbiditatea postoperatorie în chirurgia cardiacă: un studiu analitic prospectiv de cohortă. J Cardiothorac Surg 8: 170.
- Lomivorotov VV, Efremov SM, Boboshko VA, Leyderman IN, Lomivorotov VN, și colab. (2011) numărul total de limfocite preoperator în sângele periferic ca predictor al rezultatului slab în chirurgia cardiacă adultă. J Cardiothorac Vasc Anesth 25: 975-980.
- Cuthbertson BH, Croal BL, Rae D, Gibson PH, McNeilly JD, și colab. (2009) nivelurile peptidei n-terminale pro-B de tip natriuretic și rezultatul precoce după intervenția chirurgicală cardiacă: un studiu prospectiv de cohortă. Br J Anaesth 103: 647-653.
- Hutfless R, Kazanegra R, Madani M, Bhalla MA, Tulua-Tata A, și colab. (2004) utilitatea peptidei natriuretice de tip B în prezicerea complicațiilor postoperatorii și a rezultatelor la pacienții supuși unei intervenții chirurgicale cardiace. J Am Coll Cardiol 43: 1873-1879.
- Gheorghiade M, Abraham WT, Albert NM, Gattis Stough W, Greenberg BH, și colab. (2007) relația dintre concentrația serică de sodiu de admitere și rezultatele clinice la pacienții spitalizați pentru insuficiență cardiacă: o analiză din registrul OPTIMIZE-HF. Eur Inima J 28: 980-988.
- Abraham WT, Adams KF, Fonarow GC, Costanzo MR, Berkowitz RL și colab. (2005) mortalitatea în spital la pacienții cu insuficiență cardiacă decompensată acută care necesită medicamente vasoactive intravenoase: o analiză din Registrul Național al insuficienței cardiace decompensate Acute (adere). J Am Coll Cardiol 46: 57-64.
- Grady KL, Dracup K, Kennedy G, Moser DK, pian M, și colab. (2000) managementul echipei pacienților cu insuficiență cardiacă: o declarație pentru profesioniștii din domeniul sănătății de la Consiliul de asistență cardiovasculară al Asociației Americane a inimii. Circulație 102: 2443-24456.Stevenson LW, Perloff JK (1989) fiabilitatea limitată a semnelor fizice pentru estimarea hemodinamicii în insuficiența cardiacă cronică. Jama 261: 884-888.
- Nohria A, Tsang SW, Fang JC, Lewis EF, Jarcho JA și colab. (2003) evaluarea clinică identifică profilurile hemodinamice care prezic rezultatele la pacienții admiși cu insuficiență cardiacă. J Am Coll Cardiol 41: 1797-1804.
- Forrester JS, Diamond G, Chatterjee K, Swan HJ (1976) terapia medicală a infarctului miocardic acut prin aplicarea subseturilor hemodinamice. N Engl J Med 295: 1356-1362.
- Nohria A, Lewis e, Stevenson LW (2002) managementul Medical al insuficienței cardiace avansate. Jama 287: 628-640.
- Kirkpatrick JN, Vannan MA, Narula J, lang RM (2007) ecocardiografia în insuficiența cardiacă: aplicații, utilitate și noi orizonturi. J Am Coll Cardiol 50: 381-396.
- Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, și colab. (2011) evaluarea ecocardiografică a hemodinamicii la pacienții cu insuficiență cardiacă sistolică decompensată. Circ Cardiovasc Imaging 4: 220-227.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, și colab. (2015) recomandări pentru cuantificarea camerei cardiace prin ecocardiografie la adulți: o actualizare de la Societatea Americană de ecocardiografie și Asociația Europeană de imagistică cardiovasculară. Eur Inima J Cardiovasc Imaging 16: 233-271.
- Garbi M, McDonagh T, Cosyns B, Bucciarelli-Ducci C, Edvardsen T, și colab. (2014) criterii de adecvare pentru utilizarea imagisticii cardiovasculare în insuficiența cardiacă: raport de revizuire a literaturii. Eur Inima J Cardiovasc Imaging 16: 147-153.
- Gimelli A, Lancellotti P, Badano LP, Lombardi M, Gerber B și colab. (2014) evaluarea imagistică cardiacă neinvazivă a pacienților cu insuficiență cardiacă sistolică cronică: un raport al Asociației Europene de imagistică cardiovasculară (EACVI). Eur Inima J 35: 3417-3425.
- Vazir a, Cowie MR (2012) evaluarea insuficienței cardiace decompensate acute: strategii și instrumente. EUR Cardiol 8: 128-133.
- Gray a, Goodacre S, Newby de, Masson M, Sampson F, și colab. (2008) ventilația neinvazivă în edemul pulmonar cardiogen acut. N Engl J Med 359: 142-151.
- Cotter G, Cotter OM, Kaluski E (2008) monitorizarea hemodinamică în insuficiența cardiacă acută. Crit Îngrijire Med 36: S40-S43.
- Lewis PA, Ward DA, Courtney MD (2009) pompa cu balon intra-aortic în managementul insuficienței cardiace: implicații pentru practica medicală. Aust Crit Îngrijire 22: 125-131.
- Slaughter MS, Singh R (2012) rolul dispozitivelor de asistență ventriculară în insuficiența cardiacă avansată. Revista Espa Elixcola de Cardiologia 65: 982-985.
- Shah MR, Hasselblad V, Stinnett SS, Gheorghiade M, Swedberg K, și colab. (2001) profiluri hemodinamice ale insuficienței cardiace avansate: asociere cu caracteristici clinice și rezultate pe termen lung. J Carte Nu 7: 105-113.
- Loeb HS, Bredakis J, Gunner RM (1977) superioritatea dobutaminei față de dopamină pentru mărirea debitului cardiac la pacienții cu insuficiență cardiacă cronică cu debit scăzut. Circulație 55: 375-378.
- Follath F, Cleland JG, doar H, Papp JG, Scholz H, și colab. (2002) eficacitatea și siguranța levosimendanului intravenos comparativ cu dobutamina în insuficiența cardiacă severă cu ieșire redusă (studiul LIDO): un studiu randomizat dublu-orb. Lanceta 360: 196-202.
- Nishimura RA, Grantham JA, Connolly HM, Schaff HV, HIGANO ST, și colab. (2002) stenoză aortică cu randament scăzut, cu gradient scăzut la pacienții cu funcție sistolică ventriculară stângă deprimată: utilitatea clinică a provocării dobutaminei în laboratorul de cateterizare. Circulație 106: 809-813.
- Adamopoulos S, Parissis JT, Iliodromitis EK, Paraskevaidis I, Tsiapras D și colab. (2006) efectele levosimendanului față de dobutamină asupra căilor inflamatorii și apoptotice în insuficiența cardiacă cronică decompensată acut. Am J Cardiol 98: 102-106.
- Mebazaa A, Nieminen MS, Packer M, Cohen-Solal A, Kleber FX și colab. (2007) Supraviețuiește Anchetatorilor. Levosimendan vs dobutamină pentru pacienții cu insuficiență cardiacă decompensată acută: studiul randomizat SURVIVE. Jama 297: 1883-1891.
- Levin RL, Degrange MA, Porcile R, Salvagio F, Blanco N, și colab. (2008) sensibilizatorul de calciu levosimendan dă rezultate superioare dobutaminei în sindromul postoperator scăzut al debitului cardiac. Revista Espa Oktsola de cardiolog Oktsa (ediția în limba engleză) 61: 471-479.
- Mullens W, Abrahams Z, Francis GS, Skouri HN, Starling RC și colab. (2008) nitroprusiat de sodiu pentru insuficiență cardiacă avansată cu ieșire redusă. J Am Coll Cardiol 52: 200-207.
- Lomivorotov VV, Boboshko VA, Efremov SM, Kornilov IA, Chernyavskiy AM, și colab. (2012) Levosimendan versus o pompă cu balon intra-aortic la pacienții cardiaci cu risc ridicat. J Cardiothorac Vasc Anth 26: 596-603.
- Alvarez J, Baluja A, Selas S, Otero P, Rial M, și colab. (2013) o comparație a fluxului sanguin hepatic de doubutamină și levosimendan n la pacienții cu o stare de debit cardiac scăzut după o intervenție chirurgicală cardiacă: un studiu randomizat controlat. Anaesth Terapie Intensivă 41: 719-727.
- Cholley B, Caruba T, Grosjean S, Amour J, Ouattara A, și colab. (2017) efectul levosimendanului asupra sindromului de ieșire cardiacă scăzută la pacienții cu fracție de ejecție scăzută supuși grefării bypass coronarian cu bypass cardiopulmonar: studiul clinic randomizat LICORN. Jama 318: 548-556.
- Landoni G, Lomivorotov VV, Alvaro G, Lobreglio R, Pisano A, și colab. (2017) Levosimendan pentru suport hemodinamic după intervenția chirurgicală cardiacă. N Engl J Med 376: 2021-2031.
- Mehta RH, Leimberger JD, Van Diepen S, Meza J, Wang a, și colab. (2017) Levosimendan la pacienții cu disfuncție ventriculară stângă supuși unei intervenții chirurgicale cardiace. N Engl J Med 376: 2032-2042.
- Schumann J, Henrich ce, Strobl H, Prondzinsky R, Weiche S, și colab. (2018) agenți Inotropi și strategii vasodilatatoare pentru tratamentul șocului cardiogen sau a sindromului de debit cardiac scăzut. Biblioteca Cochrane. 2 : 1-10.