Chimie introductivă – Ediția 1 Canadiană
obiective de învățare
- definiți presiunea vaporilor lichidelor.
- explicați originea atât a tensiunii superficiale, cât și a acțiunii capilare.
există câteva proprietăți pe care le au toate lichidele. Lichidul cu care suntem cel mai familiarizați este probabil apa și are aceste proprietăți. Alte lichide le au, de asemenea, care este ceva de a păstra în minte.
toate lichidele au o anumită porțiune din particulele lor având suficientă energie pentru a intra în faza gazoasă și, dacă aceste particule se află la suprafața lichidului, o fac (figura 10.6 „evaporare”). Formarea unui gaz dintr-un lichid la temperaturi sub punctul de fierbere se numește evaporare. La aceste temperaturi, materialul din faza gazoasă se numește vapori, mai degrabă decât gaz; termenul gaz este rezervat atunci când faza gazoasă este faza stabilă.
Figura 10.6 evaporare

unele particule ale unui lichid au suficientă energie pentru a ieși din faza lichidă pentru a deveni vapori.
dacă volumul disponibil este suficient de mare, în cele din urmă tot lichidul va deveni vapori. Dar dacă volumul disponibil nu este suficient, în cele din urmă unele dintre particulele de vapori vor reintra în faza lichidă (figura 10.7 „echilibru”). La un moment dat, numărul de particule care intră în faza de vapori va fi egal cu numărul de particule care părăsesc faza de vapori, astfel încât nu există nicio modificare netă a cantității de vapori din sistem. Noi spunem că sistemul este în echilibru. Presiunea parțială a vaporilor la echilibru se numește presiunea de vapori a lichidului.
figura 10.7 echilibru

la un moment dat, numărul de particule care intră în faza de vapori va fi echilibrat de numărul de particule care revin în lichid. Acest punct se numește echilibru.
înțelegeți că lichidul nu a încetat să se evapore. Procesul invers—condensarea-are loc la fel de rapid ca evaporarea, deci nu există nicio modificare netă a cantității de vapori din sistem. Termenul echilibru dinamic reprezintă o situație în care are loc încă un proces, dar procesul opus are loc și în același ritm, astfel încât să nu existe nicio schimbare netă în sistem.
presiunea vaporilor pentru o substanță depinde de temperatura substanței; pe măsură ce temperatura crește, la fel și presiunea vaporilor. Figura 10.8 „parcele de presiune a vaporilor versus temperatură pentru mai multe lichide” este un grafic de presiune a vaporilor versus temperatură pentru mai multe lichide. Având presiunea de vapori definită, putem redefini și punctul de fierbere al unui lichid: temperatura la care presiunea de vapori a unui lichid este egală cu presiunea mediului înconjurător. Presiunea normală de vapori, atunci, este temperatura la care presiunea de vapori este 760 torr, sau exact 1 atm. Astfel, punctele de fierbere variază în funcție de presiunea din jur, fapt care poate avea implicații mari asupra gătitului alimentelor la cote mai mici sau mai mari decât cele normale. Presiunea atmosferică variază semnificativ în funcție de altitudine.
figura 10.8 parcele de presiune a vaporilor față de temperatură pentru mai multe lichide
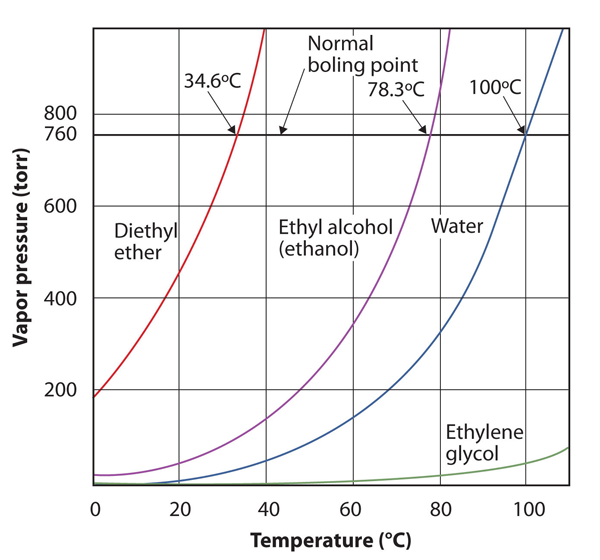
presiunea vaporilor unui lichid depinde de identitatea lichidului și de temperatură, așa cum arată acest grafic.
Exemplul 4
utilizați figura 10.8 „parcele de presiune a vaporilor față de temperatură pentru mai multe lichide” pentru a estima punctul de fierbere al apei la 500 torr, care este presiunea atmosferică aproximativă din vârful muntelui Everest.
soluție
A se vedea figura însoțitoare. Cinci sute torr sunt între 400 și 600, așa că extindem o linie din acel punct de pe axa y până la curba pentru apă și apoi o coborâm pe axa x pentru a citi temperatura asociată. Se pare că punctul de pe curba de presiune a vaporilor de apă corespunde unei temperaturi de aproximativ 90 int. C, deci concluzionăm că punctul de fierbere al apei la 500 torr este de 90 int.C.
figura 10.9 folosind figura 10.8″ parcele de presiune a vaporilor versus temperatură pentru mai multe lichide”pentru a răspunde la exemplul 4
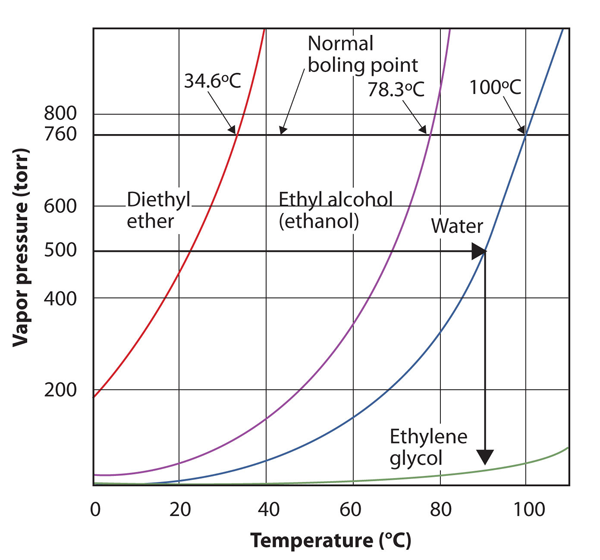
citind graficul corect, puteți estima punctul de fierbere al unui lichid la temperaturi diferite.
Testați-vă
utilizați figura 10.8 „parcele de presiune a vaporilor față de temperatură pentru mai multe lichide” pentru a estima punctul de fierbere al etanolului la 400 torr.
răspuns
aproximativ 65 de metri cubi c
curba presiunii de vapori pentru apă nu este exact zero la punctul de topire-0 metri cubi C. Chiar și gheața are o presiune de vapori; de aceea sublimează în timp. Cu toate acestea, presiunile de vapori ale solidelor sunt de obicei mult mai mici decât cele ale lichidelor. La -1 C, presiunea de vapori a gheții este de 4,2 torr. La o temperatură a congelatorului de 0 CTF F (-17 CTF C), Presiunea de vapori a gheții este de numai 1,0 torr; așa-numitele congelatoare adânci pot ajunge până la -23 CTF C, unde presiunea de vapori a gheții este de numai 0,6 torr.
diagrame de fază
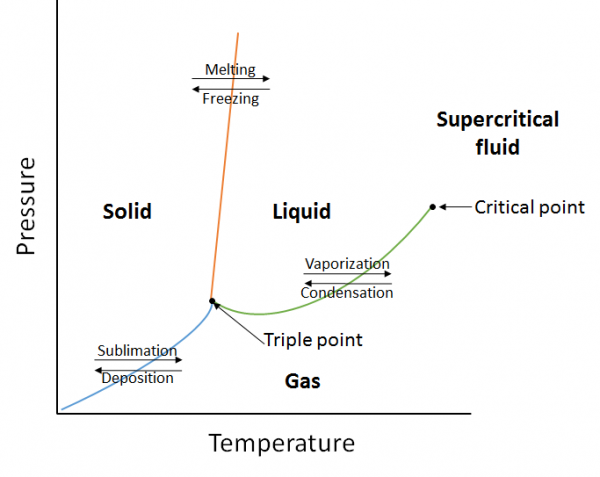
o diagramă de fază este o reprezentare grafică a relațiilor de echilibru care există între fazele unei substanțe sub presiuni și temperaturi specificate (figura 10.10). Diagrama de fază este o combinație de trei curbe: curba presiunii vaporilor, curba de topire și curba de sublimare. Am văzut anterior că curbele de presiune a vaporilor reprezintă echilibrul dintre faza lichidă și cea gazoasă, iar punctul în care presiunea este egală cu 1 atm este punctul normal de fierbere. O caracteristică suplimentară a acestei curbe în diagrama de fază (verde), este că se termină la punctul critic. Punctul critic este punctul la cea mai înaltă temperatură și presiune la care lichidele și gazele rămân distinse. La temperaturi și presiune dincolo de acest punct, Materia există într-o fază cu proprietăți atât ale lichidelor, cât și ale gazelor cunoscute sub numele de fluid supercritic.
curba de topire (portocaliu) reprezintă echilibrul dintre solid și lichid, iar punctul în care presiunea este egală cu 1 atm este punctul normal de topire. Curba de sublimare (albastru) reprezintă echilibrul care există între solid și gaz. În cele din urmă, punctul în care se întâlnesc toate cele trei curbe este cunoscut sub numele de punct triplu. În acest moment, trei faze (solid, lichid și gaz) există toate la echilibru.
exemplu:
folosind următoarea diagramă de fază, determinați ce s-ar întâmpla dacă:
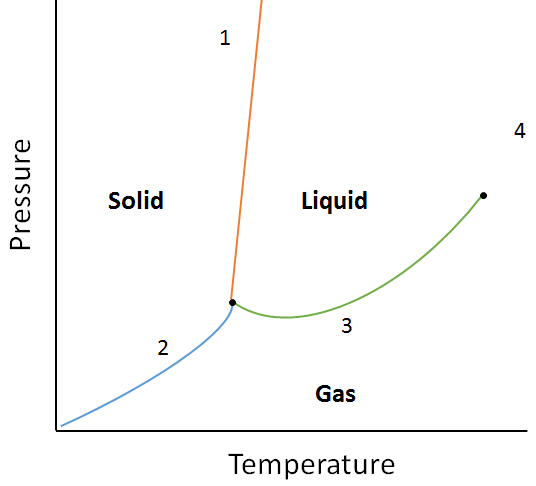
a. temperatura este crescută pentru materie la punctul 1.
b. presiunea este crescută pentru materie la punctul 3.
soluție:
a.Materia din punctul 1 se va topi (schimbă faza de la solid la lichid) dacă temperatura este crescută.
b. Materia din punctul 3 se va condensa (schimbă faza de la gaz la lichid) dacă temperatura este crescută.
tensiunea superficială și acțiunea capilară
toate lichidele au și alte proprietăți. Tensiunea superficială este un efect cauzat de un dezechilibru al forțelor asupra atomilor de la suprafața unui lichid, așa cum se arată în figura 10.11 „tensiunea superficială”. Particula albastră din cea mai mare parte a lichidului experimentează forțe intermoleculare din jur, așa cum este ilustrat de săgeți. Cu toate acestea, particula galbenă de pe suprafață nu experimentează forțe deasupra ei, deoarece nu există particule deasupra ei. Acest lucru duce la un dezechilibru al forțelor pe care le numim tensiune superficială.
figura 10.11 tensiunea superficială

tensiunea superficială provine din faptul că particulele de la suprafața unui lichid nu experimentează interacțiuni din toate direcțiile, ducând la un dezechilibru al forțelor de pe suprafață.
figura 10.12 efectele tensiunii superficiale

Sursa:” wet apple ” de cristian ruberti este licențiat sub Creative Commons Atribuire-Necomercial-ShareAlike 2.0 Generic.