Chimie introductivă – Ediția 1 Canadiană
obiective de învățare
- definiți tamponul.
- identificați corect cele două componente ale unui tampon.
după cum se indică în secțiunea 12.4 „acizi și baze puternice și slabe și sărurile lor”, acizii slabi sunt relativ frecvenți, chiar și în alimentele pe care le consumăm. Dar întâlnim ocazional un acid sau o bază puternică, cum ar fi acidul stomacal, care are un pH puternic acid de 1,7. Prin definiție, acizii și bazele puternice pot produce o cantitate relativ mare de ioni H+ sau OH− și, prin urmare, au activități chimice marcate. În plus, cantități foarte mici de acizi și baze puternice pot schimba pH-ul unei soluții foarte repede. Dacă s—ar adăuga 1 mL de acid stomacal în sânge și nu ar fi prezent niciun mecanism de corectare, pH-ul sângelui ar scădea de la aproximativ 7,4 la aproximativ 4,7-un pH care nu este propice continuării vieții. Din fericire, organismul are un mecanism pentru minimizarea unor astfel de modificări dramatice ale pH-ului.
mecanismul implică un tampon, o soluție care rezistă schimbărilor dramatice ale pH-ului. tampoanele fac acest lucru fiind compuse din anumite perechi de substanțe dizolvate: fie un acid slab plus o sare derivată din acel acid slab, fie o bază slabă plus o sare a acelei baze slabe. De exemplu, un tampon poate fi compus din hc2h3o2 dizolvat (un acid slab) și NaC2H3O2 (sarea derivată din acel acid slab). Un alt exemplu de tampon este o soluție care conține NH3 (o bază slabă) și NH4Cl (o sare derivată din acea bază slabă).
să folosim un tampon HC2H3O2 / nac2h3o2 pentru a demonstra cum funcționează tampoanele. Dacă la soluția tampon se adaugă o bază puternică−o sursă de ioni OH—(aq)—, acei ioni OH− vor reacționa cu HC2H3O2 într-o reacție acido−bazică:
HC2H3O2(aq) + OH−(aq), H2O(AQ) + c2h3o2− (AQ), în loc să modifice dramatic pH-ul, făcând soluția bazică, ionii Oh adăugați reacționează pentru a produce H2O, astfel încât pH-ul nu se schimbă prea mult.
Dacă se adaugă un acid puternic—o sursă de ioni H+—la soluția tampon, ionii H+ vor reacționa cu anionul din sare. Deoarece HC2H3O2 este un acid slab, nu este ionizat mult. Aceasta înseamnă că, dacă o mulțime de ioni H+ și C2H3O2− ioni sunt prezenți în aceeași soluție, ei se vor uni pentru a face HC2H3O2:
H+(aq) + c2h3o2−(aq) HC2H3O2(aq)
în loc să schimbe pH-ul dramatic și să facă soluția acidă, ionii h+ adăugați reacționează pentru a face molecule de acid slab. Figura 12.2″ acțiunile tampoanelor ” ilustrează ambele acțiuni ale unui tampon.
figura 12.2 acțiunile tampoanelor
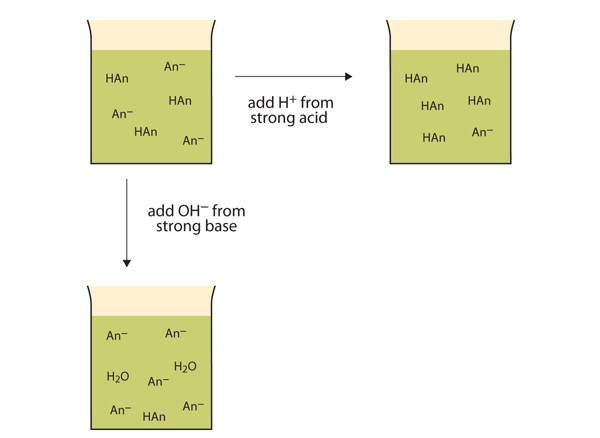
tampoanele pot reacționa atât cu acizi puternici (partea superioară), cât și cu baze puternice (partea laterală) pentru a minimiza modificările mari ale pH-ului.tampoanele fabricate din baze slabe și sărurile bazelor slabe acționează în mod similar. De exemplu, într− un tampon care conține NH3 și NH4Cl, moleculele de NH3 pot reacționa cu orice exces de ioni H+ introduși de acizi puternici:
NH3(aq) + h+(aq) NH4+(aq)
în timp ce ionul NH4+(aq) poate reacționa cu orice ioni OH−introduși de baze puternice:
NH4+(aq) + OH – (aq) H2O(XV)
exemplul 15
ce combinații de compuși pot face o soluție tampon?
- HCHO2 și Nacho2
- HCl și NaCl
- CH3NH2 și CH3NH3Cl
- NH3 și NaOH
soluție
- HCHO2 este acid formic, un acid slab, în timp ce NaCHO2 este sarea obținută din anionul acidului slab (ionul formiat ). Combinația acestor două substanțe dizolvate ar face o soluție tampon.
- HCl este un acid puternic, nu un acid slab, astfel încât combinația acestor două substanțe dizolvate nu ar face o soluție tampon.
- CH3NH2 este metilamină, care este ca NH3 cu unul dintre atomii săi H substituit cu o grupare CH3. Deoarece nu este listat în tabelul 12.2 „acizi și baze puternice”, putem presupune că este o bază slabă. Compusul CH3NH3Cl este o sare obținută din acea bază slabă, astfel încât combinația acestor două substanțe dizolvate ar face o soluție tampon.
- NH3 este o bază slabă, dar NaOH este o bază puternică. Combinația acestor două substanțe dizolvate nu ar face o soluție tampon.
Testați-vă
ce combinații de compuși pot face o soluție tampon?
- NaHCO3 și Naci
- H3PO4 și NaH2PO4
- NH3 și (NH4)3PO4
- NaOH și Naci
răspunsuri
- nu
- da
- da
- nu
div tampoanele funcționează bine numai pentru cantități limitate de acid sau Bază puternic adăugate. Odată ce fie solutul reacționează complet, soluția nu mai este un tampon și pot apărea modificări rapide ale pH-ului. Spunem că un tampon are o anumită capacitate. Tampoanele care au mai mult solut dizolvat în ele pentru a începe au capacități mai mari, așa cum s-ar putea aștepta.
sângele uman are un sistem de tamponare pentru a minimiza modificările extreme ale pH− ului. un tampon în sânge se bazează pe prezența HCO3-și H2CO3 . Cu acest tampon prezent, chiar dacă un acid stomacal și-ar găsi drumul direct în fluxul sanguin, modificarea pH-ului sângelui ar fi minimă. În interiorul multor celule ale corpului, există un sistem de tamponare bazat pe ioni de fosfat.
alimente și băuturi App: Acidul care ușurează durerea
deși medicamentele nu sunt tocmai „alimente și băuturi”, le ingerăm, așa că haideți să aruncăm o privire la un acid care este probabil cel mai frecvent medicament: acidul acetilsalicilic, cunoscut și sub numele de aspirină. Aspirina este bine cunoscută ca un calmant și antipiretic (reducător de febră).
structura aspirinei este prezentată în figura însoțitoare. Partea acidă este încercuită; este atomul H din acea parte care poate fi donat, deoarece aspirina acționează ca un acid br-Lowry. Deoarece nu este prezentat în tabelul 12.2 „acizi și baze puternice”, acidul acetilsalicilic este un acid slab. Cu toate acestea, este încă un acid și, având în vedere că unii oameni consumă zilnic cantități relativ mari de aspirină, natura sa acidă poate provoca probleme la nivelul mucoasei stomacului, în ciuda apărării stomacului împotriva propriului acid stomacal.
figura 12.3 structura moleculară a aspirinei

atomii înconjurați sunt partea acidă a moleculei.deoarece proprietățile acide ale aspirinei pot fi problematice, multe mărci de aspirină oferă o formă de „aspirină tamponată” a medicamentului. În aceste cazuri, aspirina conține, de asemenea, un agent de tamponare—de obicei MgO—care reglează aciditatea aspirinei pentru a minimiza efectele secundare acide.pe cât de utilă și comună este aspirina, a fost comercializată oficial ca medicament începând din 1899. Administrația SUA pentru alimente și medicamente (FDA), agenția guvernamentală însărcinată cu supravegherea și aprobarea medicamentelor în Statele Unite, nu a fost înființată decât în 1906. Unii au susținut că, dacă FDA a fost formată înainte de introducerea aspirinei, aspirina poate să nu fi obținut niciodată aprobarea datorită potențialului său de efecte secundare—sângerări gastrointestinale, zgomote în urechi, sindromul Reye (o problemă hepatică) și unele reacții alergice. Cu toate acestea, recent aspirina a fost touted pentru efectele sale în diminuarea atacuri de cord și accidente vasculare cerebrale, deci este probabil ca aspirina este aici pentru a rămâne.
key Takeaways
- un tampon este o soluție care rezistă schimbărilor bruște ale pH-ului.
exerciții
-
definiți tamponul. Ce două componente chimice conexe sunt necesare pentru a face un tampon?
-
se poate face un tampon prin combinarea unui acid puternic cu o bază puternică? De ce sau de ce nu?
-
ce combinații de compuși pot face un tampon? Să presupunem soluții apoase.
a) HCl și NaCl
b) HNO2 și NaNO2
c) NH4NO3 și HNO3
d) NH4NO3 și NH3
4. Ce combinații de compuși pot face un tampon? Să presupunem soluții apoase.
a) H3PO4 și Na3PO4
b) NaHCO3 și Na2CO3
c) NaNO3 și Ca(NO3)2
d) HN3 și NH3
5. Pentru fiecare combinație din Exercițiul 3 care este un tampon, scrieți ecuațiile chimice pentru reacțiile componentelor tampon atunci când se adaugă un acid puternic și o bază puternică.
6. Pentru fiecare combinație din exercițiul 4 care este un tampon, scrieți ecuațiile chimice pentru reacțiile componentelor tampon atunci când se adaugă un acid puternic și o bază puternică.
7. Sistemul tampon fosfat complet se bazează pe patru substanțe: H3PO4, H2PO4 -, HPO42 – și PO43 -. Ce soluții tampon diferite pot fi obținute din aceste substanțe?
8. Explicați de ce NaBr nu poate fi o componentă într-un tampon acid sau bazic.
9. Se fac două soluții care conțin aceleași concentrații de substanțe dizolvate. O soluție este compusă din H3PO4 și Na3PO4, în timp ce cealaltă este compusă din HCN și NaCN. Ce soluție ar trebui să aibă capacitatea mai mare ca tampon?
10. Se fac două soluții care conțin aceleași concentrații de substanțe dizolvate. O soluție este compusă din NH3 și NH4NO3, în timp ce cealaltă este compusă din H2SO4 și Na2SO4. Ce soluție ar trebui să aibă capacitatea mai mare ca tampon?
răspunsuri
un tampon este combinația dintre un acid sau o bază slabă și o sare a acelui acid sau bază slabă.
a) nu
b) da
c) nu
d) da
3b: acid puternic: NO2− + h+ HNO2 la sută; bază solidă: HNO2 + OH− NO2 la sută− + H2O; 3D: bază solidă: NH4+ + OH− NH3 la sută + H2O; acid puternic: NH3 + h+ NH4 la sută+7.
tampoanele pot fi realizate din trei combinații: (1) H3PO4 și H2PO4−, (2) H2PO4− și HPO42− și (3) HPO42− și PO43−. (Din punct de vedere tehnic, un tampon poate fi realizat din oricare două componente.)
tamponul fosfat ar trebui să aibă capacitatea mai mare.