Entalpia și reacțiile chimice
7.3 entalpia și reacțiile chimice
obiectivele învățării
- definesc entalpia.
- exprimă în mod corespunzător schimbarea entalpiei reacțiilor chimice.
- explicați modul în care modificările entalpiei sunt măsurate experimental.
acum că am arătat cum sunt legate energia, munca și căldura, suntem gata să luăm în considerare schimbările energetice în reacțiile chimice. Un concept fundamental este că fiecare reacție chimică are loc cu o schimbare simultană a energiei. Acum trebuie să învățăm cum să exprimăm în mod corespunzător aceste schimbări energetice.
studiul gazelor din capitolul 6 „gaze” și definiția muncii din secțiunea 7.2 „muncă și căldură” indică faptul că Condiții precum presiunea, volumul și temperatura afectează conținutul energetic al unui sistem. Ceea ce avem nevoie este o definiție a energiei care se menține atunci când unele dintre aceste condiții sunt specificate (oarecum similară cu definiția noastră a temperaturii și presiunii standard în studiul nostru asupra gazelor). Definim schimbarea entalpieicăldura unui proces la presiune constantă; notată INKTHH. (XVH) ca căldură a unui proces atunci când presiunea este menținută constantă:
presiunea constantă
litera H reprezintă „entalpia”, un fel de energie, în timp ce în cazul lui se produce o modificare a cantității. Vom fi întotdeauna interesați de schimbarea în H, mai degrabă decât de valoarea absolută a lui H în sine.
când apare o reacție chimică, există o schimbare caracteristică a entalpiei. Schimbarea entalpiei pentru o reacție este de obicei scrisă după o ecuație chimică echilibrată și pe aceeași linie. De exemplu, atunci când doi moli de hidrogen reacționează cu un mol de oxigen pentru a face doi moli de apă, schimbarea caracteristică a entalpiei este de 570 kJ. Noi scriem ecuația ca
2H2(g) + O2(g) 2H2O(g) 2H2O (XQ) XQX = -570 KJ
o ecuație chimică care include o modificare entalpie se numește ecuație termochimicăo ecuație chimică care include o modificare entalpie.. Se presupune că o ecuație termochimică se referă la ecuație în cantități molare, ceea ce înseamnă că trebuie interpretată în termeni de moli, nu molecule individuale.
exemplul 5
scrieți ecuația termochimică pentru reacția PCl3(g) cu Cl2(g) pentru a face PCl5(g), care are o schimbare de entalpie de -88 kJ.
soluție
ecuația termochimică este
PCL3(g) + Cl2(g) XV PCL5(g) XVH = -88 kJ
Testați-vă
scrieți ecuația termochimică pentru reacția lui N2(g) cu O2(g) pentru a face 2NO(g), care are o schimbare de entalpie de 181 kJ.
Answer
N2(g) + O2(g) 2NO(G) 181 KJ
s-ar putea să fi observat că pentru o reacție chimică, valoarea de X-X poate fi pozitivă sau negativă. Se presupune că numărul este pozitiv dacă nu are semn; un semn + poate fi adăugat Explicit pentru a evita confuzia. Se spune că o reacție chimică care are o valoare pozitivă a XIF este o reacție chimică endotermică care are o schimbare pozitivă în entalpie., în timp ce se spune că o reacție chimică care are un HECTH negativ este o reacție chimică exotermică care are o schimbare negativă în entalpie..
ce înseamnă dacă valoarea unui proces este pozitivă? Aceasta înseamnă că sistemul în care are loc reacția chimică câștigă energie. Dacă se consideră că energia unui sistem este reprezentată ca o înălțime pe un grafic energetic vertical, schimbarea entalpiei care însoțește reacția poate fi diagramată ca în partea (a) din Figura 7.3 „energia de reacție”: energia reactanților are o anumită energie, iar sistemul își crește energia pe măsură ce merge la produse. Produsele sunt mai mari pe scara verticală decât reactanții. Endotermic, atunci, implică faptul că sistemul câștigă sau absoarbe energie.
există o situație opusă pentru un proces exoterm, așa cum se arată în partea (b) din Figura 7.3 „energia de reacție”. Dacă schimbarea entalpiei unei reacții este negativă, sistemul pierde energie, astfel încât produsele au mai puțină energie decât reactanții, iar produsele sunt mai mici pe scara energetică verticală decât reactanții. Exoterma, atunci, implică faptul că sistemul pierde sau degajă energie.
figura 7.3 energia de reacție
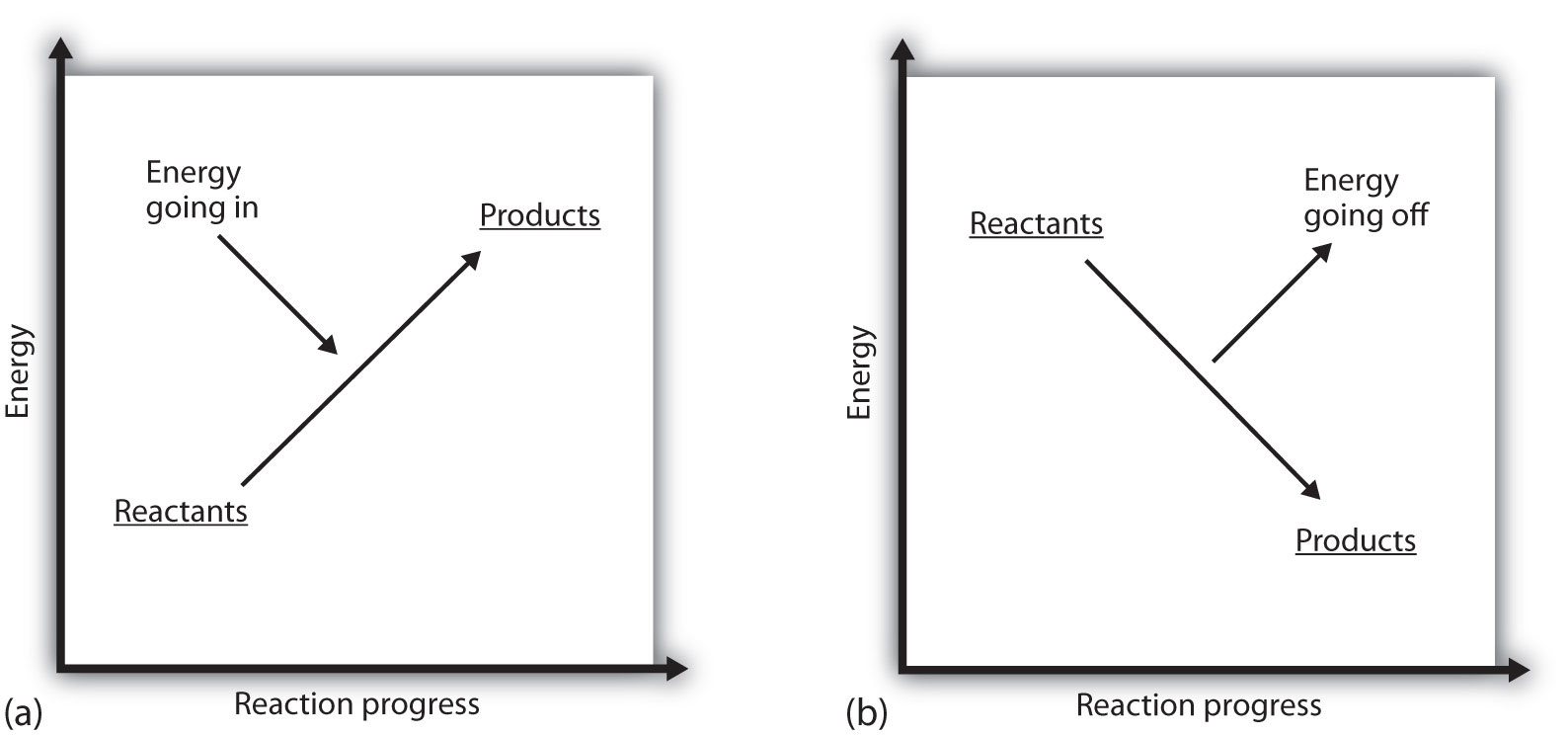
(a) într-o reacție endotermică, energia sistemului crește (adică se deplasează mai sus pe scara verticală a energiei). (b) într-o reacție exotermă, energia sistemului scade (adică se deplasează mai jos pe scara verticală a energiei).
exemplul 6
luați în considerare această ecuație termochimică.
2CO ( g) + O2(g) x2co2 (G) XXXX = -565 kJ
este exoterm sau endoterm? Câtă energie este eliberată sau absorbită?
soluție
prin definiție, o reacție chimică care are un rezultat negativ de un XlX este exotermă, ceea ce înseamnă că această cantitate de energie—în acest caz, 565 kJ—este eliberată de reacție.
Testați-vă
luați în considerare această ecuație termochimică.
CO2(g) + h2(g) co(g) + H2O(G) XlX = 42 kJ
este exoterm sau endoterm? Câtă energie este eliberată sau absorbită?
răspuns
endotermic; 42 kJ sunt absorbite.
cum se masoara experimental valorile de la Alecs? De fapt, nu se măsoară x-H; q se măsoară. Dar măsurătorile sunt efectuate în condiții de presiune constantă, astfel încât XQH este egal cu Q măsurat.
Experimental, q se măsoară profitând de ecuația
q = mc-ult
premăsurăm masa substanțelor chimice dintr-un sistem. Apoi lăsăm reacția chimică să apară și să măsurăm schimbarea temperaturii (CENTICT) a sistemului. Dacă cunoaștem căldura specifică a materialelor din sistem (de obicei, o facem), putem calcula q. această valoare a lui q este numeric egală cu XQTAH a procesului, pe care o putem scala până la o scară molară. Containerul în care se află sistemul este de obicei izolat, astfel încât orice schimbare de energie duce la schimbarea temperaturii sistemului, mai degrabă decât la scurgerea din sistem. Containerul este denumit calorimetrun recipient utilizat pentru a măsura căldura unei reacții chimice., iar procesul de măsurare a modificărilor entalpiei se numește calorimetrieprocesul de măsurare a modificărilor entalpiei pentru reacțiile chimice..
figura 7.4 calorimetre
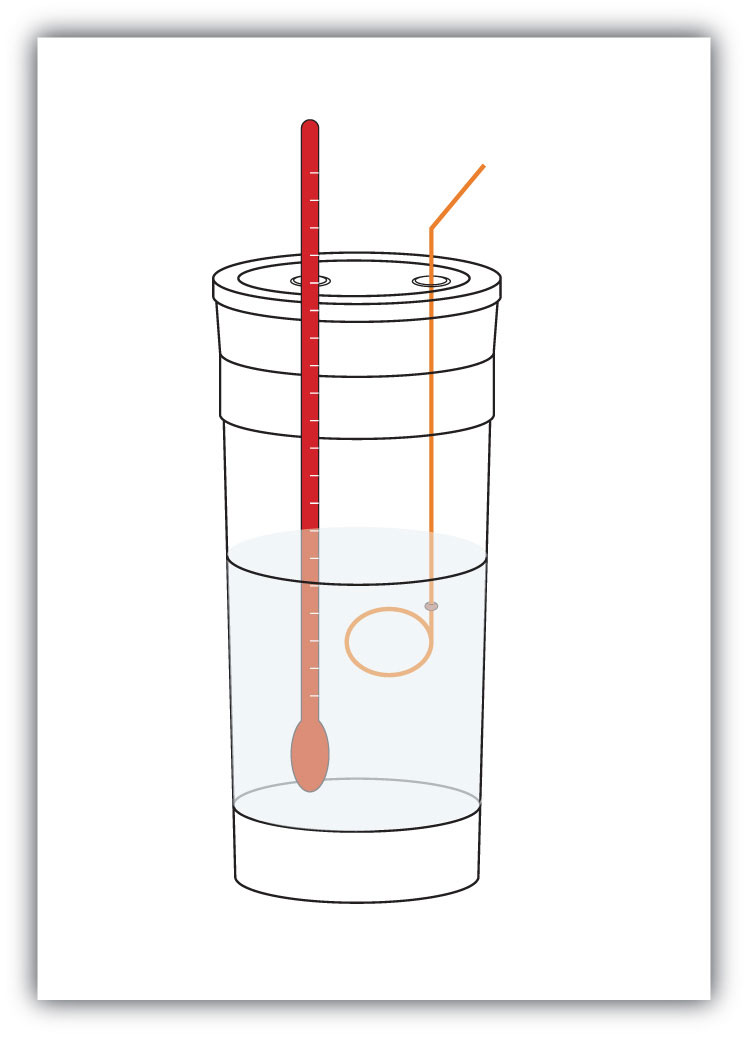
un calorimetru simplu poate fi construit din niște căni de cafea din spumă imbricate, un capac, un termometru și un agitator.
de exemplu, să presupunem că 4,0 g de NaOH sau 0,10 mol de NaOH sunt dizolvate pentru a face 100,0 mL de soluție apoasă, în timp ce 3,65 g de HCl sau 0,10 mol de HCl sunt dizolvate pentru a face încă 100,0 mL de soluție apoasă. Cele două soluții sunt amestecate într-un calorimetru izolat, se introduce un termometru și calorimetrul este acoperit (vezi figura 7.4 „calorimetre” pentru un exemplu de configurare). Termometrul măsoară schimbarea temperaturii pe măsură ce are loc următoarea reacție chimică:
NaOH (aq) + HCl(AQ) NaCl(aq) + H2O(hectolitru)
un observator observă că temperatura crește de la 22,4% C la 29,1% C. presupunând că capacitățile și densitățile termice ale soluțiilor sunt aceleași cu cele ale apei pure, acum avem informațiile de care avem nevoie pentru a determina schimbarea entalpiei reacției chimice. Cantitatea totală de soluție este de 200,0 mL, iar cu o densitate de 1,00 g/mL, avem astfel 200,0 g de soluție. Folosind ecuația pentru q, înlocuim măsurătorile noastre experimentale și căldura specifică a apei(tabelul 7.1 „încălziri specifice ale diferitelor substanțe”):
q=(200,0 g) (4,184 j g XCT) (6,7 XCT)
rezolvarea pentru Q, obținem
q=5.600 J XCT pentru reacție
căldura Q este egală cu cea pentru reacție deoarece reacția chimică are loc la presiune constantă. Cu toate acestea, reacția degajă această cantitate de energie, astfel încât semnul real de pe XVH este negativ:
pentru reactie
avem urmatoarea ecuatie termochimica pentru reactia chimica care s-a produs in calorimetru:
110 NaOH(aq)+110 HCl(aq) 110 naci(AQ)+110 H2O(AQ)-5600 J
coeficientii 1/10 sunt prezenti pentru a ne reaminti ca am inceput cu o zecime dintr-un mol din fiecare reactant, astfel incat facem o zecime dintr-un mol din fiecare produs. De obicei, însă, raportăm ecuații termochimice în termeni de alunițe, nu o zecime dintr-o aluniță. Pentru a scala până la cantități molare, trebuie să înmulțim coeficienții cu 10. Cu toate acestea, atunci când facem acest lucru, obținem de 10 ori mai multă energie. Astfel, avem
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 J
ΔH poate fi transformat într-kJ unități, astfel încât ultima noastră ecuația termochimică este
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
Ne-au luat doar datele noastre experimentale de calorimetrie și a determinat o schimbare entalpia unei reacții chimice. Măsurători similare cu privire la alte reacții chimice pot determina valorile de X-H ale oricărei reacții chimice pe care doriți să o studiați.
exemplul 7
o soluție de 100 mL de 0.25 mol de Ca2+(aq) s−au amestecat cu 0,50 mol de ioni F−(aq) și s-a precipitat CaF2:
Ca2 + (AQ) + 2f – (aq) CaF2 (s)
temperatura soluției a crescut cu 10,5 CTQ C. care a fost modificarea entalpiei pentru reacția chimică? Care a fost schimbarea entalpiei pentru producerea a 1 mol de CaF2? Să presupunem că soluția are aceeași densitate și căldură specifică ca apa.
soluție
pentru că ni se administrează direct, se poate determina căldura reacției, care este egală cu:
Q=(100 g)(4.184 j g c)(10.5 C)
rezolvând pentru q, obținem
q = 4.400 J
prin urmare, HECTH = -4.400 J.
conform stoichiometriei reacției, se vor forma exact 0,25 mol de CaF2, deci această cantitate de căldură este de 0,25 mol. Pentru 1 mol de CaF2, trebuie să mărim căldura cu un factor de patru:
q = 4.400 J 4 = 17.600 J pentru 1 mol CaF2
pe o bază molară, schimbarea entalpiei este
OCTOH = -17.600 J = -17,6 kJ
Testați-vă
într-un calorimetru la presiune constantă, 0,10 mol de CH4(g) și 0,20 mol de O2(G) sunt reacționate.
CH4(g) + 2O2(g) CO2(g) + 2H2O(XV)
reacția se încălzește 750.0 g de H2O până la 28,4 centimetri C. Ce este pentru reacția pe o scară molară, ce este XIXth?
răspuns
-891 kJ
soluții cheie
- fiecare reacție chimică are loc cu o schimbare simultană a energiei.
- schimbarea entalpiei este egală cu căldura la presiune constantă.
- modificările entalpiei pot fi exprimate prin utilizarea ecuațiilor termochimice.
- modificările entalpiei sunt măsurate prin utilizarea calorimetriei.
exerciții
-
în ce condiții sunt q și XQU la fel?
-
în ce condiții sunt diferite q și X-X?
-
hidrogenul gazos și clorul gazos reacționează pentru a produce gaz de clorură de hidrogen cu o schimbare de entalpie însoțitoare de -184 kJ. Scrieți o ecuație termochimică echilibrată corespunzător pentru acest proces.
-
propanul (C3H8) reacționează cu gazul elementar de oxigen pentru a produce dioxid de carbon și apă lichidă cu o schimbare de entalpie însoțitoare de -2.220 kJ. Scrieți o ecuație termochimică echilibrată corespunzător pentru acest proces.
-
gazul de azot reacționează cu gazul de oxigen pentru a face NO(g) în timp ce absoarbe 180 kJ. Scrieți o ecuație termochimică echilibrată corespunzător pentru acest proces.
-
sodiul solid reacționează cu clorul gazos pentru a produce clorură de sodiu solidă în timp ce degajă 772 kJ. Scrieți o ecuație termochimică echilibrată corespunzător pentru acest proces.
-
hidrogenul gazos și clorul gazos reacționează pentru a produce gaz de clorură de hidrogen cu o schimbare de entalpie însoțitoare de -184 kJ. Este acest proces endotermic sau exoterm?
-
propanul (C3H8) reacționează cu oxigenul elementar gaz pentru a produce dioxid de carbon în timp ce degajă 2.220 kJ de energie. Este acest proces endotermic sau exoterm?
-
gazul de azot reacționează cu gazul de oxigen pentru a face NO(g) în timp ce absoarbe 180 kJ. Este acest proces exoterm sau endoterm?
-
sodiul metalic poate reacționa cu azotul pentru a produce azidă de sodiu (NaN3) cu un XQQ de 21,72 kJ. Este acest proces exoterm sau endoterm?
-
desenați o diagramă a nivelului de energie pentru reacția chimică din exercițiul 8. (A se vedea figura 7.3 „energia de reacție” pentru un exemplu.)
-
desenați o diagramă a nivelului de energie pentru reacția chimică din exercițiul 9. (A se vedea figura 7.3 „energia de reacție” pentru un exemplu.)
-
într-o soluție de 250 mL, se combină 0,25 mol de KOH(aq) și 0,25 mol de HNO3(aq). Temperatura soluției crește de la 22,5 C la 35,9 C. Se presupune că soluția are aceeași densitate și capacitate termică a apei. Care este căldura reacției și care este cea de-a zecea parte a reacției pe bază molară?
-
într-o soluție de 600 mL, 0.50 mol de Ca(OH)2(aq) și 0,50 mol de H2SO4 (aq) sunt combinate. Temperatura soluției crește cu 22,3 centimetrii C. care este căldura reacției și care este centimetrul reacției pe bază molară? Să presupunem că soluția are aceeași densitate și capacitate termică a apei.
-
pentru a încălzi 400,0 g de H2O, 0,050 mol de etanol (C2H5OH) este ars. Apa se încălzește de la 24,6 la 65,6 la 6,6 la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută la sută?
-
pentru a încălzi 100,0 g de H2O, se arde 0,066 mol ceară de albine. Apa se incalzeste de la 21.4 la 25.5 la 25.5 la C. care este caldura reactiei si care este cea a reactiei pe baza molara?
raspunsuri
-
in conditii de presiune constanta
-
H2(g) + Cl2(G) 2HCl(g) -184 KJ
-
N2(g) + O2(g) 2nu2(g) XlX = 180 kj
-
exoterme
endoterme
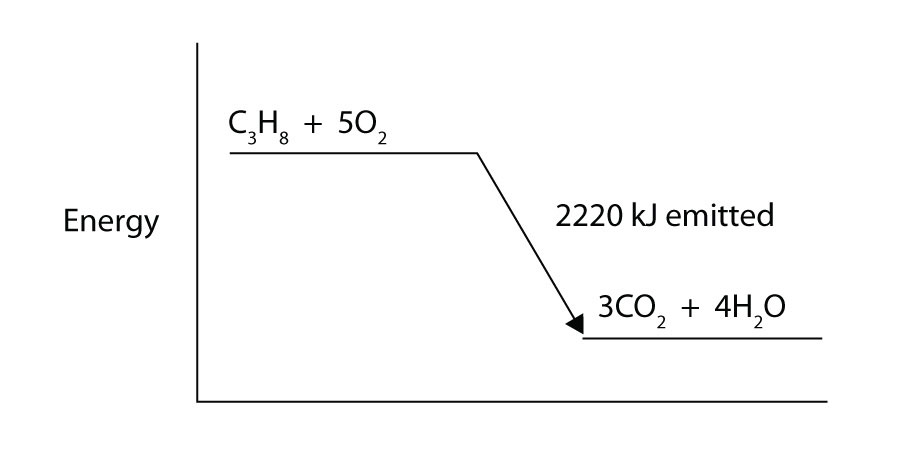
căldură de reacție=-14.0 kj; -56,0 kJ/mol de reactanți
căldură de reacție = -68,6 kJ; -1,370 kJ/mol de etanol