protein digestion: steg, enzymer och hormoner
kroppen kräver proteiner, och särskilt de essentiella aminosyrorna som finns i dem. Det rekommenderade dagliga intaget för ett friskt vuxenämne är 0, 85 g/kg kroppsvikt, så för en 70 kg person är ca 60 g, men ofta i den typiska västerländska kosten är intaget större än 100 g/dag.
förutom livsmedelsproteiner smälter kroppen också 50-100 g endogena proteiner som utsöndras eller förloras i lumen i mag-tarmkanalen och som härrör från:
- saliv;
- magsaft;
- pankreasenzymer och andra sekret;
- tarmceller som flingar av;
- proteiner som passerar in i tarmlumen från blodomloppet.
denna blandning smälts effektivt och absorberas i duodenum, den första och den kortaste delen av tunntarmen, med en daglig förlust genom avföring lika med ca 1,6 g kväve, motsvarande 10 g protein. Det mesta av det förlorade kvävet används av mikrofloran i tjocktarmen för dess tillväxt, och därmed finns det i avföringen som en del av bakteriemassan.
innehåll
- matsmältningsenzymer
- Roll matlagning och tugga av mat
- stadier av protein matsmältning
- mage och protein matsmältning
- protein matsmältning och pepsin
- Duodenum och protein matsmältning
- aktivering av pankreatiska zymogener
- pankreatisk trypsinhämmare
- mage och protein matsmältning
matsmältningsenzymer
proteinförtunning sker som ett resultat av hydrolysen av peptidbindningarna som binder de enskilda aminosyrorna i polypeptidkedjan. Dessa reaktioner katalyseras av enzymer som kallas proteaser.
tarmproteaserna, specifika för aminosyrasidokedjan, är hydrolaser som kan delas in i två klasser:
- endopeptidaser, som hydrolyserar peptidbindningar i polypeptidkedjan, och produceras av magen och den exokrina bukspottkörteln;
- exopeptidaser, som kan delas in i två grupper:
karboxipeptidas, som tar bort aminosyror från C-terminaländen, och produceras av magen och den exokrina bukspottkörteln;
karboxipeptidas, som tar bort aminosyror från C-terminaländen, och produceras av den exokrina bukspottkörteln;
aminopeptidas, som verkar på den N-terminala änden, och produceras av enterocyterna.

dessa enzymer syntetiseras och utsöndras i en inaktiv form, kallad zymogener eller proenzymer.
i cellen lagras zymogener inuti membranbegränsade granuler som kallas zymogengranuler. När cellen stimuleras av den specifika signalen, säkrar granulmembranet med plasmamembranet och zymogener frigörs genom exocytos.
dessa proteaser syntetiseras i en inaktiv form för att undvika att de, innan de utsöndras, smälter sig själva och/eller vävnadsproteiner. Vad som händer är att enzymets aktiva plats är ”maskerad” och först efter aktivering kan proteinet verka på substratet. Aktiveringen är resultatet av klyvningen, katalyserad av ett specifikt enzym, av en eller flera specifika peptidbindningar, med frisättning av ett eller flera segment av polypeptidkedjan. Detta gör det möjligt för molekylen att anta en tredimensionell konformation där den aktiva platsen är fri och korrekt konfigurerad.även deras ackumulering i granulerna är ett skyddssystem: det isolerar dem från de andra molekylerna som finns i cellen.
de flesta proteiner i deras ursprungliga konformation är resistenta mot proteasernas verkan. Detta är en följd av deras sekundära och tertiära eller inhemska struktur som maskerar många bindningar till enzymernas verkan. Dessa strukturer stabiliseras av kovalenta bindningar, såsom disulfidbroar mellan cysteinrester och icke-kovalenta krafter, såsom Joniska interaktioner, vätebindningar och van der Waals-krafter.
för en adekvat proteinförtunning är det därför viktigt att peptidbindningar är så tillgängliga som möjligt för verkan av tarmproteaserna. Detta uppnås, utanför kroppen genom matlagning av mat, och i kroppen av den sura miljön i magen.
roll av matlagning och tuggning av mat
matlagning av mat, när det inte är överdrivet, underlättar proteinförtunning.
på vilket sätt?liksom alla molekyler är proteiner inte orörliga utan vibrerar. När temperaturen ökar proteinerna vibrerar vid en större amplitud, upp för att förstöra de icke-kovalenta bindningarna som bidrar till underhållet av den ursprungliga strukturen. Därför sker en konformationsförändring av proteinet, det vill säga molekylen denatureras. Detta kan göra interna peptidbindningar mer tillgängliga för verkan av matsmältningsenzymer.
även tugga och insalivation av mat homogeniserar och fuktar de fasta komponenterna i maten själv, vilket underlättar mag-och tunntarmen.
stadier av proteinförtunning
två steg är involverade i matsmältningen av proteiner: den första sker i magen och den andra i i tolvfingertarmen, den första delen av tunntarmen.
mag-och proteinförtunning
proteinförtunning börjar i magen, och detta är ett ”beredningssteg” jämfört med händelserna som inträffar i tolvfingertarmen.
närvaron av mat i magen stimulerar G-celler i slemhinnan i gastrisk antrum och proximal duodenum för att producera och släppa hormonet gastrin i blodomloppet. Hormonet stimulerar parietalcellerna i de korrekta magkörtlarna, lokaliserade mestadels i organets botten, för att producera och utsöndra saltsyra i magen (parietalceller producerar också den inneboende faktorn, ett protein som binder vitamin B12, förhindrar dess förstöring och låter det absorberas).
i rätt magkörtlar hittade du också:
- slemhalsceller, som producerar slem;
- huvudceller, som frigör pepsinogen.
alla dessa ämnen, tillsammans med andra såsom kaliumjoner och magslipas, finns i magsaften, som har ett pH som sträcker sig mellan 1 och 2, 5.
på grund av dess låga pH har magsaften en antiseptisk verkan som dödar de flesta bakterier och andra främmande celler och en denaturerande effekt, eftersom den bryter mot de icke-kovalenta bindningarna som upprätthåller proteins ursprungliga struktur. Denna denatureringseffekt underlättar åtkomsten av tarmproteas till peptidbindningar, som uppvärmningen under tillagningen. Vissa proteiner som är rika på disulfidbindningar, såsom keratiner, är resistenta mot denaturering med lågt pH och därmed svåra att smälta. Tvärtom är de flesta av de globulära proteinerna nästan fullständigt hydrolyserade till ingående aminosyror.slutligen aktiverar det låga pH-värdet i magsaften pepsinogen, en zymogen, till pepsin, det första enzymet som är involverat i proteinförtunning.
protein digestion och pepsin
det finns olika isoenzymer av pepsinogen, såsom typ i, syntetiserad av kroppens celler och fundus i magen och typ II som produceras i alla organets regioner. Alla isoenzymer omvandlas till det aktiva enzymet. Aktiveringen sker via autokatalys, vid pH-värden under 5, genom en intramolekylär process bestående av hydrolys av en specifik peptidbindning och frisättning av en liten peptid från proenzymets N-terminala ände. Denna peptid förblir bunden till enzymet och fortsätter att fungera som en hämmare tills pH sjunker under 2, eller tills det bryts ned ytterligare av pepsin själv. Så, när en del pepsin bildas, aktiverar detta snabbt andra pepsinogenmolekyler.
Pepsin, ett endopeptidas med ett optimalt pH av aktivitet vid 1,6, hydrolyserar 10-20% av proteinerna i måltiden. Många matsmältningsenzymer kan verka på ett brett spektrum av substrat, och pepsin är inget undantag, vilket katalyserar klyvningen av peptidbindningar intill aminosyrarester såsom leucin och fenylalanin, tyrosin och tryptofan (aromatiska aminosyror). En blandning av peptider av stor storlek och några fria aminosyror produceras.
Pepsinverkan är viktig inte så mycket för dess direkta bidrag till proteinförtunning, det är blygsamt, men för frisättning av peptider och aminosyror som på duodenal nivå stimulerar utsöndringen av cholecystokinin och därmed duodenal/bukspottkörtelfasen av proteinförtunning (se nedan).
det bör noteras att verkan av pepsin på kollagen, en familj av proteiner som lindar runt och håller ihop muskelcellerna, underlättar tillgången till pankreasproteaset till måltidsproteiner.
Duodenum och protein digestion
när maginnehållet passerar in i duodenum stimulerar dess surhet s-celler, lokaliserade i duodenalslimhinnan och i den proximala delen av jejunum (nästa del av tunntarmen), för att producera och släppa hormonsekretinet i blodomloppet. Hormonet orsakar utsöndring av en alkalisk bukspottskörteljuice, rik på bikarbonatjoner men fattiga i enzymer, som passerar in i duodenum genom bukspottkörtelkanalen. I tolvfingertarmen neutraliserar den saltsyran som produceras av magen och höjer pH till cirka 7 (neutrala nivåer). Secretin stimulerar också gallsekretion och minskar gastrin frisättning.
närvaron av aminosyror i duodenum stimulerar, som nämnts ovan, endokrina celler i duodenum och jejunum för att producera och släppa kolecystokinin (CKK) i blodomloppet. Hormonet stimulerar bland annat exokrin bukspottkörtel att utsöndra en juice rik på enzymer( närvarande som zymogener), det vill säga:
- trypsinogen, chymotrypsinogen och proelastas, endopeptidaser med en annan substratspecificitet jämfört med pepsin men också bland dem;
- prokarboxypeptidas A och B, exopeptidaser som avlägsnar aminosyror från peptidernas C-terminala ände.
därför finns det i tolvfingertarmen en neutral miljö rik på enzymer som kan fortsätta, en gång aktiverad, proteinförtunning. Dessutom, eftersom proteaserna har olika substratspecificitet, kan varje peptid som produceras av ett enzym vara substrat av ett annat enzym.
i bukspottskörteljuice är amylas, lipas och nukleas också närvarande.
aktivering av pankreatiska zymogener
det första och huvudsteget i deras aktivering är omvandlingen av trypsinogen till trypsin genom enteropeptidas (även kallad enterokinas), ett endopeptidas producerat av celler i duodenum efter cholecystokininstimulering. Enteropeptidas katalyserar klyvningen av en specifik peptidbindning mellan en lysinrest och en isoleucinrest av trypsinogen, med frisättning av en hexapeptid. Detta orsakar en konformationell omläggning av proteinet som aktiverar det, det vill säga trypsin bildas.enzymet klyver peptidbindningar intill lysin-och argininrester av protein för att smälta; dessutom kan det aktivera chymotrypsinogen, proelastas och prokarboxypeptidas A och B, men också andra molekyler av trypsinogen, som pepsin (autokatalys).
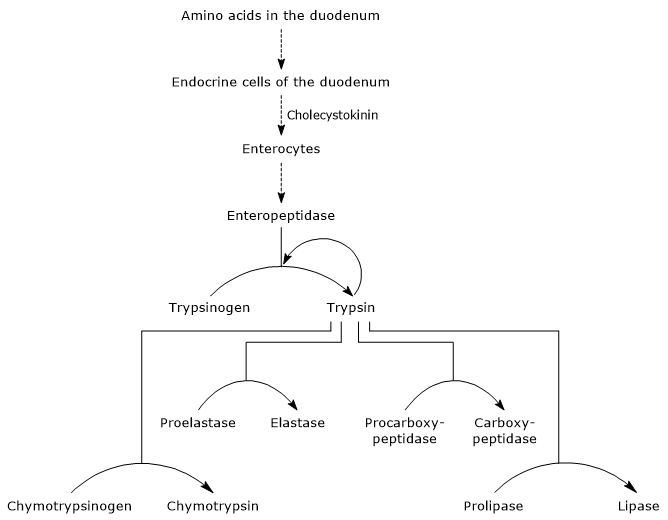
därför ökar duodenums förmåga att smälta proteiner när pankreatiska zymogener aktiveras, alla utlöses av en liten mängd enteropeptidas.
- aktiveringen av chymotrypsinogen till chymotrypsin sker genom olika steg som trypsin och det aktiverade chymotrypsinet själv deltar i.
i det första steget katalyserar trypsin klyvningen av en specifik peptidbindning, och detta medför aktivering av chymotrypsinogen till chymotrypsin, som är fullt aktiv. Sedan katalyserar sig själv-chymotrypsin frisättningen av två dipeptider med bildandet av chymotrypsin-chymotrypsin, en stabilare form av enzymet. chymotrypsin genomgår två konformationsförändringar, varav den första leder till bildandet av chymotrypsin-chymotrypsin, och den andra av chymotrypsin-chymotrypsin, den slutliga aktiva formen av enzymet.
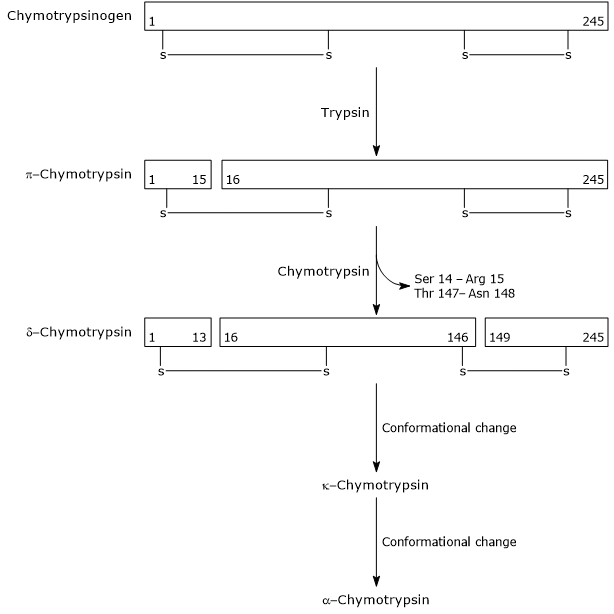
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
elastas, som är mindre specifikt än de andra matsmältningshydrolaserna, katalyserar klyvningen av peptidbindningar intill aminosyror såsom glycin, alanin och serin. - Prokarboxipeptidas
Prokarboxipeptidas a aktiveras till karboxipeptidas A; proteaset klyver peptidbindningar intill aminosyror med grenade eller aromatiska sidokedjor, såsom fenylalanin och valin.
Prokarboxipeptidas B aktiveras till karboxipeptidas B, specifikt för aminosyror med basiska sidokedjor, såsom lysin och arginin.
ovannämnda proteaser, till skillnad från pepsin, har ett optimalt pH-värde som sträcker sig från7 till 8, det vill säga neutralt eller svagt alkaliskt.
pankreatisk trypsinhämmare
det finns ett ” ytterligare ”skyddssystem mot intrapankreatisk trypsinaktivitet: syntesen av en hämmare som kallas”pankreatisk trypsinhämmare”. Molekylen, närvarande i pankreas zymogengranulerna, kan binda mycket tätt det aktiva stället för enzymet som inaktiverar det. På detta sätt blockeras aktiviteten hos något trypsin som härrör från en för tidig aktivering av trypsinogen, vilket förhindrar en situation där några aktiverade molekyler aktiverar alla pankreatiska zymogener.
i växter finns det många molekyler med liknande aktivitet. Ett exempel är Kunitz trypsinhämmare, ett protein som huvudsakligen finns i sojabönor, som bildar ett mycket stabilt komplex med den aktiva platsen för trypsin.eftersom de ovan nämnda proteaserna har en distinkt substratspecificitet, som verkar på peptidbindningar intill olika aminosyror, kan varje peptid som genereras av ett proteas vara substrat av en annan. På detta sätt hydrolyseras de partiellt digererade proteinerna som kommer in i duodenum effektivt till fria aminosyror och peptider med 2-8 rester. Dessa peptider är substrat av aminopeptidaser utsöndrade från enterocyter och associerade med deras mikrovilli.
Dipeptidas är också närvarande.
det bör noteras att samma proteaser slutligen smälts och slutar processen.
betydelsen och effektiviteten av proteolytiska enzymer i tarmproteinförtunningen kan förstås från detta exempel. Om in vitro du vill hydrolysera ett protein i dess beståndsdelar aminosyror, är det nödvändigt att använda en stark och koncentrerad syra som katalysator och att värma provet vid 105 kcal C över natten. I tarmen erhålls samma resultat inom några timmar, som arbetar först i den relativt sura miljön i magen och sedan i de milda alkaliska förhållandena i tolvfingertarmen, vid 37 kcal C.
de frisatta aminosyrorna, tillsammans med di – och tri-peptider, absorberas av enterocyter. Di-och tri-peptiderna hydrolyseras vanligtvis till ingående aminosyror i enterocyterna, och detta förklarar varför praktiskt taget endast fria aminosyror är närvarande i portalcirkulationen.
Bender D. A. Benders ordbok för näring och livsmedelsteknik. 8: e upplagan. Woodhead Publishing. Oxford, 2006
Bender D. A. introduktion till näring och metabolism. 3: e upplagan. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L. och Stryer L. Biokemiska. 5: e upplagan. WH Freeman och Company, 2002
Bhagavan NV, Ha C-E. Essentials of medical biochemistry: med kliniska fall. 4: e upplagan. Academic Press, 2015
Cozzani I. och Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Principer för biokemi. 4: e upplagan. W. H. Freeman och företag, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal MD, Glew Rh medicinsk biokemi: mänsklig metabolism i hälsa och sjukdom. John Wiley & Söner, INC., Publikation, 2009
Stipanuk M. H., Caudill ma Biokemiska, fysiologiska och molekylära aspekter av mänsklig näring. 3: e upplagan. Elsevier health sciences, 2013