Digestión de proteínas: pasos, enzimas y hormonas
El cuerpo requiere proteínas, y en particular los aminoácidos esenciales que contienen. La ingesta diaria recomendada para un sujeto adulto sano es de 0,85 g/kg de peso corporal, por lo que para una persona de 70 kg es de aproximadamente 60 g, pero a menudo en la dieta occidental típica, la ingesta es superior a 100 g / día.Además de las proteínas de los alimentos, el cuerpo también digiere 50-100 g de proteínas endógenas secretadas o perdidas en el lumen del tracto gastrointestinal, y que resultan de:
- saliva;
- jugo gástrico;
- enzimas pancreáticas y otras secreciones;
- células intestinales que se desprenden;
- proteínas que pasan a la luz intestinal desde el torrente sanguíneo.
Esta mezcla se digiere y absorbe de manera eficiente en el duodeno, la primera y la parte más corta del intestino delgado, con una pérdida diaria a través de las heces igual a aproximadamente 1,6 g de nitrógeno, equivalente a 10 g de proteína. La mayor parte del nitrógeno perdido es utilizado por la microflora en el colon para su crecimiento, y por lo tanto se encuentra en las heces como parte de la masa bacteriana.
CONTENIDO
- Enzimas digestivas
- Papel de la cocción y masticación de los alimentos
- Etapas de digestión de proteínas
- Digestión de estómago y proteínas
- Digestión de proteínas y pepsina
- Digestión de duodeno y proteínas
- Activación de zimógenos pancreáticos
- Inhibidor de tripsina pancreática
- Digestión de estómago y proteínas
Enzimas digestivas
La digestión de proteínas se produce como resultado de la hidrólisis de los enlaces peptídicos que unen los aminoácidos individuales en la cadena polipeptídica. Estas reacciones son catalizadas por enzimas llamadas proteasas.
Las proteasas intestinales, específicas para la cadena lateral de aminoácidos, son hidrolasas que se pueden dividir en dos clases:
- endopeptidasas, que hidrolizan enlaces peptídicos dentro de la cadena polipeptídica, y son producidas por el estómago y el páncreas exocrino;
- exopeptidasas, que se pueden dividir en dos grupos:
la carboxipeptidasa, que elimina los aminoácidos del extremo C-terminal, y son producidos por el páncreas exocrino;la aminopeptidasa, que actúa sobre el extremo N-terminal, y es producida por los enterocitos.

Estas enzimas se sintetizan y secretan en una forma inactiva, llamada zimógenos o proenzimas.Dentro de la célula, los zimógenos se almacenan dentro de gránulos delimitados por membrana llamados gránulos de zimógeno. Cuando la célula es estimulada por la señal específica, la membrana de gránulos se fusiona con la membrana plasmática y los zimógenos se liberan por exocitosis.
Estas proteasas se sintetizan en forma inactiva para evitar que, antes de ser secretadas, se digieran a sí mismas y/o proteínas tisulares. Lo que sucede es que el sitio activo de la enzima está «enmascarado» y solo después de la activación, la proteína puede actuar sobre el sustrato. La activación es el resultado de la escisión, catalizada por una enzima específica, de uno o más enlaces peptídicos específicos, con liberación de uno o más segmentos de la cadena polipeptídica. Esto permite que la molécula asuma una conformación tridimensional en la que el sitio activo está libre y configurado correctamente.Incluso su acumulación dentro de los gránulos es un sistema de protección: los aísla de las otras moléculas presentes en la célula.La mayoría de las proteínas en su conformación nativa son resistentes a la acción de las proteasas. Esto es consecuencia de su estructura secundaria y terciaria o nativa que enmascara muchos enlaces a la acción de las enzimas. Estas estructuras son estabilizadas por enlaces covalentes, como puentes de disulfuro entre residuos de cisteína, y fuerzas no covalentes, como interacciones iónicas, enlaces de hidrógeno y fuerzas de van der Waals.Por lo tanto, para una digestión adecuada de las proteínas, es esencial que los enlaces peptídicos sean lo más accesibles posible a la acción de las proteasas intestinales. Esto se logra, fuera del cuerpo a través de la cocción de los alimentos, y dentro del cuerpo por el ambiente ácido en el estómago.
Papel de la cocción y masticación de los alimentos
La cocción de los alimentos, cuando no es excesiva, facilita la digestión de proteínas.¿De qué manera?Al igual que todas las moléculas, también las proteínas no son inmóviles, sino que vibran. A medida que aumenta la temperatura, las proteínas vibran a una mayor amplitud, hasta destruir los enlaces no covalentes que contribuyen al mantenimiento de la estructura nativa. Por lo tanto, se produce un cambio conformacional de la proteína, es decir, la molécula se desnaturaliza. Esto puede hacer que los enlaces peptídicos internos sean más accesibles a la acción de las enzimas digestivas.Incluso la masticación e insalivación de los alimentos homogeneiza y humidifica los componentes sólidos del alimento en sí, facilitando la digestión gástrica y del intestino delgado.
Etapas de la digestión de proteínas
Dos etapas están involucradas en la digestión de proteínas: la primera se produce en el estómago y la otra en el duodeno, la primera parte del intestino delgado.
Digestión de estómago y proteínas
La digestión de proteínas comienza en el estómago, y esta es una «etapa de preparación» en comparación con los eventos que ocurren en el duodeno.La presencia de alimentos en el estómago estimula las células G de la mucosa del antro gástrico y el duodeno proximal para producir y liberar la hormona gastrina en el torrente sanguíneo. La hormona estimula las células parietales de las glándulas gástricas adecuadas, localizadas principalmente en la parte inferior del órgano, para producir y secretar ácido clorhídrico en el estómago (las células parietales también producen el factor intrínseco, una proteína que se une a la vitamina B12, evitando su destrucción y permitiendo su absorción).En las glándulas gástricas adecuadas también se encontró:
- células mucosas del cuello, que producen moco;
- células principales, que liberan pepsinógeno.
Todas estas sustancias, junto con otras como los iones de potasio y la lipasa gástrica, están presentes en el jugo gástrico, que tiene un pH que oscila entre 1 y 2,5.Debido a su bajo pH, el jugo gástrico tiene una acción antiséptica, matando a la mayoría de las bacterias y otras células extrañas, y un efecto desnaturalizador, ya que rompe los enlaces no covalentes que mantienen la estructura nativa de las proteínas. Este efecto desnaturalizador facilita el acceso de la proteasa intestinal a enlaces peptídicos, como el calentamiento durante la cocción. Algunas proteínas ricas en enlaces disulfuro, como las queratinas, son resistentes a la desnaturalización por pH bajo y, por lo tanto, difíciles de digerir. Por el contrario, la mayoría de las proteínas globulares están casi completamente hidrolizadas en aminoácidos constituyentes.Finalmente, el bajo pH del jugo gástrico activa el pepsinógeno, un zimógeno, a pepsina, la primera enzima involucrada en la digestión de proteínas.
Digestión de proteínas y pepsina
Hay diferentes isoenzimas de pepsinógeno, como el tipo I, sintetizado por las células del cuerpo y el fondo del estómago, y el tipo II que se produce en todas las regiones del órgano. Todas las isoenzimas se convierten en la enzima activa. La activación se produce mediante autocatálisis, a valores de pH inferiores a 5, mediante un proceso intramolecular que consiste en la hidrólisis de un enlace peptídico específico y la liberación de un pequeño péptido desde el extremo N-terminal de la proenzima. Este péptido permanece unido a la enzima y continúa actuando como inhibidor hasta que el pH cae por debajo de 2, o hasta que es degradado aún más por la propia pepsina. Por lo tanto, una vez que se forma algo de pepsina, esto activa rápidamente otras moléculas de pepsinógeno.La pepsina, una endopeptidasa con un pH de actividad óptimo a 1,6, hidroliza el 10-20% de las proteínas de la comida. Muchas enzimas digestivas son capaces de actuar sobre una amplia gama de sustratos, y la pepsina no es una excepción, catalizando la escisión de enlaces peptídicos adyacentes a residuos de aminoácidos como leucina y fenilalanina, tirosina y triptófano (aminoácidos aromáticos). Se produce una mezcla de péptidos de gran tamaño y algunos aminoácidos libres.La acción de la pepsina es importante no tanto por su contribución directa a la digestión de proteínas, que es modesta, sino por la liberación de péptidos y aminoácidos que, a nivel duodenal, estimulan la secreción de colecistoquinina y, por lo tanto, la fase duodenal/pancreática de la digestión de proteínas (ver más abajo).Cabe señalar que la acción de la pepsina sobre el colágeno, una familia de proteínas que envuelven y mantienen unidas las células musculares, facilita el acceso de la proteasa pancreática a las proteínas de las comidas.
Digestión de duodeno y proteínas
Cuando el contenido gástrico pasa al duodeno, su acidez estimula las células S, localizadas en la mucosa duodenal y en la parte proximal del yeyuno (la siguiente parte del intestino delgado), para producir y liberar la hormona secretina en el torrente sanguíneo. La hormona causa la secreción de un jugo pancreático alcalino, rico en iones de bicarbonato pero pobre en enzimas, que pasa al duodeno a través del conducto pancreático. En el duodeno, neutraliza el ácido clorhídrico producido por el estómago, elevando el pH a alrededor de 7 (niveles neutros). La secretina también estimula la secreción biliar y reduce la liberación de gastrina.La presencia de aminoácidos en el duodeno estimula, como se mencionó anteriormente, las células endocrinas en el duodeno y el yeyuno para producir y liberar colecistoquinina (CKK) en el torrente sanguíneo. La hormona, entre otras funciones, estimula el páncreas exocrino para secretar un jugo rico en enzimas (presentes como zimógenos), es decir:
- tripsinógeno, quimotripsinógeno y proelastasa, endopeptidasas con una especificidad de sustrato diferente en comparación con la pepsina, pero también entre ellas;
- procarboxipeptidasa A y B, exopeptidasas que eliminan los aminoácidos del extremo C-terminal de los péptidos.
Por lo tanto, en el duodeno hay un ambiente neutro rico en enzimas capaces de continuar, una vez activadas, la digestión de proteínas. Además, como las proteasas tienen una especificidad de sustrato diferente, cada péptido producido por una enzima puede ser sustrato de otra enzima.En el jugo pancreático, la amilasa, la lipasa y la nucleasa también están presentes.
Activación de zimógenos pancreáticos
El primer y principal paso en su activación es la conversión de tripsinógeno en tripsina por enteropeptidasa (también llamada enterocinasa), una endopeptidasa producida por las células del duodeno después de la estimulación de la colecistoquinina. La enteropeptidasa cataliza la escisión de un enlace peptídico específico entre un residuo de lisina y un residuo de isoleucina del tripsinógeno, con la liberación de un hexapéptido. Esto provoca un reordenamiento conformacional de la proteína que la activa, es decir, se forma tripsina.La enzima escinde enlaces peptídicos adyacentes a residuos de lisina y arginina de proteínas para digerir; además, puede activar quimotripsinógeno, proelastasa y procarboxipeptidasa A y B, pero también otras moléculas de tripsinógeno, como la pepsina (autocatálisis).
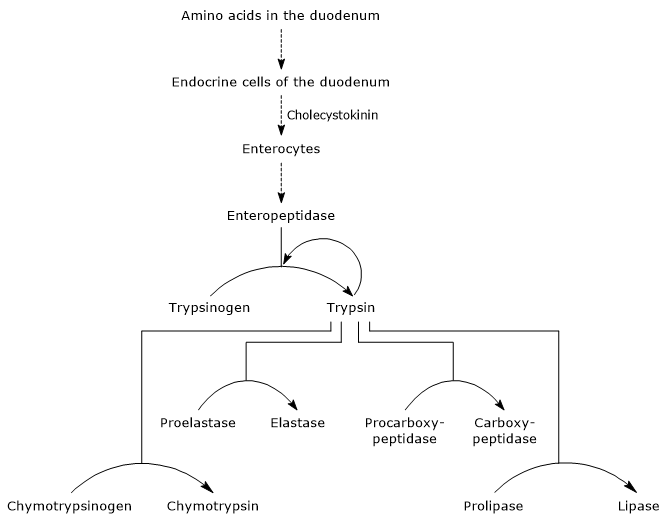
Por lo tanto, la capacidad del duodeno para digerir proteínas aumenta a medida que se activan los zimógenos pancreáticos, todos activados por una pequeña cantidad de enteropeptidasa.
- La activación de quimotripsinógeno a quimotripsina se produce a través de diferentes pasos en los que participan la tripsina y la propia quimotripsina activada.
En el primer paso, la tripsina cataliza la escisión de un enlace peptídico específico, y esto causa la activación de quimotripsinógeno a π-quimotripsina, que es totalmente activa. Luego, la propia π-quimotripsina cataliza la liberación de dos dipéptidos con la formación de la δ-quimotripsina, una forma más estable de la enzima. δ-quimotripsina sufre dos cambios conformacionales, el primero de los cuales conduce a la formación de κ-quimotripsina, y el segundo de α-quimotripsina, la forma activa final de la enzima.
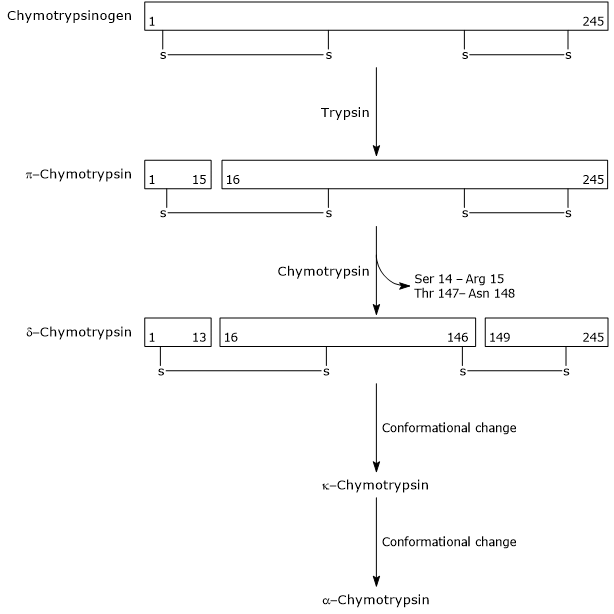
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.La elastasa, que es menos específica que las otras hidrolasas digestivas, cataliza la escisión de enlaces peptídicos adyacentes a aminoácidos como la glicina, la alanina y la serina.
- Procarboxipeptidasa
La procarboxipeptidasa A se activa a carboxipeptidasa A; la proteasa escinde enlaces peptídicos adyacentes a aminoácidos con cadenas laterales ramificadas o aromáticas, como fenilalanina y valina.La procarboxipeptidasa B se activa a carboxipeptidasa B, específica para aminoácidos con cadenas laterales básicas, como lisina y arginina.
Las proteasas mencionadas anteriormente, a diferencia de la pepsina, tienen un pH de acción óptimo que varía de 7 a 8, es decir, neutro o débilmente alcalino.
Inhibidor de tripsina pancreática
Existe un sistema de protección » adicional «contra la actividad intrapancreática de la tripsina: la síntesis de un inhibidor llamado»inhibidor de tripsina pancreática». La molécula, presente en los gránulos de zimógeno pancreático, es capaz de unirse muy estrechamente al sitio activo de la enzima inactivadora. De esta manera, la actividad de cualquier tripsina resultante de una activación prematura de tripsinógeno se bloquea, evitando una situación en la que unas pocas moléculas activadas activan todos los zimógenos pancreáticos.En las plantas, hay muchas moléculas con actividad similar. Un ejemplo es el inhibidor de la tripsina de Kunitz, una proteína que se encuentra principalmente en la soja, que forma un complejo muy estable con el sitio activo de la tripsina.
Dado que las proteasas mencionadas anteriormente tienen una especificidad de sustrato distinta, actuando sobre enlaces peptídicos adyacentes a diferentes aminoácidos, cada péptido generado por una proteasa puede ser sustrato de otro. De esta manera, las proteínas parcialmente digeridas que entran en el duodeno se hidrolizan eficientemente en aminoácidos libres y péptidos de 2-8 residuos. Estos péptidos son sustratos de aminopeptidasas secretadas por enterocitos y asociadas con sus microvellosidades.La dipeptidasa también está presente.Debe tenerse en cuenta que las mismas proteasas finalmente se digieren, finalizando el proceso.La importancia y eficacia de las enzimas proteolíticas en la digestión de proteínas intestinales se puede entender a partir de este ejemplo. Si desea hidrolizar in vitro una proteína en sus aminoácidos constituyentes, es necesario utilizar un ácido fuerte y concentrado como catalizador y calentar la muestra a 105 ° C durante la noche. En el intestino se obtiene el mismo resultado en cuestión de horas, operando primero en el ambiente relativamente ácido del estómago, y luego en las condiciones alcalinas suaves del duodeno, a 37 ° C.
Los aminoácidos liberados, junto con los di – y tri-péptidos, son absorbidos por los enterocitos. Los di-péptidos y los tri-péptidos generalmente se hidrolizan en aminoácidos constituyentes dentro de los enterocitos, y esto explica por qué prácticamente solo los aminoácidos libres están presentes en la circulación portal.
Bender D. A. Benders ‘ dictionary of nutrition and food technology (en inglés). 8ª Edición. Woodhead Publishing. Oxford, 2006
Bender D. A. Introducción a la nutrición y el metabolismo. 3rd Edition. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L., and Stryer L. Bioquímica. 5ª Edición. W. H. Freeman and Company, 2002
Bhagavan N. V., Ha C-E. Essentials of medical biochemistry: with clinical cases. 4th Edition. Academic Press, 2015
Cozzani I. y Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Principios de bioquímica. 4th Edition. W. H. Freeman and Company, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M. D., Glew R. H. Bioquímica médica: metabolismo humano en salud y enfermedad. John Wiley & Sons, INC., Publicación, 2009
Stipanuk M. H., Caudill M. A. Aspectos bioquímicos, fisiológicos y moleculares de la nutrición humana. 3rd Edition. Elsevier ciencias de la salud, 2013