proteiinin pilkkoutuminen: vaiheet, entsyymit ja hormonit
elimistö tarvitsee proteiineja ja erityisesti niiden sisältämiä välttämättömiä aminohappoja. Terveelle aikuiselle suositeltu päiväsaanti on 0,85 g/painokilo, joten 70-kiloiselle se on noin 60 g, mutta tyypillisessä länsimaisessa ruokavaliossa saanti on usein yli 100 g/vrk.
ravintoproteiinien lisäksi elimistö sulattaa myös 50-100 g endogeenisiä proteiineja, joita erittyy tai häviää ruoansulatuskanavan lumeniin ja jotka johtuvat:
- syljestä;
- mahaneste;
- haimaentsyymit ja muut eritteet;
- suolistosolut, jotka hilseilevät pois;
- proteiinit, jotka kulkeutuvat verenkierrosta suolen lumeen.
tämä seos pilkkoutuu ja imeytyy tehokkaasti pohjukaissuoleen, ohutsuolen ensimmäiseen ja lyhimpään osaan, ja päivittäinen ulostehäviö vastaa noin 1, 6 g typpeä, mikä vastaa 10 g proteiinia. Paksusuolen mikrobisto käyttää suurimman osan menetetystä typestä kasvuunsa, ja näin sitä löytyy ulosteesta osana bakteerimassaa.
sisältö
mahan ja proteiinin digestio
- proteiinin digestio ja pepsiini
- haiman tsymogeenien aktivoituminen
- haiman trypsiinin estäjä
- endopeptidaasit, jotka hydrolysoivat peptidisidoksia polypeptidiketjun sisällä ja joita tuottavat vatsa ja eksokriininen haima;
- eksopeptidaasit, jotka voidaan jakaa kahteen ryhmään:
- limaiset kaulasolut, jotka tuottavat limaa;
- pääsolut, jotka vapauttavat pepsinogeeniä.
- trypsinogeeni, kymotrypsinogeeni ja proelastaasi, endopeptidaasit, joilla on erilainen substraattispesifisyys pepsiiniin verrattuna, mutta myös niiden joukossa;
- prokarboksipeptidaasi A ja B, eksopeptidaasit, jotka poistavat aminohappoja peptidien C-terminaalisesta päästä.
- kymotrypsiinin aktivoituminen kymotrypsiiniksi tapahtuu eri vaiheiden kautta, joihin trypsiini ja itse aktivoitunut kymotrypsiini osallistuvat.
ensimmäisessä vaiheessa trypsiini katalysoi tietyn peptidisidoksen pilkkoutumista, ja tämä aiheuttaa kymotrypsinogeenin aktivoitumisen π-kymotrypsiiniksi, joka on täysin aktiivinen. Tämän jälkeen π-kymotrypsiini itse katalysoi kahden dipeptidin vapautumista muodostaen δ-kymotrypsiinin, joka on entsyymin stabiilimpi muoto. δ-kymotrypsiini käy läpi kaksi konformaatiomuutosta, joista ensimmäinen johtaa κ-kymotrypsiinin muodostumiseen ja toinen α-kymotrypsiinin, joka on entsyymin viimeinen aktiivinen muoto.
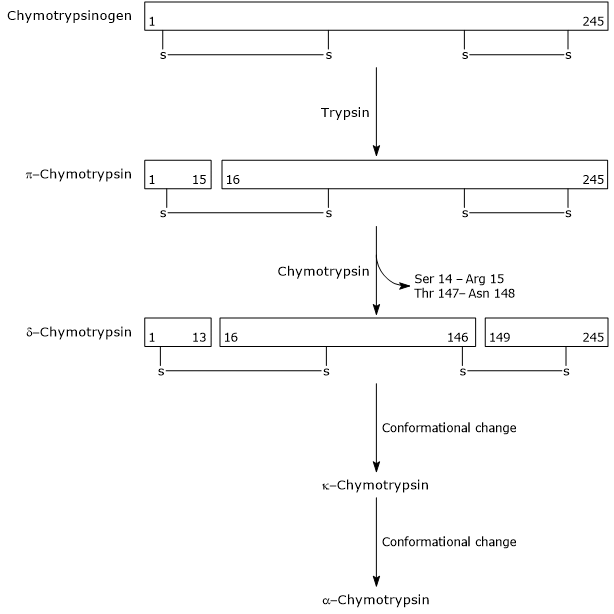
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
elastaasi, joka on vähemmän spesifinen kuin muut ruoansulatushydrolaasit, katalysoi aminohappojen kuten glysiinin, alaniinin ja seriinin viereisten peptidisidosten pilkkoutumista. - Prokarboksipeptidaasi
Prokarboksipeptidaasi a aktivoituu karboksipeptidaasi A: ksi; proteaasi pilkkoo aminohappojen viereisiä peptidisidoksia haaroittuneilla tai aromaattisilla sivuketjuilla, kuten fenyylialaniinilla ja valiinilla.
Prokarboksipeptidaasi B aktivoituu karboksipeptidaasi B: ksi, joka on spesifinen aminohapoille, joilla on emäksiset sivuketjut, kuten lysiini ja arginiini.
pohjukaissuolen ja proteiinin digestio
/li>
ruoansulatusentsyymit
proteiinin pilkkoutuminen tapahtuu polypeptidiketjun yksittäisiä aminohappoja sitovien peptidisidosten hydrolyysin seurauksena. Näitä reaktioita katalysoivat proteaaseiksi kutsutut entsyymit.
aminohapon sivuketjulle ominaiset suoliproteaasit ovat hydrolaaseja, jotka voidaan jakaa kahteen luokkaan:
karboksipeptidaasi, joka poistaa aminohappoja C-terminaalisesta päästä ja syntyy eksokriininen haima;
aminopeptidaasi, joka toimii n-terminaalisessa päässä ja jota enterosyytit tuottavat.

nämä entsyymit syntetisoidaan ja eritetään inaktiivisessa muodossa, joita kutsutaan tsymogeeneiksi tai proentsyymeiksi.
solun sisällä tsymogeenit varastoituvat kalvon rajaamien rakeiden eli tsymogeenirakeiden sisään. Kun spesifinen signaali stimuloi solua, rakekalvo fuusioituu plasmakalvon kanssa ja tsymogeenit vapautuvat eksosytoosilla.
nämä proteaasit syntetisoidaan inaktiivisessa muodossa, jotta ne eivät ennen erittymistään sulattaisi itseään ja/tai kudosproteiineja. Tapahtuu niin, että entsyymin aktiivinen kohta on ”naamioitu” ja vasta aktivoinnin jälkeen proteiini voi vaikuttaa substraattiin. Aktivaatio on seurausta yhden tai useamman spesifisen peptidisidoksen pilkkoutumisesta tietyn entsyymin katalysoimana, jolloin vapautuu yksi tai useampi polypeptidiketjun segmentti. Näin molekyyli voi olettaa kolmiulotteisen konformaation, jossa aktiivinen kohta on vapaa ja oikein konfiguroitu.
jo niiden kertyminen rakeisiin on suojajärjestelmä: se eristää ne muista solussa olevista molekyyleistä.
useimmat alkuperäisen konformaationsa proteiinit ovat vastustuskykyisiä proteaasien vaikutukselle. Tämä on seurausta niiden sekundäärisestä ja tertiäärisestä eli natiivista rakenteesta, joka peittää monet sidokset entsyymien toimintaan. Näitä rakenteita stabiloivat kovalenttiset sidokset, kuten kysteiinijäämien väliset disulfidisillat, ja ei-kovalenttiset voimat, kuten ioniset vuorovaikutukset, vetysidokset ja van der Waalsin voimat.
riittävän proteiinin pilkkoutumisen kannalta onkin oleellista, että peptidisidokset ovat mahdollisimman helposti suoliston proteaasien vaikutuspiirissä. Tämä saavutetaan kehon ulkopuolella ruoan keittämisen kautta ja kehossa vatsan happaman ympäristön avulla.
rooli ruoan kypsentämisessä ja pureskelussa
ruoan kypsentäminen, kun se ei ole liiallista, helpottaa proteiinin pilkkoutumista.
millä tavalla?
kuten kaikki molekyylit, eivät myöskään proteiinit ole liikkumattomia vaan värähtelevät. Lämpötilan noustessa proteiinit värähtelevät suuremmalla amplitudilla, jopa tuhotakseen natiivin rakenteen ylläpitoon osallistuvat nonkovalentit sidokset. Siksi proteiinissa tapahtuu konformaatiomuutos eli molekyyli denaturoituu. Tämä voi tehdä sisäisistä peptidisidoksista helpommin ruuansulatusentsyymien vaikutukselle.
jopa ruoan pureskelu ja insalivointi homogenoivat ja kostuttavat itse ruoan kiinteät komponentit, mikä helpottaa mahalaukun ja ohutsuolen ruoansulatusta.
proteiinien pilkkoutumisen vaiheet
proteiinien pilkkoutumiseen liittyy kaksi vaihetta: ensimmäinen tapahtuu mahalaukussa ja toinen pohjukaissuolessa, ohutsuolen alkuosassa.
mahan ja proteiinin digestio
proteiinin digestio alkaa mahalaukusta, ja tämä on ”valmisteluvaihe” verrattuna pohjukaissuolessa tapahtuviin tapahtumiin.
ruoan läsnäolo vatsassa stimuloi mahalaukun limakalvon ja proksimaalisen pohjukaissuolen g-soluja tuottamaan ja vapauttamaan gastriini-hormonia verenkiertoon. Hormoni stimuloi parietaalisoluja asianmukaisen maharauhasten, lokalisoitu enimmäkseen alareunassa elimen, tuottaa ja erittää suolahappoa vatsaan (parietaalisolut tuottavat myös luontainen tekijä, proteiini, joka sitoo B12-vitamiinia, estää sen tuhoutumisen ja mahdollistaa sen imeytymisen).
oikeista mahan rauhasista löytyi myös:
kaikki nämä aineet yhdessä muiden kuten kaliumionien ja mahalaukun lipaasin kanssa ovat mahanesteessä, jonka pH on välillä 1-2, 5.
alhaisen pH-arvonsa vuoksi mahanesteellä on antiseptinen vaikutus, joka tappaa useimmat bakteerit ja muut vieraat solut, ja denaturoiva vaikutus, koska se rikkoo proteiinien alkuperäistä rakennetta ylläpitäviä ei-vaalentteja sidoksia. Tämä denaturoiva vaikutus helpottaa suoliston proteaasin pääsyä peptidisidoksiin, kuten kuumennusta keittämisen aikana. Jotkut proteiinit, joissa on runsaasti disulfidisidoksia, kuten keratiinit, kestävät denaturaatiota alhaisen pH: n vuoksi ja ovat siksi vaikeasti sulavia. Päinvastoin suurin osa pallomaisista proteiineista hydrolysoituu lähes kokonaan aminohapoiksi.
lopulta mahanesteen alhainen pH aktivoi tsymogeeniin kuuluvan pepsinogeenin pepsiiniksi, joka on ensimmäinen proteiinin pilkkomiseen osallistuva entsyymi.
proteiinin digestio ja pepsiini
pepsinogeenistä on olemassa erilaisia isoentsyymejä, kuten tyyppi I, joka syntetisoidaan mahan solujen ja silmänpohjan solujen avulla, ja tyyppi II, jota tuotetaan kaikilla elimen alueilla. Kaikki isoentsyymit muuntuvat aktiiviseksi entsyymiksi. Aktivaatio tapahtuu autokatalyysin avulla, kun pH-arvo on alle 5, intramolekulaarisessa prosessissa, joka koostuu spesifisen peptidisidoksen hydrolyysistä ja pienen peptidin vapautumisesta proentsyymin n-terminaalisesta päästä. Tämä peptidi sitoutuu edelleen entsyymiin ja toimii edelleen inhibiittorina, kunnes pH laskee alle 2: n tai kunnes pepsiini itse hajottaa sen edelleen. Kun siis osa pepsiinistä on muodostunut, tämä aktivoi nopeasti muita pepsinogeenimolekyylejä.
pepsiini, endopeptidaasi, jonka optimaalinen pH on 1,6, hydrolysoi 10-20% aterian proteiineista. Monet ruoansulatusentsyymit kykenevät toimimaan monenlaisilla substraateilla, eikä pepsiini ole poikkeus, sillä se katalysoi aminohappojäämien, kuten leusiinin ja fenyylialaniinin, tyrosiinin ja tryptofaanin (aromaattiset aminohapot), viereisten peptidisidosten pilkkoutumista. Syntyy suurikokoisten peptidien ja muutaman vapaan aminohapon seos.
pepsiinin vaikutus ei ole tärkeä niinkään sen suoran vaikutuksen vuoksi proteiinien pilkkoutumiseen, joka on vaatimatonta, vaan peptidien ja aminohappojen vapautumisen kannalta, jotka pohjukaissuolen tasolla stimuloivat kolekystokiniinin eritystä ja siten pohjukaissuolen/haiman vaihetta proteiinin pilkkoutumisessa (KS.alla).
on huomattava, että pepsiinin vaikutus kollageeniin, proteiiniperheeseen, joka kietoutuu lihassolujen ympärille ja pitää ne koossa, helpottaa haiman proteaasin pääsyä ateriaproteiineihin.
pohjukaissuolen ja proteiinin digestio
kun mahalaukun sisältö siirtyy pohjukaissuoleen, sen happamuus stimuloi pohjukaissuolen limakalvossa ja jejunumin proksimaalisessa osassa (ohutsuolen seuraavassa osassa) sijaitsevia s-soluja tuottamaan ja vapauttamaan verenkierrossa sekretiiniä. Hormoni aiheuttaa alkalisen haimamehun erityksen, jossa on runsaasti bikarbonaatti-ioneja mutta huonosti entsyymejä ja joka kulkee pohjukaissuoleen haimakanavan kautta. Pohjukaissuolessa se neutraloi mahalaukun tuottaman suolahapon nostaen pH: n noin 7: ään (neutraalille tasolle). Sekretiini myös stimuloi sapen eritystä ja vähentää gastriinin vapautumista.
aminohappojen läsnäolo pohjukaissuolessa stimuloi, kuten edellä mainittiin, pohjukaissuolen ja jejunumin endokriinisiä soluja tuottamaan ja vapauttamaan kolekystokiniinia (CKK) verenkiertoon. Hormoni muun muassa stimuloi eksokriinistä haimaa erittämään mehua, joka sisältää runsaasti entsyymejä (esiintyy tsymogeeneinä), joka on:
siksi pohjukaissuolessa on neutraali ympäristö, jossa on runsaasti entsyymejä, jotka pystyvät aktivoituessaan jatkamaan proteiinien pilkkoutumista. Lisäksi, koska proteaasilla on erilainen substraattispesifisyys, jokainen entsyymin tuottama peptidi voi olla toisen entsyymin substraatti.
haimamehussa esiintyy myös amylaasia, lipaasia ja nukleaasia.
haiman tsymogeenien aktivointi
ensimmäinen ja tärkein vaihe niiden aktivoinnissa on trypsinogeenin muuntaminen trypsiiniksi enteropeptidaasilla (jota kutsutaan myös enterokinaasiksi), endopeptidaasilla, jota pohjukaissuolen solut tuottavat kolekystokiniinistimulaation jälkeen. Enteropeptidaasi katalysoi spesifisen peptidisidoksen pilkkoutumista trypsinogeenin lysiinijäämän ja isoleusiinijäämän välillä vapauttaen heksapeptidin. Tämä aiheuttaa sitä aktivoivan proteiinin konformaation uudelleenjärjestelyn, eli muodostuu trypsiiniä.
entsyymi pilkkoo proteiinijäämien lysiinin ja arginiinijäämien viereisiä peptidisidoksia sulattaakseen; lisäksi se voi aktivoida kymotrypsinogeenia, proelastaasia ja prokarboksipeptidaasi A: ta ja B: tä, mutta myös muita trypsinogeenimolekyylejä, kuten pepsiiniä (autokatalyysi).
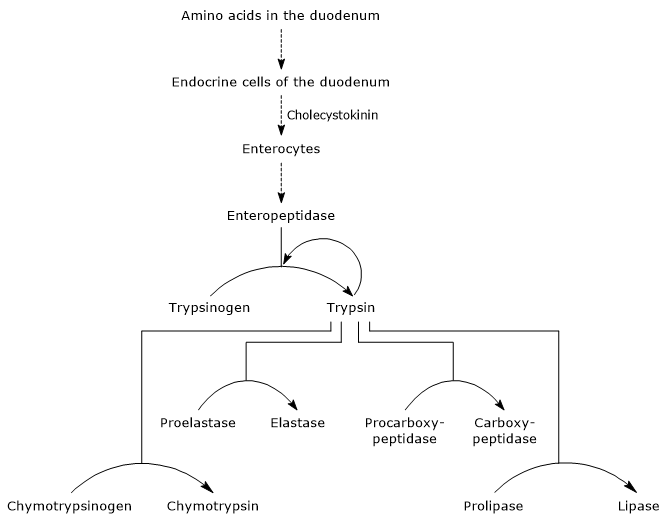
siksi pohjukaissuolen kyky sulattaa proteiineja kasvaa haiman tsymogeenien aktivoituessa, minkä kaiken laukaisee pieni määrä enteropeptidaasia.
edellä mainittujen proteaasien, toisin kuin pepsiinin, optimaalinen pH-arvo on välillä 7-8 eli neutraali tai heikosti emäksinen.
haiman trypsiinin inhibiittori
on olemassa ”ylimääräinen” suojajärjestelmä kansantaudin sisäistä trypsiinin aktiivisuutta vastaan: inhibiittorin synteesi nimeltään ”haiman trypsiinin inhibiittori”. Haiman tsymogeenirakeissa oleva molekyyli kykenee sitoutumaan hyvin tiiviisti sen inaktivoivan entsyymin aktiiviseen kohtaan. Näin minkä tahansa trypsiinin toiminta, joka johtuu trypsinogeenin ennenaikaisesta aktivoitumisesta, estyy estäen tilanteen, jossa muutamat aktivoidut molekyylit aktivoivat kaikki haiman tsymogeenit.
kasveissa on monia molekyylejä, joilla on samankaltainen aktiivisuus. Yksi esimerkki on Kunitz trypsiinin inhibiittori, proteiini, jota esiintyy pääasiassa soijapavuissa, joka muodostaa erittäin stabiilin kompleksin trypsiinin aktiivisen kohdan kanssa.
koska edellä mainituilla proteaasilla on erillinen substraattispesifisyys, joka vaikuttaa eri aminohappojen viereisiin peptidisidoksiin, jokainen proteaasin tuottama peptidi voi olla toisen substraatti. Näin pohjukaissuoleen päätyvät osittain pilkkoutuneet proteiinit hydrolysoituvat tehokkaasti 2-8 jäämän vapaiksi aminohapoiksi ja peptideiksi. Nämä peptidit ovat enterosyyteistä erittyvien aminopeptidaasien substraatteja, jotka liittyvät niiden mikrovilleihin.
dipeptidaaseja esiintyy myös.
on huomattava, että samat proteaasit lopulta pilkkoutuvat, jolloin prosessi päättyy.
tästä esimerkistä voidaan ymmärtää proteolyyttisten entsyymien merkitys ja tehokkuus suoliston proteiinin pilkkoutumisessa. Jos in vitro haluat hydrolysoida proteiinin sen aminohapoiksi, on välttämätöntä käyttää voimakasta ja väkevää happoa katalyyttinä ja kuumentaa näyte 105 ° C: ssa yön yli. Suolistossa sama tulos saadaan muutamassa tunnissa, toimimalla ensin mahalaukun suhteellisen happamassa ympäristössä ja sitten pohjukaissuolen lievissä emäksisissä olosuhteissa 37 °C: ssa.
vapautuneet aminohapot yhdessä di – ja tri-peptidien kanssa imeytyvät enterosyytteihin. Di-ja tri-peptidit hydrolysoituvat yleensä enterosyyttien sisältämiksi aminohapoiksi, ja tämä selittää sen, miksi portaalikierroksessa on käytännössä vain vapaita aminohappoja.
Bender D. A. Benders’ dictionary of nutrition and food technology. 8. painos. Woodhead Publishing. Oxford, 2006
Bender D. A. Introduction to nutrition and metabolism. 3. painos. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L. ja Stryer L. Biokemia. 5. Painos. W. H. Freeman and Company, 2002
Bhagavan N. V., Ha C-E. Essentials of medical biochemistry: with clinical cases. 4. painos. Academic Press, 2015
Cozzani I. and Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Biokemian periaatteet. 4. painos. W. H. Freeman and Company, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M. D., Glew R. H. Medical Biochemistry: human metabolism in health and disease. John Wiley & Sons, INC., Julkaisu, 2009
Stipanuk M. H., Caudill M. A. Biochemical, physiological, and molecular aspects of human nutrition. 3. painos. Elsevier health sciences, 2013