trávení Bílkovin: kroky, enzymy a hormony
tělo potřebuje bílkoviny, a zejména esenciálních aminokyselin v nich obsažených. Doporučený denní příjem pro zdravého dospělého předmět je 0.85 g/kg tělesné hmotnosti, tak pro osobu o hmotnosti 70 kg je asi 60 g, ale často v typické Západní stravě je příjem větší než 100 g/den.
kromě potravinových bílkovin tělo také tráví 50-100 g endogenních proteinů vylučovaných nebo ztracených do lumen gastrointestinálního traktu a které jsou výsledkem:
- slin;
- žaludeční šťávy;
- pankreatických enzymů a jiných sekretů;
- střevní buňky, které odlupovat;
- proteiny, které přecházejí do lumen střeva z krevního řečiště.
Tato směs je efektivně stravitelné a vstřebává v dvanáctníku, první a nejkratší část tenkého střeva, s denní ztrátou přes stolici rovná asi 1,6 g dusíku, což odpovídá 10 g bílkovin. Většina ztraceného dusíku je používána mikroflórou v tlustém střevě pro její růst, a proto se nachází ve stolici jako součást bakteriální hmoty.
OBSAH
- Trávicí enzymy
- Úloha vaření a žvýkání potravy
- Fáze trávení bílkovin
- Žaludek a trávení bílkovin
- trávení Bílkovin a pepsinu
- Dvanáctníku a trávení bílkovin
- Aktivace pankreatických zymogens
- Slinivky břišní trypsin inhibitoru
- Žaludek a trávení bílkovin
Trávicí enzymy
trávení Bílkovin dochází v důsledku hydrolýzy peptidové vazby, které se vážou na jednotlivé aminokyseliny do polypeptidového řetězce. Tyto reakce jsou katalyzovány enzymy nazývanými proteázy.
střevní proteázy, specifické pro amino kyselina postranní řetězce, jsou hydrolázy, které mohou být rozděleny do dvou skupin:
- endopeptidases, které rozpouštějí peptidové vazby uvnitř polypeptidového řetězce, a jsou produkovány v žaludku a exokrinní pankreas;
- exopeptidázy, které mohou být rozděleny do dvou skupin:
karboxypeptidázy, které odstranit aminokyselin z C-terminální konec, a jsou produkovány exokrinní pankreas;
aminopeptidáza, která působí na n-koncový konec a je produkována enterocyty.

Tyto enzymy jsou syntetizovány a vylučovány v neaktivní formě, tzv. zymogens nebo proenzymes.
v buňce jsou zymogeny uloženy uvnitř membránově ohraničených granulí nazývaných zymogen granule. Když je buňka stimulována specifickým signálem, membrána granulí se spojí s plazmatickou membránou a zymogeny se uvolňují exocytózou.
Tyto proteázy jsou syntetizovány v neaktivní formě, aby se zabránilo tomu, že před vylučováním tráví sebe a / nebo tkáňové proteiny. Co se stane, je, že aktivní místo enzymu je „maskované“ a teprve po aktivaci může protein působit na substrát. Aktivace je výsledkem štěpení, katalyzovaného specifickým enzymem, jedné nebo více specifických peptidových vazeb, s uvolněním jednoho nebo více segmentů polypeptidového řetězce. To umožňuje molekule předpokládat trojrozměrnou konformaci, ve které je aktivní místo volné a správně nakonfigurované.
i jejich akumulace v granulích je ochranným systémem: izoluje je od ostatních molekul přítomných v buňce.
většina proteinů v jejich přirozené konformaci je odolná vůči působení proteáz. Je to důsledek jejich sekundární a terciární nebo nativní struktury, která maskuje mnoho vazeb na působení enzymů. Tyto struktury jsou stabilizována kovalentními vazbami, jako jsou disulfidové můstky mezi zbytky cysteinu, a non-kovalentní síly, jako jsou iontové interakce, vodíkové vazby a van der Waalsovy síly.
pro adekvátní trávení bílkovin je proto nezbytné, aby peptidové vazby byly co nejvíce přístupné působení střevních proteáz. Toho je dosaženo mimo tělo vařením jídla a uvnitř těla kyselým prostředím v žaludku.
Role vaření a žvýkání jídla
vaření jídla, pokud není nadměrné, usnadňuje trávení bílkovin.
jakým způsobem?
stejně jako všechny molekuly, i proteiny nejsou nehybné, ale vibrují. Jak se teplota zvyšuje, proteiny vibrují při větší amplitudě, až do zničení nekovalentních vazeb, které přispívají k udržení nativní struktury. Proto dochází ke konformační změně proteinu, to znamená, že molekula je denaturována. To může zpřístupnit vnitřní peptidové vazby působení trávicích enzymů.
dokonce i žvýkání a insalivace potravin homogenizuje a zvlhčuje pevné složky samotné potraviny, což usnadňuje trávení žaludku a tenkého střeva.
Fázích trávení bílkovin
Dvou fázích se podílí na trávení bílkovin: první se vyskytuje v žaludku, a druhý v dvanácterníku, první část tenkého střeva.
Žaludek a trávení bílkovin
trávení Bílkovin začíná v žaludku, a to je „přípravné fázi“ ve srovnání s událostmi, které se vyskytují v dvanáctníku.
přítomnost potravy v žaludku stimuluje G buňky sliznice žaludečního antra a proximální duodenum k výrobě a uvolňování hormonu gastrinu v krvi. Hormon stimuluje parietální buňky vlastní žlázky žaludeční, lokalizované především v dolní části orgánů, aby produkují a vylučují kyseliny chlorovodíkové do žaludku (parietální buňky také produkují vnitřní faktor, protein, který váže vitamin B12, brání jeho zničení a která umožňuje, aby se vstřebává).
ve správných žaludečních žlázách jste také našli:
- slizniční krční buňky, které produkují hlen;
- hlavní buňky, které uvolňují pepsinogen.
Všechny tyto látky, spolu s ostatními, jako jsou ionty draslíku a žaludeční lipázy, jsou přítomny v žaludeční šťávy, která má pH, které se pohybuje mezi 1 a 2,5.
díky nízkému pH má žaludeční šťáva antiseptický účinek, zabíjí většinu bakterií a dalších cizích buněk a denaturační účinek, protože porušuje nekovalentní vazby, které udržují nativní strukturu proteinů. Tento denaturační účinek usnadňuje přístup střevní proteázy k peptidovým vazbám, jako je zahřívání během vaření. Některé proteiny bohaté na disulfidové vazby, jako jsou keratiny, jsou odolné vůči denaturaci nízkým pH, a proto jsou obtížně stravitelné. Naopak, většina globulárních proteinů je téměř úplně hydrolyzována na základní aminokyseliny.
a Konečně, nízké pH žaludeční šťávy, aktivuje pepsinogen, zymogen, pepsin, první enzym podílející se na trávení bílkovin.
trávení Bílkovin a pepsinu
Existují různé izoenzymy pepsinogen, jako je typ I, syntetizován v buňkách těla a fundu žaludku, a typ II, který se vyrábí ve všech regionech orgánu. Všechny izoenzymy jsou převedeny na aktivní enzym. K aktivaci dochází prostřednictvím autocatalysis, při hodnotách pH pod 5, intramolekulární proces spočívá v hydrolýze specifické peptidové vazby a uvolnění malého peptidu z N-terminálního konce proenzym. Tento peptid zůstává vázán na enzym a nadále působí jako inhibitor, dokud pH neklesne pod 2, nebo dokud není dále degradován samotným pepsinem. Jakmile se vytvoří nějaký pepsin, rychle se aktivuje další molekuly pepsinogenu.
pepsin, endopeptidáza s optimálním pH aktivity při 1,6, hydrolyzuje 10-20% bílkovin v jídle. Mnoho trávicích enzymů, které jsou schopné působit na širokou škálu substrátů, a pepsinu není výjimkou, katalyzující štěpení peptidové vazby přilehlé k aminokyselinových zbytků, jako jsou leucin a fenylalanin, tyrosin a tryptofan (aromatické aminokyseliny). Vyrábí se směs peptidů velké velikosti a několika volných aminokyselin.
Pepsin akce je důležité ani ne tak pro jeho přímý příspěvek k trávení bílkovin, který je skromný, ale pro uvolnění peptidů a aminokyselin, které, na dvanáctníku úrovni, stimulovat sekreci cholecystokininu, a proto duodenální/slinivky fáze trávení bílkovin (viz níže).
je třeba poznamenat, že působení pepsinu na kolagen, rodinu proteinů, které obalují a drží pohromadě svalové buňky, usnadňuje přístup pankreatické proteázy k bílkovinám jídla.
Dvanáctníku a trávení bílkovin
Když obsah žaludku přechází do dvanáctníku, jeho kyselost stimuluje Y buňky, lokalizované v duodenální sliznici a v proximální části jejuna (další část tenkého střeva), k produkci a uvolňování hormonů sekretin do krevního řečiště. Hormon způsobuje sekreci alkalické pankreatické šťávy, bohaté na hydrogenuhličitan ionty a chudé na enzymy, které přechází do dvanáctníku prostřednictvím pankreatického vývodu. V dvanáctníku neutralizuje kyselinu chlorovodíkovou produkovanou žaludkem a zvyšuje pH na přibližně 7 (neutrální hladiny). Sekretin také stimuluje sekreci žluči a snižuje uvolňování gastrinu.
přítomnost aminokyselin v dvanáctníku stimuluje, jak bylo uvedeno výše, endokrinní buňky v dvanáctníku a jejunu k produkci a uvolňování cholecystokininu (CKK) do krevního řečiště. Hormon mimo jiné stimuluje exokrinní pankreas k vylučování šťávy bohaté na enzymy (přítomné jako zymogeny), tj.:
- trypsinogen, chymotrypsinogen a proelastase, endopeptidases s různými substrátová specificita ve srovnání s pepsinem, ale i mezi nimi;
- procarboxypeptidase a a B, exopeptidázy, které odstraní aminokyselin z C-konci peptidů.
proto je v dvanáctníku neutrální prostředí bohaté na enzymy schopné pokračovat, jakmile je aktivováno, trávení bílkovin. Navíc, protože proteázy mají odlišnou substrátovou specificitu, může být každý peptid produkovaný enzymem substrátem jiného enzymu.
v pankreatické šťávě jsou také přítomny amyláza, lipáza a nukleáza.
Aktivace pankreatických zymogens
první a hlavní krok v jejich aktivace je přeměna trypsinogen na trypsin tím, enteropeptidase (také volal enterokinázou), endopeptidase produkován buňkami duodena po cholecystokinin stimulace. Enteropeptidase katalyzuje štěpení specifické peptidové vazby mezi lysin reziduí a isoleucin zbytek trypsinogen, s vydáním hexapeptidu. To způsobuje konformační přeskupení proteinu, který ho aktivuje, to znamená, že se tvoří trypsin.
enzym štěpí peptidové vazby přilehlé k lysin a arginin zbytky bílkovin stravitelné, navíc, to může aktivovat chymotrypsinogen, proelastase a procarboxypeptidase a a B, ale i další molekuly trypsinogen, stejně jako pepsin (autocatalysis).
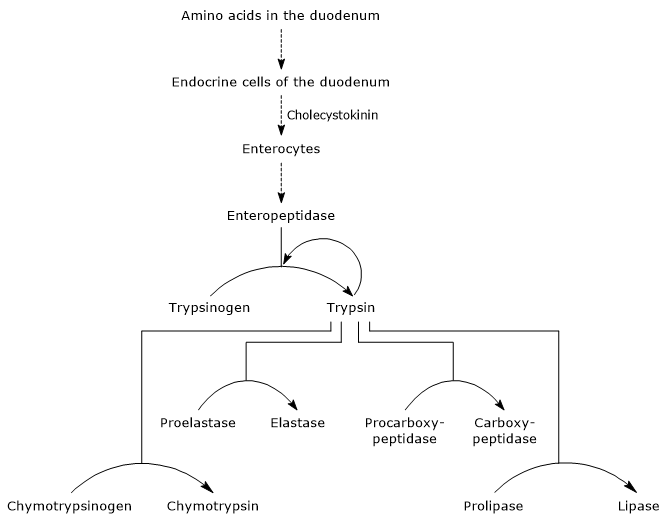
Proto, schopnosti dvanáctníku stravitelné bílkoviny se zvyšuje, stejně jako slinivky břišní zymogens jsou aktivovány, spouští malé množství enteropeptidase.
- k aktivaci chymotrypsinogenu na chymotrypsin dochází různými kroky, kterých se účastní trypsin a samotný aktivovaný chymotrypsin.
V prvním kroku, trypsin katalyzuje štěpení specifické peptidové vazby, a to způsobí aktivaci chymotrypsinogen na π-chymotrypsin, který je plně aktivní. Poté π-chymotrypsin sám katalyzuje uvolňování dvou dipeptidů tvorbou δ-chymotrypsinu, stabilnější formy enzymu. δ-Chymotrypsin prochází dva konformační změny, z nichž první vede k tvorbě κ-chymotrypsin, a druhý α-chymotrypsin, poslední aktivní formu enzymu.
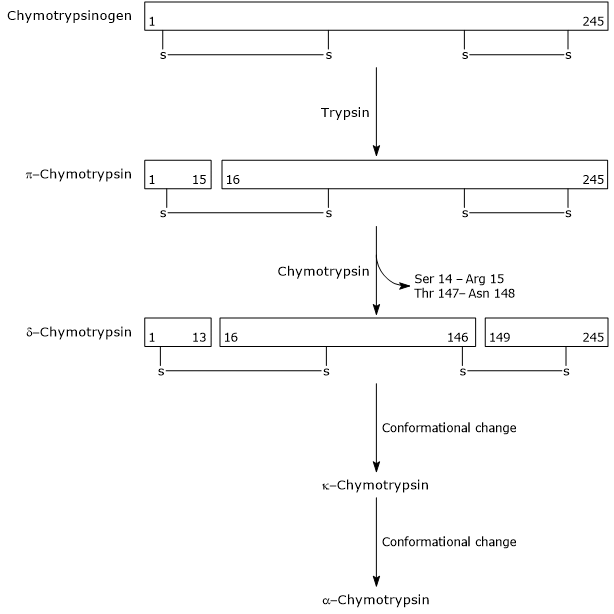
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
elastáza, která je méně specifická než ostatní trávicí hydrolázy, katalyzuje štěpení peptidových vazeb sousedících s aminokyselinami, jako je glycin, alanin a serin. - Procarboxypeptidase
Procarboxypeptidase je aktivován na karboxypeptidázy A, proteázy štěpí peptidové vazby sousedící aminokyseliny s rozvětveným nebo aromatických postranních řetězců, jako je fenylalanin a valin.
Procarboxypeptidase B je aktivován karboxypeptidáza B, specifické pro aminokyseliny se základními straně řetězců, jako je lysin a arginin.
výše uvedené proteázy mají na rozdíl od pepsinu optimální pH účinku v rozmezí od7 do 8, tj. neutrální nebo slabě alkalické.
pankreatický inhibitor trypsinu
existuje“ dodatečný „ochranný systém proti intrapankreatické aktivitě trypsinu: syntéza inhibitoru nazývaného „pankreatický inhibitor trypsinu“. Molekula přítomná v granulích pankreatického zymogenu je schopna velmi těsně vázat Aktivní místo enzymu, který ji inaktivuje. Tímto způsobem je blokována aktivita jakéhokoli trypsinu v důsledku předčasné aktivace trypsinogenu, což zabraňuje situaci, kdy několik aktivovaných molekul aktivuje všechny pankreatické zymogeny.
v rostlinách existuje mnoho molekul s podobnou aktivitou. Příkladem je inhibitor trypsinu Kunitz, protein nacházející se hlavně v sójových bobech, který tvoří velmi stabilní komplex s aktivním místem trypsinu.
Od výše zmíněných proteáz mají odlišné substrátové specifičnosti, působící na peptidové vazby přilehlé k různých aminokyselin, každý peptid generované proteázy může být substrát další. Tímto způsobem jsou částečně trávené proteiny, které vstupují do dvanáctníku, účinně hydrolyzovány na volné aminokyseliny a peptidy 2-8 zbytků. Tyto peptidy jsou substráty aminopeptidáz vylučovaných z enterocytů a spojených s jejich mikrovily.
dipeptidáza jsou také přítomny.
je třeba poznamenat, že stejné proteázy jsou nakonec tráveny a ukončují proces.
význam a účinnost proteolytických enzymů při trávení střevních bílkovin lze pochopit z tohoto příkladu. Pokud chcete in vitro hydrolyzovat protein na jeho aminokyseliny, je nutné použít silnou a koncentrovanou kyselinu jako katalyzátor a zahřívat vzorek na 105 ° C přes noc. Ve střevech stejný výsledek je získán během několika hodin, provozní nejprve v relativně kyselé prostředí žaludku, a pak v mírné alkalickém prostředí dvanáctníku, při 37 °C.
uvolněné aminokyseliny spolu s di-a tri-peptidy jsou absorbovány enterocyty. Di-a tri-peptidy jsou obvykle hydrolyzovány na základní aminokyseliny v enterocytech, což vysvětluje, proč jsou v portální cirkulaci přítomny prakticky pouze volné aminokyseliny.
Bender D. a. Benders‘ dictionary of nutrition and food technology. 8. vydání. Woodhead Publishing. Oxford, 2006
Bender D. a. úvod do výživy a metabolismu. 3. vydání. Taylor & Francis, 2004
Berg J. M., Tymoczko jl, Stryer L. Biochemie. 5. vydání. W. h. Freeman a společnost, 2002
Bhagavan n. v., Ha C-E. Základy lékařské biochemie: s klinickými případy. 4. vydání. Academic Press, 2015
Cozzani I.and Dainese e. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Principy biochemie. 4. vydání. W. h. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990,
Rosenthal, M. D., Glew R. H. Lékařské Biochemie: lidský metabolismus ve zdraví a nemoci. John Wiley & Sons, INC., Publikace, 2009
Stipanuk M.H., Caudill m. a. biochemické, fyziologické a molekulární aspekty lidské výživy. 3. vydání. Elsevier health sciences, 2013