Digestion des protéines: étapes, enzymes et hormones
L’organisme a besoin de protéines, et en particulier des acides aminés essentiels qu’elles contiennent. L’apport quotidien recommandé pour un sujet adulte en bonne santé est de 0,85 g / kg de poids corporel, donc pour une personne de 70 kg, c’est environ 60 g, mais souvent dans le régime occidental typique, l’apport est supérieur à 100 g / jour.
En plus des protéines alimentaires, le corps digère également 50 à 100 g de protéines endogènes sécrétées ou perdues dans la lumière du tractus gastro-intestinal, et qui résultent de:
- salive;
- suc gastrique;
- enzymes pancréatiques et autres sécrétions;
- cellules intestinales qui s’écaillent;
- protéines qui passent dans la lumière intestinale de la circulation sanguine.
Ce mélange est efficacement digéré et absorbé dans le duodénum, la première et la plus courte partie de l’intestin grêle, avec une perte quotidienne par les fèces égale à environ 1,6 g d’azote, équivalent à 10 g de protéines. La majeure partie de l’azote perdu est utilisée par la microflore du côlon pour sa croissance et se trouve donc dans les fèces dans le cadre de la masse bactérienne.
CONTENU
- Enzymes digestives
- Rôle de la cuisson et de la mastication des aliments
- Étapes de la digestion des protéines
- Digestion de l’estomac et des protéines
- Digestion des protéines et de la pepsine
- Digestion du duodénum et des protéines
- Activation des zymogènes pancréatiques
- Inhibiteur de la trypsine pancréatique
- Digestion de l’estomac et des protéines
- >
Enzymes digestives
La digestion des protéines se produit à la suite de l’hydrolyse des liaisons peptidiques qui lient les acides aminés individuels dans la chaîne polypeptidique. Ces réactions sont catalysées par des enzymes appelées protéases.
Les protéases intestinales, spécifiques de la chaîne latérale des acides aminés, sont des hydrolases qui peuvent être divisées en deux classes:
- les endopeptidases, qui hydrolysent les liaisons peptidiques au sein de la chaîne polypeptidique, et sont produites par l’estomac et le pancréas exocrine;
- les exopeptidases, qui peuvent être divisées en deux groupes:
la carboxypeptidase, qui élimine les acides aminés de l’extrémité C-terminale, et sont produites par le pancréas exocrine;
les aminopeptidases, qui agissent sur l’extrémité N-terminale, et sont produites par les entérocytes.

Ces enzymes sont synthétisées et sécrétées sous une forme inactive, appelée zymogènes ou proenzymes.
Au sein de la cellule, les zymogènes sont stockés à l’intérieur de granules membranaires appelés granules de zymogène. Lorsque la cellule est stimulée par le signal spécifique, la membrane granulaire fusionne avec la membrane plasmique et les zymogènes sont libérés par exocytose.
Ces protéases sont synthétisées sous une forme inactive pour éviter que, avant d’être sécrétées, elles se digèrent elles-mêmes et/ou des protéines tissulaires. Ce qui se passe, c’est que le site actif de l’enzyme est « masqué” et qu’après activation, la protéine peut agir sur le substrat. L’activation est le résultat du clivage, catalysé par une enzyme spécifique, d’une ou plusieurs liaisons peptidiques spécifiques, avec libération d’un ou plusieurs segments de la chaîne polypeptidique. Cela permet à la molécule d’assumer une conformation tridimensionnelle dans laquelle le site actif est libre et correctement configuré.
Même leur accumulation au sein des granules est un système de protection : elle les isole des autres molécules présentes dans la cellule.
La plupart des protéines dans leur conformation native sont résistantes à l’action des protéases. Ceci est une conséquence de leur structure secondaire et tertiaire ou native qui masque de nombreuses liaisons à l’action des enzymes. Ces structures sont stabilisées par des liaisons covalentes, telles que des ponts disulfures entre les résidus de cystéine, et des forces non covalentes, telles que les interactions ioniques, les liaisons hydrogène et les forces de van der Waals.
Pour une digestion protéique adéquate, il est donc essentiel que les liaisons peptidiques soient aussi accessibles que possible à l’action des protéases intestinales. Ceci est réalisé, à l’extérieur du corps par la cuisson des aliments et à l’intérieur du corps par l’environnement acide de l’estomac.
Rôle de la cuisson et de la mastication des aliments
La cuisson des aliments, lorsqu’elle n’est pas excessive, facilite la digestion des protéines.
De quelle manière?
Comme toutes les molécules, les protéines ne sont pas non plus immobiles mais vibrent. Lorsque la température augmente, les protéines vibrent à une plus grande amplitude, jusqu’à détruire les liaisons non covalentes qui contribuent au maintien de la structure native. Par conséquent, un changement conformationnel de la protéine se produit, c’est-à-dire que la molécule est dénaturée. Cela peut rendre les liaisons peptidiques internes plus accessibles à l’action des enzymes digestives.
Même la mastication et l’insalivation des aliments homogénéisent et humidifient les composants solides de la nourriture elle-même, facilitant la digestion gastrique et intestinale.
Étapes de la digestion des protéines
Deux étapes sont impliquées dans la digestion des protéines: la première se produit dans l’estomac et l’autre dans le duodénum, la première partie de l’intestin grêle.
Digestion de l’estomac et des protéines
La digestion des protéines commence dans l’estomac, et il s’agit d’une « étape de préparation” par rapport aux événements qui se produisent dans le duodénum.
La présence de nourriture dans l’estomac stimule les cellules G de la muqueuse de l’antre gastrique et du duodénum proximal pour produire et libérer l’hormone gastrine dans la circulation sanguine. L’hormone stimule les cellules pariétales des glandes gastriques appropriées, localisées principalement au bas de l’organe, pour produire et sécréter de l’acide chlorhydrique dans l’estomac (les cellules pariétales produisent également le facteur intrinsèque, une protéine qui lie la vitamine B12, empêchant sa destruction et permettant son absorption).
Dans les glandes gastriques appropriées, vous avez également trouvé:
- cellules muqueuses du cou, qui produisent du mucus;
- cellules principales, qui libèrent du pepsinogène.
Toutes ces substances, ainsi que d’autres telles que les ions potassium et la lipase gastrique, sont présentes dans le suc gastrique, dont le pH est compris entre 1 et 2,5.
En raison de son faible pH, le suc gastrique a une action antiseptique, tuant la plupart des bactéries et autres cellules étrangères, et un effet dénaturant, car il rompt les liaisons non covalentes qui maintiennent la structure native des protéines. Cet effet dénaturant facilite l’accès de la protéase intestinale aux liaisons peptidiques, comme le chauffage pendant la cuisson. Certaines protéines riches en liaisons disulfures, telles que les kératines, sont résistantes à la dénaturation par un pH faible, et donc difficiles à digérer. Au contraire, la plupart des protéines globulaires sont presque complètement hydrolysées en acides aminés constitutifs.
Enfin, le faible pH du suc gastrique active le pepsinogène, un zymogène, en pepsine, la première enzyme impliquée dans la digestion des protéines.
Digestion des protéines et pepsine
Il existe différentes isoenzymes de pepsinogène, telles que le type I, synthétisées par les cellules du corps et du fond d’estomac, et le type II qui est produit dans toutes les régions de l’organe. Toutes les isoenzymes sont converties en enzyme active. L’activation se fait par autocatalyse, à des valeurs de pH inférieures à 5, par un processus intramoléculaire consistent en l’hydrolyse d’une liaison peptidique spécifique et la libération d’un petit peptide à partir de l’extrémité N-terminale de la proenzyme. Ce peptide reste lié à l’enzyme et continue d’agir comme inhibiteur jusqu’à ce que le pH tombe en dessous de 2, ou jusqu’à ce qu’il soit encore dégradé par la pepsine elle-même. Ainsi, une fois que de la pepsine est formée, cela active rapidement d’autres molécules de pepsinogène.
La pepsine, une endopeptidase dont le pH d’activité est optimal à 1,6, hydrolyse 10 à 20% des protéines du repas. De nombreuses enzymes digestives sont capables d’agir sur un large éventail de substrats, et la pepsine ne fait pas exception, catalysant le clivage des liaisons peptidiques adjacentes aux résidus d’acides aminés tels que la leucine et la phénylalanine, la tyrosine et le tryptophane (acides aminés aromatiques). Un mélange de peptides de grande taille et de quelques acides aminés libres est produit.
L’action de la pepsine est importante non pas tant pour sa contribution directe à la digestion des protéines, c’est-à-dire modeste, mais pour la libération de peptides et d’acides aminés qui, au niveau duodénal, stimulent la sécrétion de cholécystokinine, et donc la phase duodénale / pancréatique de la digestion des protéines (voir ci-dessous).
Il convient de noter que l’action de la pepsine sur le collagène, une famille de protéines qui s’enroulent autour et retiennent ensemble les cellules musculaires, facilite l’accès de la protéase pancréatique aux protéines de farine.
Digestion du duodénum et des protéines
Lorsque le contenu gastrique passe dans le duodénum, son acidité stimule les cellules S, localisées dans la muqueuse duodénale et dans la partie proximale du jéjunum (la partie suivante de l’intestin grêle), pour produire et libérer l’hormone sécrétine dans la circulation sanguine. L’hormone provoque la sécrétion d’un suc pancréatique alcalin, riche en ions bicarbonate mais pauvre en enzymes, qui passe dans le duodénum par le canal pancréatique. Dans le duodénum, il neutralise l’acide chlorhydrique produit par l’estomac, élevant le pH à environ 7 (niveaux neutres). La sécrétine stimule également la sécrétion biliaire et réduit la libération de gastrine.
La présence d’acides aminés dans le duodénum stimule, comme mentionné ci-dessus, les cellules endocrines du duodénum et du jéjunum à produire et à libérer de la cholécystokinine (CKK) dans la circulation sanguine. L’hormone, entre autres fonctions, stimule le pancréas exocrine à sécréter un jus riche en enzymes (présent sous forme de zymogènes), c’est-à-dire:
- trypsinogène, chymotrypsinogène et proélastase, endopeptidases avec une spécificité de substrat différente par rapport à la pepsine mais aussi parmi elles;
- procarboxypeptidase A et B, exopeptidases qui éliminent les acides aminés de l’extrémité C-terminale des peptides.
Par conséquent, dans le duodénum, il existe un environnement neutre riche en enzymes capables de continuer, une fois activées, la digestion des protéines. De plus, les protéases ayant une spécificité de substrat différente, chaque peptide produit par une enzyme peut être substrat d’une autre enzyme.
Dans le suc pancréatique, l’amylase, la lipase et la nucléase sont également présentes.
Activation des zymogènes pancréatiques
La première et principale étape de leur activation est la conversion du trypsinogène en trypsine par l’entéropeptidase (également appelée entérokinase), une endopeptidase produite par les cellules du duodénum après stimulation de la cholécystokinine. L’entéropeptidase catalyse le clivage d’une liaison peptidique spécifique entre un résidu de lysine et un résidu d’isoleucine du trypsinogène, avec libération d’un hexapeptide. Cela provoque un réarrangement conformationnel de la protéine qui l’active, c’est-à-dire la formation de trypsine.
L’enzyme clive les liaisons peptidiques adjacentes aux résidus de lysine et d’arginine des protéines à digérer; de plus, elle peut activer la chymotrypsinogène, la proélastase et la procarboxypeptidase A et B, mais aussi d’autres molécules de trypsinogène, comme la pepsine (autocatalyse).
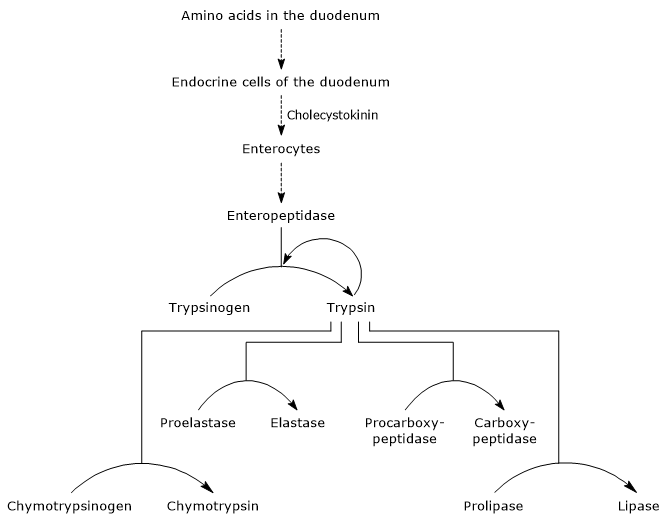
Par conséquent, la capacité du duodénum à digérer les protéines augmente à mesure que les zymogènes pancréatiques sont activés, tous déclenchés par une petite quantité d’entéropeptidase.
- L’activation de la chymotrypsinogène en chymotrypsine se produit à travers différentes étapes auxquelles participent la trypsine et la chymotrypsine activée elle-même.
Dans la première étape, la trypsine catalyse le clivage d’une liaison peptidique spécifique, ce qui provoque l’activation du chymotrypsinogène en π-chymotrypsine, qui est pleinement active. Ensuite, la π-chymotrypsine elle-même catalyse la libération de deux dipeptides avec formation de la δ-chymotrypsine, une forme plus stable de l’enzyme. la δ-chymotrypsine subit deux changements conformationnels, dont le premier conduit à la formation de la κ-chymotrypsine et le second de l’α-chymotrypsine, la forme active finale de l’enzyme.
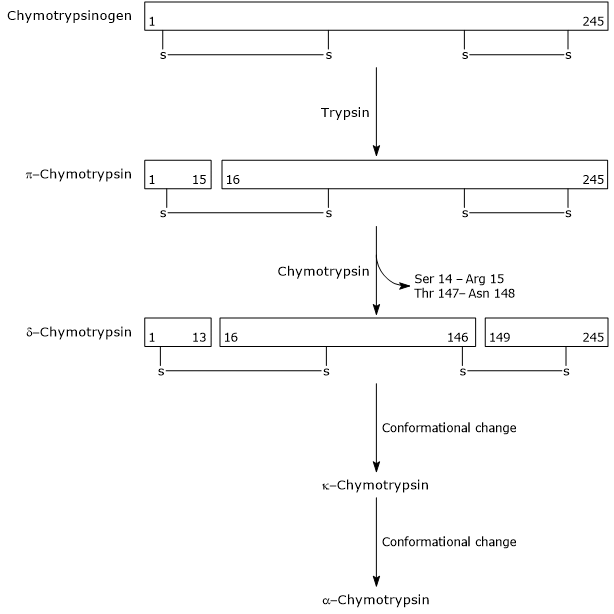
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
L’élastase, moins spécifique que les autres hydrolases digestives, catalyse le clivage des liaisons peptidiques adjacentes aux acides aminés tels que la glycine, l’alanine et la sérine. - Procarboxypeptidase
La Procarboxypeptidase A est activée en carboxypeptidase A; la protéase clive les liaisons peptidiques adjacentes aux acides aminés à chaînes latérales ramifiées ou aromatiques, telles que la phénylalanine et la valine.
La Procarboxypeptidase B est activée en carboxypeptidase B, spécifique des acides aminés à chaînes latérales basiques, tels que la lysine et l’arginine.
Les protéases mentionnées ci-dessus, contrairement à la pepsine, ont un pH d’action optimal allant de 7 à 8, c’est-à-dire neutre ou faiblement alcalin.
Inhibiteur de la trypsine pancréatique
Il existe un système de protection ”supplémentaire » contre l’activité de la trypsine intrapancréatique : la synthèse d’un inhibiteur appelé ”inhibiteur de la trypsine pancréatique « . La molécule, présente dans les granules de zymogène pancréatique, est capable de lier très étroitement le site actif de l’enzyme l’inactivant. De cette façon, l’activité de toute trypsine résultant d’une activation prématurée du trypsinogène est bloquée, empêchant une situation dans laquelle quelques molécules activées activent tous les zymogènes pancréatiques.
Chez les plantes, il existe de nombreuses molécules ayant une activité similaire. Un exemple est l’inhibiteur de la trypsine de Kunitz, une protéine principalement présente dans le soja, qui forme un complexe très stable avec le site actif de la trypsine.
Les protéases précitées ayant une spécificité de substrat distincte, agissant sur des liaisons peptidiques adjacentes à différents acides aminés, chaque peptide généré par une protéase peut être le substrat d’une autre. De cette façon, les protéines partiellement digérées qui pénètrent dans le duodénum sont efficacement hydrolysées en acides aminés libres et peptides de 2 à 8 résidus. Ces peptides sont des substrats d’aminopeptidases sécrétées par les entérocytes et associées à leurs microvillosités.
Les dipeptidases sont également présentes.
Il convient de noter que les mêmes protéases sont finalement digérées, mettant fin au processus.
L’importance et l’efficacité des enzymes protéolytiques dans la digestion des protéines intestinales peuvent être comprises à partir de cet exemple. Si in vitro vous souhaitez hydrolyser une protéine en ses acides aminés constitutifs, il est nécessaire d’utiliser un acide fort et concentré comme catalyseur et de chauffer l’échantillon à 105 ° C pendant la nuit. Dans l’intestin, le même résultat est obtenu en quelques heures, en opérant d’abord dans l’environnement relativement acide de l’estomac, puis dans les conditions alcalines douces du duodénum, à 37 ° C.
Les acides aminés libérés, ainsi que les di- et tri-peptides, sont absorbés par les entérocytes. Les di- et tri-peptides sont généralement hydrolysés en acides aminés constitutifs dans les entérocytes, ce qui explique pourquoi pratiquement seuls les acides aminés libres sont présents dans la circulation portale.
Bender D.A. Benders’dictionary of nutrition and food technology. 8ème Édition. Éditions Woodhead. Oxford, 2006
Bender D.A. Introduction à la nutrition et au métabolisme. 3ème Édition. &Francis, 2004
Berg J.M., Tymoczko J.L. et Stryer L. Biochimie. 5ème Édition. W. H. Freeman and Company, 2002
Bhagavan N.V., Ha C-E. Essentials of medical biochemistry: with clinical cases. 4ème Édition. Presse académique, 2015
Cozzani I. et Dainese E. Biochimica degli alimententi e della nutrizione. Il s’agit de la première édition de Piccin Editore, 2006
Nelson D.L., Cox M.M. Lehninger. Principes de biochimie. 4ème Édition. Il s’agit de l’un des plus grands noms de la science et de la technologie au monde. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Biochimie médicale: métabolisme humain dans la santé et la maladie. John Wiley &Fils, INC., Publication, 2009
Stipanuk M.H., Caudill M.A. Aspects biochimiques, physiologiques et moléculaires de la nutrition humaine. 3ème Édition. Elsevier sciences de la santé, 2013