fehérje emésztés: lépések, enzimek és hormonok
a szervezetnek fehérjékre van szüksége, különösen a bennük található esszenciális aminosavakra. Az egészséges felnőtt alany számára az ajánlott napi bevitel 0,85 g/testtömeg-kg, tehát egy 70 kg-os személy esetében körülbelül 60 g, de a tipikus nyugati étrendben gyakran a bevitel meghaladja a 100 g / nap értéket.
az élelmiszerfehérjék mellett a test 50-100 g endogén fehérjét is emészt, amelyek a gyomor-bél traktus lumenébe szekretálódnak vagy elvesznek, és amelyek a következőkből származnak:
- nyál;
- gyomornedv;
- hasnyálmirigy enzimek és egyéb szekréciók;
- bélsejtek, amelyek leválnak;
- fehérjék, amelyek átjutnak a bél lumenébe a véráramból.
Ez a keverék hatékonyan emészthető és felszívódik a duodenumban, a vékonybél első és legrövidebb részében, napi veszteséggel a széklettel körülbelül 1,6 g nitrogén, ami 10 g fehérjének felel meg. Az elveszett nitrogén nagy részét a vastagbél mikroflórája használja fel növekedésére, így a baktériumtömeg részeként megtalálható a székletben.
tartalom
- gyomor és fehérje emésztés
- fehérje emésztés és pepszin
- nyombél és fehérje emésztés
- aktiválása hasnyálmirigy zymogének
- hasnyálmirigy tripszin inhibitor
emésztőenzimek
a fehérje emésztése a polipeptidláncban az egyes aminosavakat kötő peptidkötések hidrolízisének eredményeként következik be. Ezeket a reakciókat proteázoknak nevezett enzimek katalizálják.
az aminosav oldalláncra specifikus bélproteázok olyan hidrolázok, amelyek két osztályra oszthatók:
- endopeptidázok, amelyek a polipeptidláncon belül hidrolizálják a peptidkötéseket, és amelyeket a gyomor és az exokrin hasnyálmirigy termel;
- exopeptidázok, amelyek két csoportra oszthatók:
a karboxipeptidázok, amelyek eltávolítják az aminosavakat A C-terminális végből, és az exokrin hasnyálmirigy által termelt;
az aminopeptidáz, amely az N-terminális végére hat, és az enterociták termelik.

ezeket az enzimeket inaktív formában szintetizálják és szekretálják, úgynevezett zimogének vagy proenzimek.
a sejten belül a zimogének a membrán által határolt granulátumokban, úgynevezett zimogén granulátumokban tárolódnak. Amikor a sejtet a specifikus jel stimulálja, a granulátummembrán összeolvad a plazmamembránnal, és a zimogének exocitózissal szabadulnak fel.
ezeket a proteázokat inaktív formában szintetizálják, hogy elkerüljék, hogy a kiválasztódás előtt megemésztsék magukat és/vagy szöveti fehérjéket. Az történik, hogy az enzim aktív helyét “elfedik”, és csak az aktiválás után képes a fehérje a szubsztrátumra hatni. Az aktiválás egy vagy több specifikus peptidkötés specifikus enzim által katalizált hasításának eredménye, a polipeptidlánc egy vagy több szegmensének felszabadulásával. Ez lehetővé teszi a molekula számára, hogy háromdimenziós konformációt feltételezzen, amelyben az aktív hely szabad és megfelelően konfigurálva van.
még a granulátumon belüli felhalmozódásuk is védelmi rendszer: izolálja őket a sejtben lévő többi molekulától.
a legtöbb fehérje natív konformációjában ellenáll a proteázok hatásának. Ez másodlagos, tercier vagy natív szerkezetük következménye, amely sok kötést elfed az enzimek hatásához. Ezeket a struktúrákat kovalens kötések stabilizálják, például diszulfid hidak a cisztein maradványok között, és nem kovalens erők, például Ionos kölcsönhatások, hidrogénkötések és van der Waals erők.
a megfelelő fehérje emésztéshez ezért elengedhetetlen, hogy a peptidkötések a lehető legjobban hozzáférhetők legyenek a bél proteázok hatásához. Ezt a testen kívül az ételek szakácsával, a testben pedig a gyomor savas környezetével érik el.
az étel főzésének és rágásának szerepe
az szakács szakácsa, ha nem túlzott, elősegíti a fehérje emésztését.
milyen módon?
mint minden molekula, a fehérjék sem mozdulatlanok, hanem rezegnek. Ahogy a hőmérséklet növekszik, a fehérjék nagyobb amplitúdóval rezegnek, hogy elpusztítsák azokat a nem kovalens kötéseket, amelyek hozzájárulnak a natív szerkezet fenntartásához. Ezért a fehérje konformációs változása következik be, vagyis a molekula denaturálódik. Ez a belső peptidkötéseket hozzáférhetőbbé teheti az emésztőenzimek hatásához.
még a rágás és insalivation élelmiszer homogenizálja és nedvesíti a szilárd összetevők az élelmiszer maga, megkönnyítve a gyomor és a vékonybél emésztést.
A fehérje emésztésének szakaszai
a fehérjék emésztésében két szakasz vesz részt: az első a gyomorban, a másik a duodenumban, a vékonybél első részében fordul elő.
gyomor és fehérje emésztés
a fehérje emésztés a gyomorban kezdődik, és ez egy “előkészítési szakasz” a duodenumban előforduló eseményekhez képest.
az élelmiszer jelenléte a gyomorban serkenti a gyomor antrum és a proximális duodenum nyálkahártyájának G-sejtjeit, hogy előállítsák és felszabadítsák a gasztrin hormont a véráramba. A hormon stimulálja a megfelelő gyomormirigyek parietális sejtjeit, amelyek többnyire a szerv alján helyezkednek el, hogy sósavat termeljenek és szekretáljanak a gyomorba (a parietális sejtek szintén előállítják a belső faktort, egy fehérjét, amely kötődik a B12-vitaminhoz, megakadályozva annak pusztulását és lehetővé téve annak felszívódását).
a megfelelő gyomor mirigyek is talált:
- nyálkahártya nyaki sejtek, amelyek nyálkát termelnek;
- fő sejtek, amelyek felszabadítják a pepszinogént.
mindezek az anyagok, másokkal együtt, mint például a káliumionok és a gyomor lipáz, jelen vannak a gyomornedvben, amelynek pH-ja 1 és 2,5 között mozog.
alacsony pH-ja miatt a gyomornedv antiszeptikus hatású, megöli a legtöbb baktériumot és más idegen sejteket, és denaturáló hatást fejt ki, mivel megszakítja a fehérjék natív szerkezetét fenntartó nem-kovalens kötéseket. Ez a denaturáló hatás megkönnyíti a bél proteáz hozzáférését a peptidkötésekhez, mint például a szakács során történő melegítés. Egyes diszulfidkötésekben gazdag fehérjék, például a keratinok, ellenállnak az alacsony pH-értékű denaturációnak, ezért nehezen emészthetők. Éppen ellenkezőleg, a globuláris fehérjék többsége szinte teljesen hidrolizálódik alkotó aminosavakká.
végül a gyomornedv alacsony pH-ja aktiválja a pepszinogént, egy zimogént a pepszinhez, az első enzimhez, amely részt vesz a fehérje emésztésében.
fehérje emésztés és pepszin
a pepszinogén különböző izoenzimjei vannak, mint például az I. típus, amelyet a test sejtjei és a gyomor fundusa szintetizálnak,és a II. Az összes izoenzim aktív enzimdé alakul. Az aktiválás autokatalízissel történik, 5 alatti pH-értékeken, intramolekuláris eljárással, amely egy specifikus peptidkötés hidrolíziséből és egy kis peptid felszabadulásából áll a proenzim N-terminális végéből. Ez a peptid kötődik az enzimhez, és továbbra is inhibitorként működik, amíg a pH 2 alá nem csökken, vagy amíg maga a pepszin tovább nem bomlik. Tehát, ha néhány pepszin képződik, ez gyorsan aktiválja a többi pepszinogén molekulát.
a pepszin, egy endopeptidáz, amelynek optimális pH-értéke 1,6, az étkezés fehérjéinek 10-20% – át hidrolizálja. Számos emésztőenzim képes a szubsztrátok széles skálájára hatni, és a pepszin sem kivétel, katalizálja az aminosavmaradékok, például a leucin és a fenilalanin, a tirozin és a triptofán (aromás aminosavak) melletti peptidkötések hasítását. Nagy méretű peptidek és néhány szabad aminosav keveréke keletkezik.
a pepszin hatása nem annyira fontos, hogy közvetlenül hozzájárul a fehérje emésztéséhez, azaz szerény, hanem a peptidek és aminosavak felszabadulásához, amelyek a duodenális szinten stimulálják a kolecisztokinin szekrécióját, és ezért a fehérje emésztés duodenális/hasnyálmirigy fázisát (lásd alább).
meg kell jegyezni, hogy a pepszin hatása a kollagénre, az izomsejteket körülvevő és összetartó fehérjék családjára megkönnyíti a hasnyálmirigy proteáz hozzáférését az étkezési fehérjékhez.
Duodenum és fehérje emésztés
amikor a gyomortartalom átjut a duodenumba, savassága stimulálja a nyombél nyálkahártyájában és a jejunum proximális részében (a vékonybél következő részében) lokalizált S-sejteket, hogy előállítsák és felszabadítsák a szekretin hormont a véráramba. A hormon a bikarbonát-ionokban gazdag, de enzimekben szegény lúgos hasnyálmirigy-lé szekrécióját okozza, amely a hasnyálmirigy-csatornán keresztül jut a duodenumba. A duodenumban semlegesíti a gyomor által termelt sósavat, a pH-t körülbelül 7-re emelve (semleges szint). A szekretin serkenti az epe szekrécióját és csökkenti a gasztrin felszabadulását.
az aminosavak jelenléte a duodenumban stimulálja, amint azt fentebb említettük, a duodenum és a jejunum endokrin sejtjeit, hogy kolecisztokinint (CKK) termeljenek és felszabadítsanak a véráramba. A hormon, többek között, stimulálja az exokrin hasnyálmirigyet, hogy enzimekben gazdag gyümölcslevet válasszon ki (zimogénként jelen van), vagyis:
- tripszinogén, kimotripszinogén és proelasztáz, endopeptidázok, amelyek szubsztrátspecifitása eltér a pepszinétől, de köztük is;
- prokarboxipeptidáz A és B, exopeptidázok, amelyek eltávolítják az aminosavakat a peptidek C-terminális végéből.
ezért a duodenumban semleges, enzimekben gazdag környezet van, amely képes aktiválni a fehérje emésztését. Továbbá, mivel a proteázok eltérő szubsztrát specifitással rendelkeznek, minden enzim által termelt peptid egy másik enzim szubsztrátja lehet.
a hasnyálban amiláz, lipáz és nukleáz is jelen van.
A hasnyálmirigy-zimogének aktiválása
aktiválásuk első és legfontosabb lépése a tripszinogén tripszinré történő átalakítása enteropeptidáz (más néven enterokináz), egy endopeptidáz, amelyet a duodenum sejtjei termelnek kolecisztokinin stimuláció után. Az enteropeptidáz egy specifikus peptidkötés hasítását katalizálja a tripszinogén lizinmaradéka és izoleucin maradéka között, hexapeptid felszabadulásával. Ez az aktiváló fehérje konformációs átrendeződését okozza, vagyis tripszin képződik.
az enzim hasítja peptid kötések mellett lizin és arginin maradványok fehérje megemészteni; sőt, képes aktiválni kimotripszinogén, proelasztáz és prokarboxipeptidáz A és B, hanem más molekulák tripszinogén, mint a pepszin (autokatalízis).
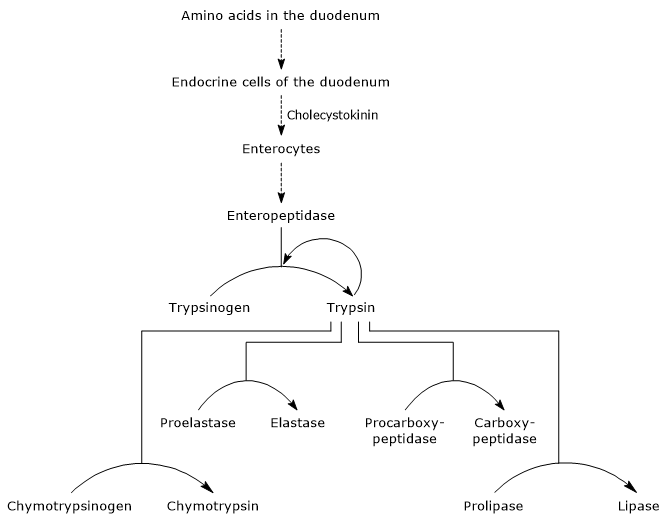
ezért a duodenum azon képessége, hogy megemésztse a fehérjéket, növekszik, amikor a hasnyálmirigy zimogének aktiválódnak, mindezt kis mennyiségű enteropeptidáz váltja ki.
- a kimotripszinogén kimotripszinre történő aktiválása különböző lépéseken keresztül történik, amelyekhez a tripszin és az aktivált kimotripszin is részt vesz.
az első lépésben a tripszin katalizálja egy specifikus peptidkötés hasítását,ami a kimotripszinogén aktiválódását okozza a teljesen aktív, teljesen aktív kimotripszinhez. Ezután maga a Anavar-kimotripszin katalizálja két dipeptid felszabadulását az enzim stabilabb formája, a ch-kimotripszin képződésével. a kimotripszin két konformációs változáson megy keresztül, amelyek közül az első a kimotripszin, a második pedig a kimotripszin, az enzim végső aktív formája.
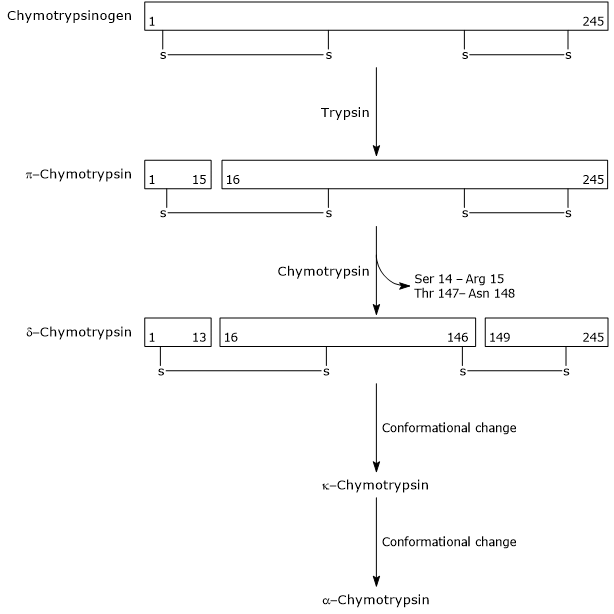
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
az elasztáz, amely kevésbé specifikus, mint a többi emésztő hidroláz, katalizálja az aminosavakkal, például glicinnel, alaninnal és szerinnel szomszédos peptidkötések hasítását. - Prokarboxipeptidáz
A Prokarboxipeptidáz a karboxipeptidáz a-vá aktiválódik; a proteáz elágazó vagy aromás oldalláncokkal, például fenilalaninnal és valinnal rendelkező aminosavakkal szomszédos peptidkötéseket hasít.
Prokarboxipeptidáz B aktiválódik karboxipeptidáz B, specifikus aminosavak bázikus oldalláncok, mint például a lizin és arginin.
a fent említett proteázok, ellentétben a pepszinnel, optimális pH-értékük van7 – től 8-ig, azaz semleges vagy gyengén lúgos.
hasnyálmirigy-tripszin inhibitor
van egy” kiegészítő “védelmi rendszer az intrapancreatikus tripszin aktivitás ellen: egy”hasnyálmirigy-tripszin inhibitor” nevű inhibitor szintézise. A hasnyálmirigy zimogén granulátumában jelen lévő molekula nagyon szorosan képes megkötni az inaktiváló enzim aktív helyét. Ily módon a tripszinogén idő előtti aktiválásából eredő tripszin aktivitása blokkolódik, megakadályozva azt a helyzetet, amelyben néhány aktivált molekula aktiválja az összes hasnyálmirigy-zimogént.
a növényekben sok hasonló aktivitású molekula van. Példa erre a Kunitz tripszin inhibitor, amely elsősorban a szójababban található fehérje, amely nagyon stabil komplexet képez a tripszin aktív helyével.
mivel a fent említett proteázok külön szubsztrát specifitással rendelkeznek, különböző aminosavakkal szomszédos peptidkötésekre hatva, a proteáz által generált minden peptid egy másik szubsztrátja lehet. Ily módon a duodenumba belépő részlegesen emésztett fehérjék hatékonyan hidrolizálódnak szabad aminosavakká és 2-8 maradék peptidekké. Ezek a peptidek az enterocitákból kiválasztódó aminopeptidázok szubsztrátjai, amelyek mikrovilláikhoz kapcsolódnak.
Dipeptidáz is jelen van.
meg kell jegyezni, hogy ugyanazokat a proteázokat végül megemésztik, befejezve a folyamatot.
a proteolitikus enzimek fontossága és hatékonysága a bélfehérje emésztésében ebből a példából érthető. Ha in vitro egy fehérjét aminosavakká kíván hidrolizálni, erős és koncentrált savat kell használni katalizátorként, és a mintát 105 CC-on melegíteni egy éjszakán át. A bélben ugyanazt az eredményt kapjuk néhány óra alatt, először a gyomor viszonylag savas környezetében, majd a duodenum enyhe lúgos állapotában, 37 C.
a felszabadult aminosavakat a di-és tri-peptidekkel együtt az enterociták szívják fel. A di-és tri-peptidek általában az enterocitákon belül alkotó aminosavakká hidrolizálódnak, és ez magyarázza, hogy a portális keringésben gyakorlatilag csak szabad aminosavak vannak jelen.
Bender D. A. Benders ‘ dictionary of nutrition and food technology. 8. kiadás. Woodhead Kiadó. Oxford, 2006
Bender D. A. Bevezetés a táplálkozásba és az anyagcserébe. 3. kiadás. Taylor & Francis, 2004
Berg J. M., Tymoczko J. L. és Stryer L. Biokémia. 5. kiadás. W. H. Freeman and Company, 2002
Bhagavan N. V., Ha C-E. az orvosi biokémia alapjai: klinikai esetekkel. 4. kiadás. Academic Press, 2015
Cozzani I. és Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. A biokémia alapelvei. 4. kiadás. W. H. Freeman and Company, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M. D., Glew R. H. orvosi biokémia: emberi anyagcsere az egészségben és a betegségben. John Wiley & Sons, INC., Publication, 2009
Stipanuk M. H., Caudill M. A. az emberi táplálkozás biokémiai, fiziológiai és molekuláris vonatkozásai. 3. kiadás. Elsevier egészségtudományok, 2013