Digestione delle proteine: passi, enzimi e ormoni
Il corpo richiede proteine, e in particolare gli aminoacidi essenziali in esse contenuti. L’assunzione giornaliera raccomandata per un soggetto adulto sano è di 0,85 g/kg di peso corporeo, quindi per una persona di 70 kg è di circa 60 g, ma spesso nella tipica dieta occidentale l’assunzione è superiore a 100 g/die.
Oltre alle proteine alimentari, il corpo digerisce anche 50-100 g di proteine endogene secrete o perse nel lume del tratto gastrointestinale e che derivano da:
- saliva;
- succo gastrico;
- enzimi pancreatici e altre secrezioni;
- cellule intestinali che si sfaldano;
- proteine che passano nel lume intestinale dal flusso sanguigno.
Questa miscela viene efficacemente digerita e assorbita nel duodeno, la prima e la parte più corta dell’intestino tenue, con una perdita giornaliera attraverso le feci pari a circa 1,6 g di azoto, equivalente a 10 g di proteine. La maggior parte dell’azoto perso viene utilizzato dalla microflora nel colon per la sua crescita, e quindi si trova nelle feci come parte della massa batterica.
CONTENUTO
- enzimi Digestivi
- funzione di cottura e la masticazione del cibo
- le Fasi della digestione delle proteine
- Stomaco e la digestione delle proteine
- la digestione delle Proteine e la pepsina
- il Duodeno e la digestione delle proteine
- Attivazione del pancreas zymogens
- inibitore della tripsina Pancreatica
- Stomaco e la digestione delle proteine
enzimi Digestivi
la digestione delle Proteine si verifica come risultato di idrolisi dei legami peptidici che uniscono i singoli amminoacidi nella catena polipeptidica. Queste reazioni sono catalizzate da enzimi chiamati proteasi.
intestinale proteasi, specifico per l’amminoacido catena laterale, sono idrolasi che possono essere suddivisi in due classi:
- endopeptidasi, che idrolizzare i legami peptidici all’interno della catena polipeptidica, e sono il prodotto di stomaco e il pancreas esocrino;
- exopeptidases, che possono essere suddivisi in due gruppi:
la carbossipeptidasi, che rimuovere aminoacidi da C-terminale, e sono prodotte dal pancreas esocrino;
l’aminopeptidasi, che agiscono sull’estremità N-terminale e sono prodotte dagli enterociti.

Questi enzimi sono sintetizzati e secreti in una forma inattiva, chiamato zymogens o proenzymes.
All’interno della cellula, gli zimogeni sono immagazzinati all’interno di granuli delimitati dalla membrana chiamati granuli di zymogen. Quando la cellula viene stimolata dal segnale specifico, la membrana granulare si fonde con la membrana plasmatica e gli zimogeni vengono rilasciati per esocitosi.
Queste proteasi sono sintetizzate in una forma inattiva per evitare che, prima di essere secrete, digeriscano se stesse e/o proteine tissutali. Quello che succede è che il sito attivo dell’enzima è “mascherato” e solo dopo l’attivazione la proteina può agire sul substrato. L’attivazione è il risultato della scissione, catalizzata da un enzima specifico, di uno o più legami peptidici specifici, con rilascio di uno o più segmenti della catena polipeptidica. Ciò consente alla molecola di assumere una conformazione tridimensionale in cui il sito attivo è libero e configurato correttamente.
Anche il loro accumulo all’interno dei granuli è un sistema di protezione: li isola dalle altre molecole presenti nella cellula.
La maggior parte delle proteine nella loro conformazione nativa sono resistenti all’azione delle proteasi. Questa è una conseguenza della loro struttura secondaria e terziaria o nativa che maschera molti legami all’azione degli enzimi. Queste strutture sono stabilizzate da legami covalenti, come ponti disolfuro tra residui di cisteina e forze non covalenti, come interazioni ioniche, legami idrogeno e forze di van der Waals.
Per un’adeguata digestione delle proteine è quindi essenziale che i legami peptidici siano il più accessibili possibile all’azione delle proteasi intestinali. Ciò si ottiene, al di fuori del corpo attraverso la cottura del cibo, e all’interno del corpo dall’ambiente acido nello stomaco.
Ruolo della cottura e masticazione del cibo
La cottura del cibo, quando non è eccessiva, facilita la digestione delle proteine.
In che modo?
Come tutte le molecole, anche le proteine non sono immobili ma vibrano. All’aumentare della temperatura le proteine vibrano ad una maggiore ampiezza, fino a distruggere i legami non covalenti che contribuiscono al mantenimento della struttura nativa. Pertanto, si verifica un cambiamento conformazionale della proteina, cioè la molecola viene denaturata. Ciò può rendere i legami peptidici interni più accessibili all’azione degli enzimi digestivi.
Anche la masticazione e l’insalivazione del cibo omogeneizzano e umidificano i componenti solidi del cibo stesso, facilitando la digestione gastrica e intestinale.
Fasi della digestione delle proteine
Due fasi sono coinvolte nella digestione delle proteine: la prima si verifica nello stomaco e l’altra nell ‘ nel duodeno, la prima parte dell’intestino tenue.
Digestione dello stomaco e delle proteine
La digestione delle proteine inizia nello stomaco e questa è una “fase di preparazione” rispetto agli eventi che si verificano nel duodeno.
La presenza di cibo nello stomaco stimola le cellule G della mucosa dell’antro gastrico e del duodeno prossimale a produrre e rilasciare l’ormone gastrina nel flusso sanguigno. L’ormone stimola le cellule parietali delle ghiandole gastriche appropriate, localizzate principalmente nella parte inferiore dell’organo, a produrre e secernere acido cloridrico nello stomaco (le cellule parietali producono anche il fattore intrinseco, una proteina che lega la vitamina B12, prevenendone la distruzione e permettendone l’assorbimento).
Nelle ghiandole gastriche corrette hai anche trovato:
- cellule del collo mucoso, che producono muco;
- cellule principali, che rilasciano pepsinogeno.
Tutte queste sostanze, insieme ad altre come gli ioni potassio e la lipasi gastrica, sono presenti nel succo gastrico, che ha un pH compreso tra 1 e 2,5.
A causa del suo basso pH, il succo gastrico ha un’azione antisettica, uccidendo la maggior parte dei batteri e altre cellule estranee e un effetto denaturante, in quanto rompe i legami non covalenti che mantengono la struttura nativa delle proteine. Questo effetto denaturante facilita l’accesso della proteasi intestinale ai legami peptidici, come il riscaldamento durante la cottura. Alcune proteine ricche di legami disolfuro, come le cheratine, sono resistenti alla denaturazione a basso pH e quindi difficili da digerire. Al contrario, la maggior parte delle proteine globulari sono quasi completamente idrolizzate in amminoacidi costituenti.
Infine, il basso pH del succo gastrico attiva il pepsinogeno, uno zimogeno, alla pepsina, il primo enzima coinvolto nella digestione delle proteine.
Digestione delle proteine e pepsina
Ci sono diversi isoenzimi di pepsinogeno, come il tipo I, sintetizzato dalle cellule del corpo e del fondo dello stomaco, e il tipo II che viene prodotto in tutte le regioni dell’organo. Tutti gli isoenzimi vengono convertiti nell’enzima attivo. L’attivazione avviene tramite autocatalisi, a valori di pH inferiori a 5, mediante un processo intramolecolare consistente nell’idrolisi di uno specifico legame peptidico e nel rilascio di un piccolo peptide dall’estremità N-terminale del proenzima. Questo peptide rimane legato all’enzima e continua ad agire come inibitore fino a quando il pH scende sotto 2, o fino a quando non viene ulteriormente degradato dalla pepsina stessa. Quindi, una volta formata una certa pepsina, questo attiva rapidamente altre molecole di pepsinogeno.
La pepsina, un’endopeptidasi con un pH ottimale di attività a 1,6, idrolizza il 10-20% delle proteine nel pasto. Molti enzimi digestivi sono in grado di agire su una vasta gamma di substrati e la pepsina non fa eccezione, catalizzando la scissione dei legami peptidici adiacenti ai residui di aminoacidi come leucina e fenilalanina, tirosina e triptofano (amminoacidi aromatici). Viene prodotta una miscela di peptidi di grandi dimensioni e alcuni aminoacidi liberi.
L’azione della pepsina è importante non tanto per il suo contributo diretto alla digestione delle proteine, che è modesto, ma per il rilascio di peptidi e amminoacidi che, a livello duodenale, stimolano la secrezione di colecistochinina, e quindi la fase duodenale/pancreatica della digestione delle proteine (vedi sotto).
Va notato che l’azione della pepsina sul collagene, una famiglia di proteine che avvolgono e tengono insieme le cellule muscolari, facilita l’accesso della proteasi pancreatica alle proteine del pasto.
Duodeno e digestione delle proteine
Quando il contenuto gastrico passa nel duodeno, la sua acidità stimola le cellule S, localizzate nella mucosa duodenale e nella parte prossimale del digiuno (la parte successiva dell’intestino tenue), per produrre e rilasciare l’ormone secretina nel flusso sanguigno. L’ormone provoca la secrezione di un succo pancreatico alcalino, ricco di ioni bicarbonato ma povero di enzimi, che passa nel duodeno attraverso il dotto pancreatico. Nel duodeno, neutralizza l’acido cloridrico prodotto dallo stomaco, aumentando il pH a circa 7 (livelli neutri). Secretina stimola anche la secrezione biliare e riduce il rilascio di gastrina.
La presenza di aminoacidi nel duodeno stimola, come accennato in precedenza, le cellule endocrine nel duodeno e nel digiuno a produrre e rilasciare colecistochinina (CKK) nel flusso sanguigno. L’ormone, tra le altre funzioni, stimola il pancreas esocrino a secernere un succo ricco di enzimi (presenti come zimogeni), cioè:
- tripsinogeno, chimotripsinogeno e proelastasi, endopeptidasi con una specificità di substrato diversa rispetto alla pepsina ma anche tra queste;
- procarbossipeptidasi A e B, esopeptidasi che rimuovono gli amminoacidi dall’estremità C-terminale dei peptidi.
Pertanto, nel duodeno è presente un ambiente neutro ricco di enzimi in grado di continuare, una volta attivato, la digestione delle proteine. Inoltre, poichè le proteasi hanno specificità differente del substrato, ogni peptide prodotto da un enzima può essere substrato di un altro enzima.
Nel succo pancreatico sono presenti anche amilasi, lipasi e nucleasi.
Attivazione di zimogeni pancreatici
Il primo e principale passo nella loro attivazione è la conversione del tripsinogeno in tripsina mediante enteropeptidasi (chiamata anche enterochinasi), un’endopeptidasi prodotta dalle cellule del duodeno dopo stimolazione della colecistochinina. L’enteropeptidasi catalizza la scissione di un legame peptidico specifico tra un residuo di lisina e un residuo di isoleucina del tripsinogeno, con rilascio di un esapeptide. Ciò provoca un riarrangiamento conformazionale della proteina che lo attiva, cioè si forma la tripsina.
L’enzima scinde i legami peptidici adiacenti ai residui di lisina e arginina di proteine da digerire; inoltre, può attivare chimotripsinogeno, proelastasi e procarbossipeptidasi A e B, ma anche altre molecole di tripsinogeno, come la pepsina (autocatalisi).
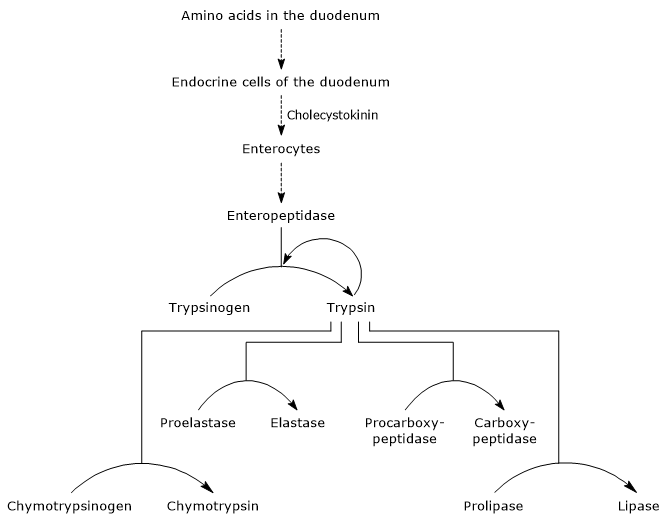
Quindi, la capacità del duodeno per digerire le proteine aumenta il pancreas zymogens sono attivati, attivati da una piccola quantità di enteropeptidase.
- L’attivazione del chimotripsinogeno in chimotripsina avviene attraverso diversi passaggi a cui partecipano la tripsina e la stessa chimotripsina attivata.
Nella prima fase, la tripsina catalizza la scissione di uno specifico legame peptidico, e questo causa l’attivazione del chimotripsinogeno in π-chimotripsina, che è completamente attiva. Quindi, π-chimotripsina stessa catalizza il rilascio di due dipeptidi con formazione della δ-chimotripsina, una forma più stabile dell’enzima. δ-chimotripsina subisce due cambiamenti conformazionali, il primo dei quali porta alla formazione della κ-chimotripsina e il secondo di α-chimotripsina, la forma attiva finale dell’enzima.
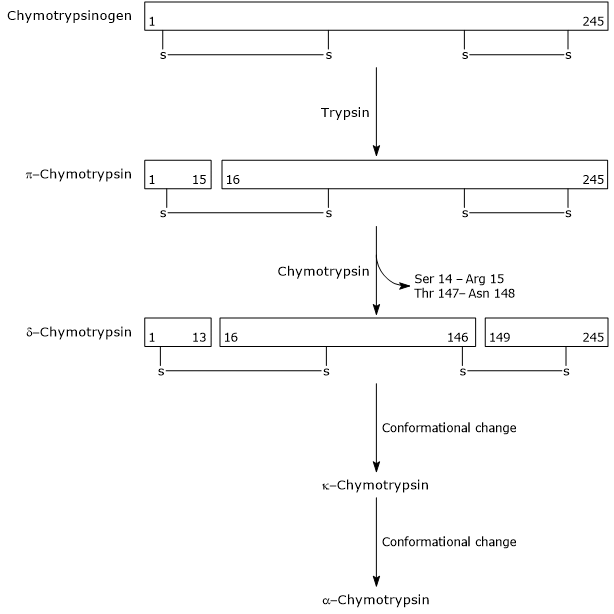
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
L’elastasi, che è meno specifica delle altre idrolasi digestive, catalizza la scissione dei legami peptidici adiacenti agli amminoacidi come glicina, alanina e serina. - Procarbossipeptidasi
La procarbossipeptidasi A viene attivata in carbossipeptidasi A; la proteasi scinde i legami peptidici adiacenti agli amminoacidi con catene laterali ramificate o aromatiche, come la fenilalanina e la valina.
La procarbossipeptidasi B viene attivata in carbossipeptidasi B, specifica per gli amminoacidi con catene laterali di base, come lisina e arginina.
Le proteasi sopra menzionate, a differenza della pepsina, hanno un pH ottimale di azione che va da7 a 8, cioè neutro o debolmente alcalino.
Inibitore della tripsina pancreatica
Esiste un sistema di protezione “aggiuntivo” contro l’attività della tripsina intrapancreatica: la sintesi di un inibitore chiamato “inibitore della tripsina pancreatica”. La molecola, presente nei granuli di zimogeno pancreatico, è in grado di legare molto strettamente il sito attivo dell’enzima inattivandolo. In questo modo, l’attività di qualsiasi tripsina risultante da un’attivazione prematura del tripsinogeno viene bloccata, impedendo una situazione in cui alcune molecole attivate attivano tutti gli zimogeni pancreatici.
Nelle piante, ci sono molte molecole con attività simile. Un esempio è l’inibitore della tripsina di Kunitz, una proteina che si trova principalmente nella soia, che forma un complesso molto stabile con il sito attivo della tripsina.
Poiché le proteasi sopra menzionate hanno una specificità del substrato distinta, agendo sui legami peptidici adiacenti a diversi amminoacidi, ogni peptide generato da una proteasi può essere substrato di un altro. In questo modo le proteine parzialmente digerite che entrano nel duodeno vengono efficacemente idrolizzate in amminoacidi liberi e peptidi di 2-8 residui. Questi peptidi sono substrati di aminopeptidasi secreti dagli enterociti e associati ai loro microvilli.
Sono presenti anche dipeptidasi.
Va notato che le stesse proteasi vengono finalmente digerite, terminando il processo.
L’importanza e l’efficacia degli enzimi proteolitici nella digestione delle proteine intestinali possono essere comprese da questo esempio. Se in vitro si desidera idrolizzare una proteina nei suoi amminoacidi costituenti, è necessario utilizzare un acido forte e concentrato come catalizzatore e riscaldare il campione a 105 ° C durante la notte. Nell’intestino lo stesso risultato si ottiene in poche ore, operando prima nell’ambiente relativamente acido dello stomaco, e poi nelle lievi condizioni alcaline del duodeno, a 37 °C.
Gli amminoacidi rilasciati, insieme a di – e tri-peptidi, vengono assorbiti dagli enterociti. I di-e tri-peptidi sono di solito idrolizzati in amminoacidi costituenti all’interno degli enterociti, e questo spiega perché praticamente solo gli amminoacidi liberi sono presenti nella circolazione portale.
Bender D. A. Dizionario Benders’ di nutrizione e tecnologia alimentare. 8a edizione. Woodhead Publishing. Oxford, 2006
Bender D. A. Introduzione alla nutrizione e al metabolismo. 3a edizione. Nel 2004 è stato pubblicato il primo album in studio della band, intitolato&. Biochimica. 5a edizione. W. H. Freeman and Company, 2002
Bhagavan N. V., Ha C-E. Essentials of medical biochemistry: with clinical cases. 4a edizione. Academic Press, 2015
Cozzani I. e Dainese E. Biochimica degli alimenti e della nutrizione. Piccin Editore, 2006
Nelson D. L., Cox M. M. Lehninger. Principi di biochimica. 4a edizione. W. H. Freeman and Company, 2004
Rawn J. D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal MD, Glew RH Biochimica medica: metabolismo umano in salute e malattia. Per maggiori informazioni:
Stipanuk M. H., Caudill M. A. Aspetti biochimici, fisiologici e molecolari della nutrizione umana. 3a edizione. Elsevier scienze della salute, 2013