タンパク質消化:ステップ、酵素、およびホルモン
体はタンパク質、特にそれらに含まれる必須アミノ酸を必要と 健康な成人の被験者の推奨される1日の摂取量は0.85g/kg体重であるため、70kgの人は約60gですが、典型的な西洋の食事ではしばしば摂取量は100g/日
食物タンパク質に加えて、体はまた、消化管の内腔に分泌または失われた内因性タンパク質の50-100gを消化し、次の結果になります。
- 唾液;
- 胃液;
- 膵臓酵素および他の分泌物;
- フレークオフ腸細胞;
- 血流から腸内腔に通過するタンパク質。
- 胃液;
- 膵酵素および他の分泌物;
この混合物は、小腸の最初と最短の部分である十二指腸で効率的に消化され吸収され、10gのタンパク質に相当する約1.6gの窒素に等しい便 失われた窒素の大部分は、その成長のために結腸内の微生物叢によって使用され、したがって、それは細菌塊の一部として糞便中に見出される。
内容
- 消化酵素
- 食品の調理と咀嚼の役割
- タンパク質消化の段階
- 胃とタンパク質消化
- タンパク質消化とペプシン
- 十二指腸とタンパク質消化
- 膵zymogensの活性化
- 膵トリプシン阻害剤
- 胃とタンパク質消化
消化酵素
タンパク質消化は、ポリペプチド鎖内の個々のアミノ酸に結合するペプチド結合の加水分解の結果として起こる。 これらの反応はプロテアーゼと呼ばれる酵素によって触媒される。
アミノ酸側鎖に特異的な腸プロテアーゼは、二つのクラスに分けることができる加水分解酵素である:
- ポリペプチド鎖内のペプチド結合を加水分解し、胃と膵臓外分泌によって産生されるエンドペプチダーゼ;
- エキソペプチダーゼは、二つのグループに分けることができる:
カルボキシペプチダーゼは、c末端からアミノ酸を除去し、膵臓外分泌によって産生される。;
アミノペプチダーゼは、N末端に作用し、腸細胞によって産生される。p>

これらの酵素は合成され、zymogensまたはproenzymesと呼ばれる不活性形態で分泌される。
細胞内では、zymogenはzymogen granules粒と呼ばれる膜有界顆粒の中に貯蔵されています。 細胞が特定のシグナルによって刺激されると、顆粒膜は原形質膜と融合し、ジモゲンはエキソサイトーシスによって放出される。
これらのプロテアーゼは、分泌される前に、彼ら自身および/または組織タンパク質を消化することを避けるために、不活性な形態で合成される。 何が起こるかは、酵素の活性部位が”マスク”され、活性化後にのみタンパク質が基質に作用することができるということである。 活性化は、特定の酵素によって触媒される、1つ以上の特異的ペプチド結合の切断、ポリペプチド鎖の1つ以上のセグメントの放出の結果である。 これにより、分子は、活性部位が遊離し、適切に構成されている三次元立体配座を仮定することができる。
顆粒内のそれらの蓄積さえも保護システムであり、細胞内に存在する他の分子からそれらを単離する。
彼らの天然立体配座のほとんどのタンパク質は、プロテアーゼの作用に耐性があります。 これは、酵素の作用に対する多くの結合を隠す、それらの二次構造および三次構造または天然構造の結果である。 これらの構造は、システイン残基間のジスルフィド橋のような共有結合、およびイオン相互作用、水素結合およびファンデルワールス力のような非共有結合力によって安定化される。
適切なタンパク質消化のためには、ペプチド結合が腸プロテアーゼの作用に可能な限りアクセス可能であることが不可欠である。 これは、食物の調理を通して体の外で、そして胃の中の酸環境によって体内で達成されます。
食品の調理と咀嚼の役割
食品の調理は、過剰でない場合、タンパク質の消化を促進する。
どのような方法で?
すべての分子と同様に、タンパク質も動かずに振動します。 温度が上昇するにつれて、タンパク質はより大きな振幅で振動し、天然構造の維持に寄与する非共有結合を破壊する。 したがって、タンパク質の立体配座変化、すなわち分子が変性される。 これは、内部ペプチド結合を消化酵素の作用によりアクセス可能にすることができる。
食品の咀嚼とinsalivationでさえ、食品自体の固体成分を均質化し、加湿し、胃および小腸の消化を促進する。
タンパク質消化の段階
二つの段階は、タンパク質の消化に関与している:最初は胃で発生し、他の十二指腸では、小腸の最初の部分。
胃とタンパク質消化
タンパク質消化は胃で始まり、これは十二指腸で起こるイベントと比較して”準備段階”です。
胃の中の食物の存在は、胃の前庭部および近位十二指腸の粘膜のG細胞を刺激して、ホルモンガストリンを産生し、血流に放出する。 ホルモンは胃に塩酸を作り出し、分泌するために器官の底で大抵集中する適切な胃腺の頭頂の細胞を刺激します(頭頂の細胞はまた内因性の要因、破壊を防ぎ、吸収されるようにするビタミンB12を結合する蛋白質を作り出します)。
適切な胃腺では、あなたも見つけました:
- 粘液を産生する粘液頸部細胞;
- ペプシノーゲンを放出するチーフ細胞。
これらの物質はすべて、カリウムイオンや胃リパーゼなどの他の物質とともに、胃液中に存在し、pHは1〜2.5の範囲です。
その低pHのために、胃液は、タンパク質の天然構造を維持する非共有結合を破壊するように、ほとんどの細菌や他の外来細胞を殺し、防腐作用を有 この変性効果は、調理中の加熱のように、ペプチド結合への腸プロテアーゼのアクセスを容易にする。 ケラチンのようなジスルフィド結合が豊富ないくつかのタンパク質は、低pHによる変性に耐性があり、したがって消化が困難である。 逆に、球状タンパク質の大部分はほぼ完全に加水分解されて構成アミノ酸になる。
最後に、胃液の低pHは、ペプシン、タンパク質消化に関与する最初の酵素に、ペプシノーゲン、zymogenを活性化します。
タンパク質消化とペプシン
ペプシノーゲンには、体の細胞や胃の眼底によって合成されたI型や、器官のすべての領域で産生されるII型など、異 すべてのアイソザイムは活性酵素に変換される。 活性化は、特定のペプチド結合の加水分解およびプロ酵素のN末端からの小さなペプチドの放出からなる分子内プロセスによって、5以下のpH値 このペプチドは酵素に結合したままであり、pHが2以下に低下するまで、またはペプシン自体によってさらに分解されるまで阻害剤として作用し続 したがって、いくつかのペプシンが形成されると、これはすぐに他のペプシノーゲン分子を活性化する。
ペプシン、1.6での活性の最適なpHを有するエンドペプチダーゼは、食事中のタンパク質の10-20%を加水分解する。 多くの消化酵素は広範囲の基質に作用することができ、ペプシンも例外ではなく、ロイシンやフェニルアラニン、チロシン、トリプトファン(芳香族アミノ酸)などのアミノ酸残基に隣接するペプチド結合の切断を触媒する。 大きなサイズのペプチドと少数の遊離アミノ酸の混合物が生成される。
ペプシン作用は、タンパク質消化への直接的な貢献のためにそれほど重要ではありません,それは控えめです,しかし、ペプチドとアミノ酸の放出のために,十二指腸レベルで,コレシストキニンの分泌を刺激します,したがって、タンパク質消化の十二指腸/膵臓相(下記参照).
これは、コラーゲン、周りを包み、一緒に筋肉細胞を保持するタンパク質のファミリーにペプシンの作用は、食事タンパク質への膵臓プロテアーゼのアク
十二指腸およびタンパク質消化
胃内容物が十二指腸に入ると、その酸性度は、十二指腸粘膜および空腸の近位部(小腸の次の部分)に局在するS細胞を刺激し、ホルモンセクレチンを産生し、血流に放出する。 このホルモンは、重炭酸イオンが豊富であるが、膵管を通って十二指腸に入る酵素が乏しいアルカリ性の膵液の分泌を引き起こす。 十二指腸では、胃によって生成された塩酸を中和し、pHを約7(中性レベル)に上昇させます。 セクレチンはまた、胆汁分泌を刺激し、ガストリン放出を減少させる。
十二指腸内のアミノ酸の存在は、上記のように、十二指腸および空腸内の内分泌細胞を刺激して、コレシストキニン(CKK)を産生し、血流に放出する。 ホルモンは、他の機能の中で、酵素で豊富なジュースを分泌するようにexocrineの膵臓を刺激します(zymogensとして現在)、それはあります:
- トリプシノーゲン、キモトリプシノーゲンおよびプロエラスターゼ、ペプシンと比較して異なる基質特異性を有するエンドペプチダーゼ;
- プロカルボキシペプチダーゼAおよびB、ペプチドのC末端からアミノ酸を除去するエキソペプチダーゼ。
したがって、十二指腸には、一度活性化されたタンパク質消化を継続することができる酵素が豊富な中性環境があります。 また、プロテアーゼは、異なる基質特異性を有するため、酵素によって産生される各ペプチドは、他の酵素の基質とすることができる。
膵液にはアミラーゼ、リパーゼ、ヌクレアーゼも存在する。
膵zymogensの活性化
その活性化の最初およびマスターステップは、コレシストキニン刺激後に十二指腸の細胞によって産生されるエンドペプチダーゼであるエンテロペプチダーゼ(エンテロキナーゼとも呼ばれる)によるトリプシノーゲンのトリプシンへの変換である。 エンテロペプチダーゼはリジン残基とトリプシノーゲンのイソロイシン残基との間の特定のペプチド結合の切断を触媒し、ヘキサペプチドを放出する。 これは、それを活性化するタンパク質の立体配座再配列、すなわちトリプシンが形成される。
酵素は消化するタンパク質のリジンとアルギニン残基に隣接するペプチド結合を切断し、また、キモトリプシノーゲン、プロエラスターゼとプロカルボキシペプチダーゼAとBだけでなく、ペプシン(自己触媒)のようなトリプシノーゲンの他の分子を活性化することができます。
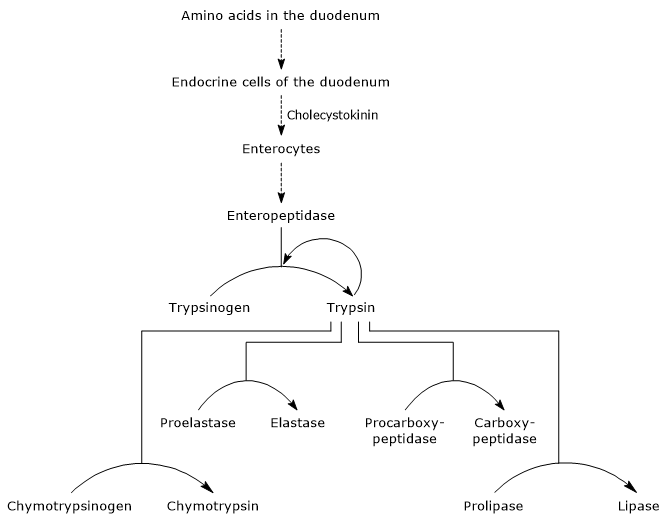
したがって、膵臓のzymogensが活動化させると同時に蛋白質を消化する十二指腸の機能は、すべて少量のenteropeptidaseによって誘発されて増加します。
- キモトリプシノーゲンのキモトリプシンへの活性化は、トリプシンと活性化されたキモトリプシン自体が関与する異なるステップを経て起こる。
最初のステップでは、トリプシンは特定のペプチド結合の切断を触媒し、これは完全に活性であるγ-キモトリプシンへのキモトリプシノーゲンの活性化 その後、γ-キモトリプシン自体は、より安定な形態の酵素であるδ-キモトリプシンの形成を伴う二つのジペプチドの放出を触媒する。 δ-キモトリプシンは二つの立体配座変化を受け、その最初のものはγ-キモトリプシンの形成をもたらし、第二のものはα-キモトリプシン、酵素の最終活性型である。
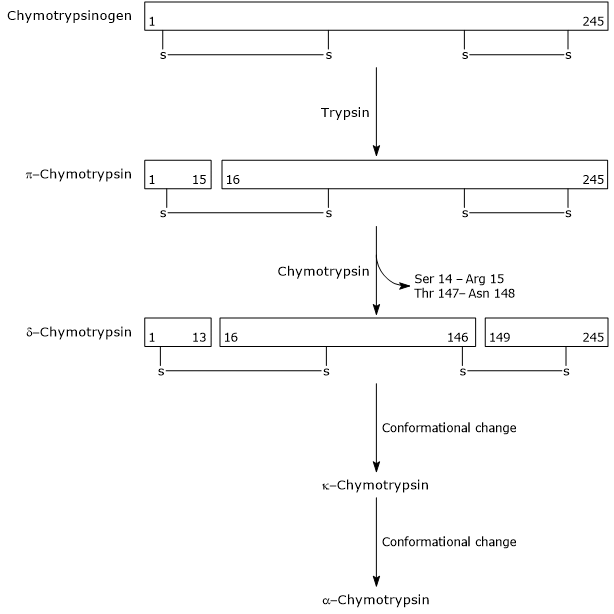
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
エラスターゼは、他の消化加水分解酵素よりも特異的ではなく、グリシン、アラニン、セリンなどのアミノ酸に隣接するペプチド結合の切断を触媒する。 - Procarboxypeptidase
Procarboxypeptidase AはカルボキシペプチダーゼAに活性化され、プロテアーゼはフェニルアラニンやバリンなどの分岐または芳香族側鎖とアミノ酸に隣接するペプ
プロカルボキシペプチダーゼBは、リジンやアルギニンなどの塩基性側鎖を持つアミノ酸に特異的なカルボキシペプチダーゼBに活性化される。
上記のプロテアーゼは、ペプシンとは異なり、7-8、すなわち中性または弱アルカリ性の範囲の最適なpHを有する。
膵トリプシン阻害剤
膵内トリプシン活性に対する”追加の”保護システムがあります:”膵トリプシン阻害剤”と呼ばれる阻害剤の合成。 膵臓のzymogen granules粒中に存在する分子は、それを不活性化する酵素の活性部位に非常に緊密に結合することができる。 このようにして、トリプシノーゲンの早期活性化に起因する任意のトリプシンの活性がブロックされ、いくつかの活性化された分子がすべての膵zymogensを活性化する状況を防止する。
植物には、同様の活性を持つ多くの分子があります。 一例は、主に大豆に見られるタンパク質であるKunitzトリプシン阻害剤であり、トリプシンの活性部位と非常に安定した複合体を形成する。
上記のプロテアーゼは、異なるアミノ酸に隣接するペプチド結合に作用する、明確な基質特異性を有するので、プロテアーゼによって生成された各ペ このように十二指腸に入る部分的に消化された蛋白質は2-8残余の自由なアミノ酸そしてペプチッドに効率的に加水分解されます。 これらのペプチドは、腸細胞から分泌され、それらの微絨毛に関連するアミノペプチダーゼの基質である。
ジペプチダーゼも存在する。
同じプロテアーゼが最終的に消化され、プロセスが終了することに留意すべきである。
腸のタンパク質消化におけるタンパク質分解酵素の重要性と有効性は、この例から理解することができます。 In vitroでタンパク質をその構成アミノ酸に加水分解したい場合は、強力で濃縮された酸を触媒として使用し、105℃で一晩加熱する必要があります。 腸では、同じ結果が数時間で得られ、胃の比較的酸性環境で最初に作動し、次いで十二指腸の軽度のアルカリ性状態で37℃で作動する。
放出されたアミノ酸は、ジペプチドおよびトリペプチドとともに、腸細胞によって吸収される。 ジおよびトリペプチドは、通常、腸細胞内の構成アミノ酸に加水分解され、これは実質的に遊離アミノ酸のみが門脈循環に存在する理由を説明する。Bender d.A.Benders’dictionary of nutrition and food technology.
ベンダー D.A.ベンダーの栄養と食品技術の辞書。 第8版。 ウッドヘッド出版 オックスフォード大学、2006年
ベンダー D.A.栄養と代謝の紹介。 第3版。 Taylor&Francis,2004
Berg J.M.,Tymoczko J.L.,And Stryer L. 生化学だ 第5版。 W.H.Freeman and Company,2002
Bhagavan N.V.,Ha C-E.医療生化学の必需品:臨床例を用いて。 第4版。 Academic Press,2015
Cozzani I.and Dainese E.Biochimica degli alimenti e della nutrizione. Piccin Editore,2006
Nelson D.L.,Cox M.M.Lehninger. 生化学の原理。 第4版。 W.H.Freeman and Company,2004
Rawn J.D.Biochimica. Mc Graw-Hill,Neil Patterson Publishers,1990
Rosenthal M.D.,Glew R.H.Medical Biochemistry:human metabolism in health and disease. John Wiley&Sons,INC.、出版、2009
Stipanuk M.H.、Caudill M.A.人間の栄養物の生化学的な、生理学的な、および分子面。 第3版。 エルゼビア健康科学、2013