2.1: Evolution der Atomtheorie
Atomtheorie nach dem neunzehnten Jahrhundert
Wenn Materie aus Atomen bestand, woraus bestanden Atome? Waren es die kleinsten Teilchen oder gab es etwas Kleineres? In den späten 1800er Jahren untersuchten eine Reihe von Wissenschaftlern, die sich für Fragen wie diese interessierten, die elektrischen Entladungen, die in Niederdruckgasen erzeugt werden könnten, mit der bedeutendsten Entdeckung des englischen Physikers JJ Thomson unter Verwendung einer Kathodenstrahlröhre. Diese Vorrichtung bestand aus einem verschlossenen Glasrohr, aus dem fast die gesamte Luft entfernt worden war; Das Rohr enthielt zwei Metallelektroden. Wenn an die Elektroden Hochspannung angelegt wurde, erschien zwischen ihnen ein sichtbarer Strahl, der als Kathodenstrahl bezeichnet wird. Dieser Strahl wurde zur positiven Ladung hin und von der negativen Ladung weg abgelenkt und in gleicher Weise mit identischen Eigenschaften erzeugt, wenn verschiedene Metalle für die Elektroden verwendet wurden. In ähnlichen Experimenten wurde der Strahl gleichzeitig durch ein angelegtes Magnetfeld abgelenkt, und Messungen des Ausmaßes der Ablenkung und der Magnetfeldstärke ermöglichten es Thomson, das Verhältnis von Ladung zu Masse der Kathodenstrahlpartikel zu berechnen. Die Ergebnisse dieser Messungen zeigten, dass diese Teilchen viel leichter waren als Atome (Abbildung \(\pageIndex{1}\)).
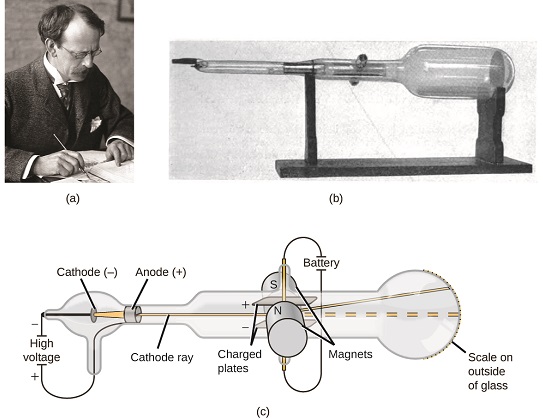
Abbildung \(\pageIndex{5}\): (a) J. J. Thomson erzeugte einen sichtbaren Strahl in einer Kathodenstrahlröhre. (b) Dies ist eine frühe Kathodenstrahlröhre, die 1897 von Ferdinand Braun erfunden wurde. (c) Im Kathodenstrahl kommt der Strahl (gelb dargestellt) von der Kathode und wird an der Anode vorbei zu einer fluoreszierenden Skala am Ende der Röhre beschleunigt. Gleichzeitige Ablenkungen durch angelegte elektrische und magnetische Felder ermöglichten es Thomson, das Masse-Ladungs-Verhältnis der Teilchen zu berechnen, aus denen der Kathodenstrahl besteht. (credit a: Modifikation der Arbeit von Nobel Foundation; credit b: Modifikation der Arbeit von Eugen Nesper; credit c: Modifikation der Arbeit von „Kurzon“ / Wikimedia Commons).
Basierend auf seinen Beobachtungen hat Thomson Folgendes vorgeschlagen und warum: Die Teilchen werden von positiven (+) Ladungen angezogen und von negativen (−) Ladungen abgestoßen, daher müssen sie negativ geladen sein (wie Ladungen abstoßen und im Gegensatz zu Ladungen anziehen); Sie sind weniger massiv als Atome und unabhängig vom Ausgangsmaterial nicht unterscheidbar. Obwohl zu dieser Zeit umstritten, wurde Thomsons Idee allmählich akzeptiert, und sein Kathodenstrahlteilchen ist das, was wir heute ein Elektron nennen, ein negativ geladenes, subatomares Teilchen mit einer Masse, die mehr als tausendmal geringer ist als die eines Atoms. Der Begriff „Elektron“ wurde 1891 vom irischen Physiker George Stoney aus „electric ion.“
1909 entdeckte der amerikanische Physiker Robert A. Millikan weitere Informationen über das Elektron durch seine „Öltropfen“ -Experimente. Millikan erzeugte mikroskopisch kleine Öltröpfchen, die durch Reibung oder durch Röntgenstrahlen elektrisch aufgeladen werden konnten. Diese Tröpfchen fielen zunächst aufgrund der Schwerkraft, aber ihr Abwärtsfortschritt konnte durch ein niedrigeres elektrisches Feld in der Vorrichtung verlangsamt oder sogar umgekehrt werden. Durch Einstellen der elektrischen Feldstärke und sorgfältige Messungen und entsprechende Berechnungen konnte Millikan die Ladung an einzelnen Tropfen bestimmen (Abbildung \(\pageIndex{2}\)).
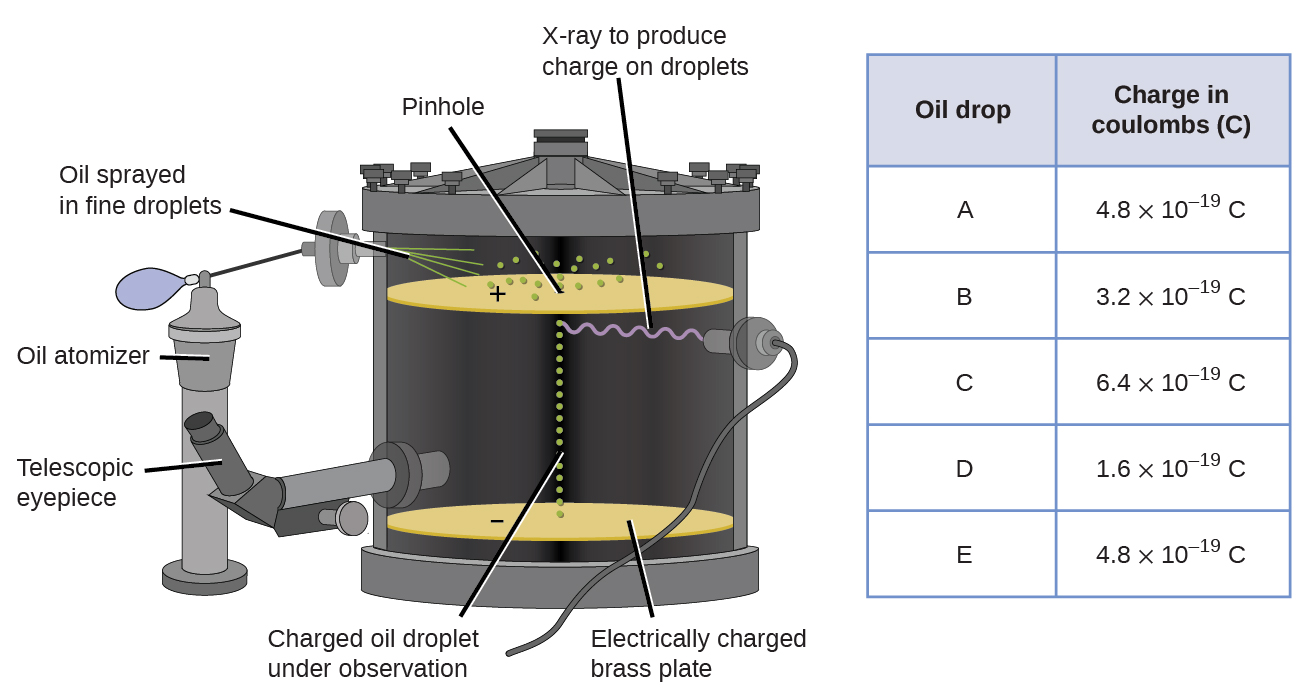
Abbildung \(\pageIndex{6}\): Millikans Experiment maß die Ladung einzelner Öltropfen. Die tabellarischen Daten sind Beispiele für einige mögliche Werte.
Wenn Sie sich die von Millikan gesammelten Ladungsdaten ansehen, haben Sie möglicherweise erkannt, dass die Ladung eines Öltropfens immer ein Vielfaches einer bestimmten Ladung ist, 1,6 \ (\ times\) 10-19 C. Millikan kam zu dem Schluss, dass dieser Wert daher eine Grundladung sein muss — die Ladung eines einzelnen Elektrons — mit seinen gemessenen Ladungen aufgrund eines Überschusses von einem Elektron (1 mal 1.6 \ (\times\) 10-19 C), zwei Elektronen (2 mal 1,6 \ (\times\) 10-19 C), drei Elektronen (3 mal 1,6 \ (\times\) 10-19 C), und so weiter, auf einem gegebenen Öltröpfchen. Da die Ladung eines Elektrons nun aufgrund von Millikans Forschung bekannt war und das Verhältnis von Ladung zu Masse bereits aufgrund von Thomsons Forschung bekannt war (1,759 \ (\ times \) 1011 C / kg), war nur eine einfache Berechnung erforderlich, um auch die Masse des Elektrons zu bestimmen.
\
Wissenschaftler hatten nun festgestellt, dass das Atom nicht unteilbar war, wie Dalton geglaubt hatte, und aufgrund der Arbeit von Thomson, Millikan und anderen waren die Ladung und Masse der negativen, subatomaren Teilchen — der Elektronen — bekannt. Der positiv geladene Teil eines Atoms war jedoch noch nicht gut verstanden. 1904 schlug Thomson das „Plumpudding“ -Modell der Atome vor, das eine positiv geladene Masse mit gleicher negativer Ladung in Form von darin eingebetteten Elektronen beschrieb, da alle Atome elektrisch neutral sind. Ein konkurrierendes Modell wurde 1903 von Hantaro Nagaoka vorgeschlagen, der ein saturnähnliches Atom postulierte, das aus einer positiv geladenen Kugel bestand, die von einem Elektronenhalo umgeben war (Abbildung \(\pageIndex {3} \)).
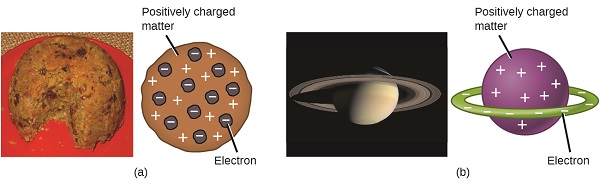
Abbildung \(\pageIndex{7}\): (a) Thomson schlug vor, dass Atome Plumpudding ähnelten, einem englischen Dessert, das aus feuchtem Kuchen mit eingebetteten Rosinen („Pflaumen“) bestand. (b) Nagaoka schlug vor, dass Atome dem Planeten Saturn ähnelten, mit einem Ring von Elektronen, der einen positiven „Planeten“ umgibt.“ (credit a: Änderung der Arbeit von „Man vyi“ / Wikimedia Commons; credit b: Änderung der Arbeit von „NASA“ / Wikimedia Commons).
Die nächste große Entwicklung im Verständnis des Atoms kam von Ernest Rutherford, einem Physiker aus Neuseeland, der seine wissenschaftliche Karriere größtenteils in Kanada und England verbrachte. Er führte eine Reihe von Experimenten mit einem Strahl aus schnellen, positiv geladenen Alphateilchen (α-Teilchen) durch, die durch den radioaktiven Zerfall von Radium erzeugt wurden; α-Teilchen bestehen aus zwei Protonen und zwei Neutronen (mehr über den radioaktiven Zerfall erfahren Sie im Kapitel Kernchemie). Rutherford und seine Kollegen Hans Geiger (später berühmt für den Geigerzähler) und Ernest Marsden richteten einen Strahl aus α-Partikeln, dessen Quelle in einen Bleiblock eingebettet war, um den größten Teil der Strahlung zu absorbieren, auf ein sehr dünnes Stück Goldfolie und untersuchten die resultierende Streuung der α-Partikel mit einem Leuchtschirm, der kurz glühte, wenn er von einem α-Partikel getroffen wurde.
Was haben sie entdeckt? Die meisten Partikel passierten die Folie, ohne überhaupt abgelenkt zu werden. Einige wurden jedoch leicht abgelenkt, und eine sehr kleine Anzahl wurde fast direkt zurück zur Quelle abgelenkt (Abbildung \(\pageIndex {4} \)). Rutherford beschrieb das Finden dieser Ergebnisse wie folgt: „Es war das unglaublichste Ereignis, das mir jemals in meinem Leben passiert ist. Es war fast so unglaublich, als würde man eine 15-Zoll-Granate auf ein Stück Seidenpapier abfeuern und es kam zurück und traf dich“1 (S. 68).
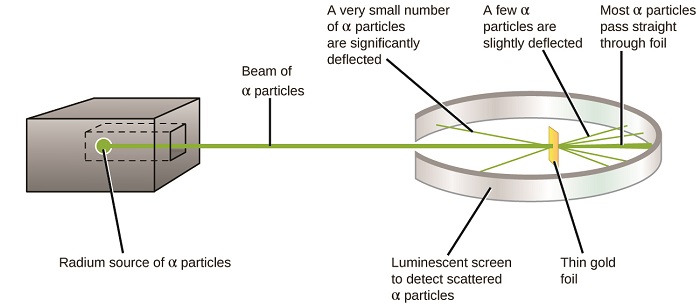
Abbildung \(\pageIndex{8}\): Geiger und Rutherford feuerten α-Partikel auf ein Stück Goldfolie und entdeckten, wohin diese Partikel gingen, wie in diesem schematischen Diagramm ihres Experiments gezeigt. Die meisten Partikel passierten direkt die Folie, aber einige wurden leicht abgelenkt und eine sehr kleine Anzahl wurde signifikant abgelenkt.
Rutherford folgerte Folgendes: Da die meisten der sich schnell bewegenden α-Teilchen die Goldatome undeflektiert passierten, müssen sie im Wesentlichen durch den leeren Raum innerhalb des Atoms gereist sein. Alphateilchen sind positiv geladen, so dass Ablenkungen auftraten, wenn sie auf eine andere positive Ladung stießen (wie Ladungen sich gegenseitig abstoßen). Da sich ähnliche Ladungen gegenseitig abstoßen, müssen die wenigen positiv geladenen α-Teilchen, die abrupt ihren Weg änderten, einen anderen Körper getroffen oder sich ihm nahe genähert haben, der ebenfalls eine hochkonzentrierte positive Ladung aufwies. Da die Umlenkungen nur einen Bruchteil der Zeit auftraten, nahm diese Ladung nur einen kleinen Teil des Raums in der Goldfolie ein. Rutherford analysierte eine Reihe solcher Experimente im Detail und zog zwei Schlussfolgerungen:
- Das von einem Atom eingenommene Volumen muss aus einer großen Menge leeren Raums bestehen.
- Ein kleiner, relativ schwerer, positiv geladener Körper, der Kern, muss sich im Zentrum jedes Atoms befinden.
Diese Analyse veranlasste Rutherford, ein Modell vorzuschlagen, in dem ein Atom aus einem sehr kleinen, positiv geladenen Kern besteht, in dem der größte Teil der Masse des Atoms konzentriert ist, umgeben von den negativ geladenen Elektronen, so dass das Atom elektrisch neutral ist (Abbildung \(\pageIndex{5}\)).
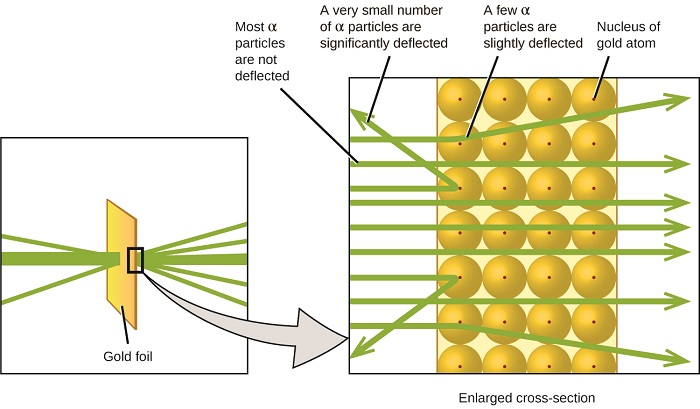
Abbildung \(\pageIndex{9}\): Die α-Teilchen werden nur dann abgelenkt, wenn sie mit dem viel schwereren, positiv geladenen Goldkern kollidieren oder sich ihm nähern. Da der Kern im Vergleich zur Größe eines Atoms sehr klein ist, werden nur sehr wenige α-Teilchen abgelenkt. Die meisten passieren den relativ großen Bereich, der von Elektronen besetzt ist, die zu leicht sind, um die sich schnell bewegenden Teilchen abzulenken.Nach vielen weiteren Experimenten entdeckte Rutherford auch, dass die Kerne anderer Elemente den Wasserstoffkern als „Baustein“ enthalten, und er nannte dieses grundlegendere Teilchen das Proton, das positiv geladene, subatomare Teilchen im Kern. Mit einem Zusatz, den Sie als nächstes lernen werden, wird dieses vor über einem Jahrhundert vorgeschlagene Kernmodell des Atoms noch heute verwendet.
Ein weiterer wichtiger Befund war die Entdeckung von Isotopen. In den frühen 1900er Jahren identifizierten Wissenschaftler mehrere Substanzen, die als neue Elemente erschienen, und isolierten sie aus radioaktiven Erzen. Beispielsweise, Ein „neues Element“, das durch den radioaktiven Zerfall von Thorium erzeugt wurde, erhielt ursprünglich den Namen Mesothorium. Eine detailliertere Analyse zeigte jedoch, dass Mesothorium chemisch identisch mit Radium (einem anderen Zerfallsprodukt) war, obwohl es eine andere Atommasse hatte. Dieses Ergebnis, zusammen mit ähnlichen Ergebnissen für andere Elemente, führte den englischen Chemiker Frederick Soddy zu der Erkenntnis, dass ein Element Arten von Atomen mit unterschiedlichen Massen haben könnte, die chemisch nicht unterscheidbar waren. Diese verschiedenen Typen werden Isotope genannt – Atome desselben Elements, die sich in der Masse unterscheiden. Für diese Entdeckung erhielt Soddy 1921 den Nobelpreis für Chemie.
Ein Rätsel blieb: Es war bekannt, dass der Kern fast die gesamte Masse eines Atoms enthielt, wobei die Anzahl der Protonen nur die Hälfte oder weniger dieser Masse lieferte. Es wurden verschiedene Vorschläge gemacht, um zu erklären, was die verbleibende Masse ausmachte, einschließlich der Existenz neutraler Teilchen im Kern. Wie zu erwarten, ist der Nachweis ungeladener Teilchen eine große Herausforderung, und erst 1932 fand James Chadwick Hinweise auf Neutronen, ungeladene subatomare Teilchen mit einer Masse, die ungefähr der von Protonen entspricht. Die Existenz des Neutrons erklärte auch Isotope: Sie unterscheiden sich in der Masse, weil sie eine unterschiedliche Anzahl von Neutronen haben, aber sie sind chemisch identisch, weil sie die gleiche Anzahl von Protonen haben. Dies wird später in dieser Einheit näher erläutert.