5.3: Lewis-Diagramme
Lewis verwendete einfache Diagramme (jetzt Lewis-Diagramme genannt), um zu verfolgen, wie viele Elektronen in der äußersten oder Valenzhülle eines bestimmten Atoms vorhanden waren. Der Kern des Atoms, d. H. Der Kern zusammen mit den inneren Elektronen, wird durch das chemische Symbol dargestellt, und nur die Valenzelektronen sind als Punkte gezeichnet, die das chemische Symbol umgeben. Somit können die drei in Abbildung 1 gezeigten Atome aus Elektronen und Valenz durch die folgenden Lewis-Diagramme dargestellt werden:
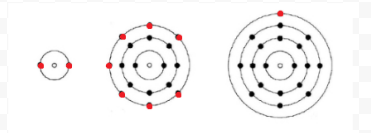

Wenn es sich bei dem Atom um ein Edelgasatom handelt, sind zwei alternative Verfahren möglich. Entweder können wir das Atom als Nullvalenzelektronen betrachten oder wir können die äußerste gefüllte Schale als Valenzschale betrachten. Die ersten drei Edelgase können somit wie folgt geschrieben werden:
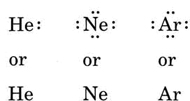
Beispiel \(\pageIndex{1}\): Lewis-Strukturen
Zeichnen Sie Lewis-Diagramme für ein Atom jedes der folgenden Elemente: Li, N, F, Na
Lösung
Wir finden aus dem Periodensystem in der vorderen Abdeckung, dass Li eine Ordnungszahl von 3 hat. Es enthält somit drei Elektronen, eines mehr als das Edelgas He. Dies bedeutet, dass die äußerste oder Valenzschale nur ein Elektron enthält und das Lewis-Diagramm

Nach der gleichen Argumentation hat N sieben Elektronen, fünf mehr als Er, während F neun Elektronen hat, sieben mehr als Er, was
![]()
Na hat neun Elektronen mehr als He, aber acht davon befinden sich im Kern, was den acht Elektronen in der äußersten Schale von Ne entspricht. Da Na nur 1 Elektron mehr als Ne hat, ist sein Lewis-Diagramm
![]()
Beachten Sie aus dem vorhergehenden Beispiel, dass die Lewis-Diagramme der Alkalimetalle bis auf ihre chemischen Symbole identisch sind. Dies stimmt gut mit dem sehr ähnlichen chemischen Verhalten der Alkalimetalle überein. Ähnlich, Lewis-Diagramme für alle Elemente in anderen Gruppen, wie die Erdalkalimetalle oder Halogene, gleich aussehen.
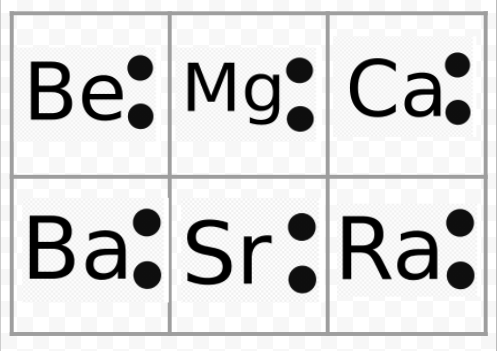
Die Lewis-Diagramme können auch verwendet werden, um die Valenzen der Elemente vorherzusagen. Lewis schlug vor, dass die Anzahl der Valenzen eines Atoms gleich der Anzahl der Elektronen in seiner Valenzschale oder der Anzahl der Elektronen wäre, die der Valenzschale hinzugefügt werden müssten, um die elektronische Schalenstruktur des nächsten Edelgases zu erreichen. Betrachten Sie als Beispiel für diese Idee die Elemente Be und O. Ihre Lewis-Diagramme und die der Edelgase He und Ne sind

Wenn wir Be mit He vergleichen, sehen wir, dass ersteres zwei weitere Elektronen hat und daher eine Wertigkeit von 2 haben sollte. Man könnte erwarten, dass das Element O eine Wertigkeit von 6 oder eine Wertigkeit von 2 hat, da es sechs Valenzelektronen hat — zwei weniger als Ne. Unter Verwendung der auf diese Weise entwickelten Valenzregeln, Lewis konnte die regelmäßige Zunahme und Abnahme der Indizes der Verbindungen in der Tabelle im Valenzabschnitt berücksichtigen, und hier reproduziert. Darüber hinaus konnte er mehr als 50 Prozent der Formeln in der Tabelle ausmachen. (Diejenigen, die mit seinen Ideen übereinstimmen, sind in der Tabelle farblich schattiert. Vielleicht möchten Sie sich jetzt auf diese Tabelle beziehen und überprüfen, ob einige der angegebenen Formeln den Lewis-Regeln entsprechen. Lewis ‚Erfolg in diesem Zusammenhang gab einen klaren Hinweis darauf, dass Elektronen der wichtigste Faktor waren, um Atome zusammenzuhalten, wenn Moleküle gebildet wurden.
Trotz dieser Erfolge gibt es auch Schwierigkeiten in Lewis ‚Theorien, insbesondere für Elemente jenseits von Kalzium im Periodensystem. Das Element Br (Z = 35) hat beispielsweise 17 Elektronen mehr als das Edelgas Ar (Z = 18). Dies führt uns zu dem Schluss, dass Br 17 Valenzelektronen hat, was es schwierig macht zu erklären, warum Br Cl und F so ähnlich ist, obwohl diese beiden Atome nur sieben Valenzelektronen haben.
| Element | Atomic Weight | Hydrogen Compounds | Oxygen Compounds | Chlorine Compounds |
|---|---|---|---|---|
| Hydrogen | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | None formed | None formed | None formed |
| Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | None formed | None formed | None formed |
| Sodium | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
| Aluminum | 26.98 | AlH3 | Al2O3 | AlCl3 |
| Silicon | 28.09 | SiH4, Si2H6 | SiO2 | SiCl4, Si2Cl6 |
| Phosphorus | 30.97 | PH3, P2H4 | P4O10, P4O6 | PCl3, PCl5, P2Cl4 |
| Sulfur | 32.06 | H2S, H2S2 | SO2, SO3 | S2Cl2, SCl2, SCl4 |
| Chlorine | 35.45 | HCl | Cl2O, ClO2, Cl2O7 | Cl2 |
| Potassium | 39.10 | KH | K2, K2O2, KO2 | KCl |
| Argon | 39.95 | None formed | None formed | None formed |
| Calcium | 40.08 | CaH2 | CaO, CaO2 | CaCl2 |
| Scandium | 44.96 | Relatively Unstable | Sc2O3 | ScCl3 |
| Titanium | 47.90 | TiH2 | TiO2, Ti2O3, TiO | TiCl4, TiCl3, TiCl2 |
| Vanadium | 50.94 | VH2 | V2O5, V2O3, VO2, VO | VCl4, VCl3, VCl2 |
| Chromium | 52.00 | CrH2 | Cr2O3, CrO2, CrO3 | CrCl3, CrCl2 |
Contributors
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Universität von Minnesota Rochester), Tim Wendorff und Adam Hahn.