Chemie für Nicht-Majors
Wie verändert sich die Energie dieses Arbeiters, wenn er die Leiter auf und ab klettert?
Eine Leiter zu besteigen kostet Energie. Bei jedem Schritt drängst du dich gegen die Schwerkraft und sammelst potentielle Energie an. Wenn Sie wieder herunterkommen, wird diese potentielle Energie freigesetzt, wenn Sie Schritt für Schritt absteigen. Wenn Sie nicht aufpassen, können Sie diese potentielle Energie auf einmal freisetzen, wenn Sie von der Leiter fallen (niemals eine gute Idee). Darüber hinaus nehmen Sie den Aufstieg oder Abstieg in Schritten. Es gibt keine „Dazwischen“ -Position auf der Leiter – Ihr Fuß trifft entweder auf eine Sprosse oder auf einen leeren Raum und Sie sind in Schwierigkeiten, bis Sie eine Sprosse finden, auf der Sie stehen können.

Nach den Entdeckungen von Wasserstoffemissionsspektren und dem photoelektrischen Effekt schlug der dänische Physiker Niels Bohr (1885-1962) 1915 ein neues Modell des Atoms vor. Bohr schlug vor, dass Elektronen keine Energie ausstrahlen, wenn sie den Kern umkreisen, sondern in Zuständen konstanter Energie existieren, die er stationäre Zustände nannte. Dies bedeutet, dass die Elektronen in festen Abständen vom Kern umkreisen (siehe Abbildung unten). Bohrs Arbeit basierte hauptsächlich auf den Emissionsspektren von Wasserstoff. Dies wird auch als Planetenmodell des Atoms bezeichnet. Es erklärte das Innenleben des Wasserstoffatoms. Bohr erhielt den Nobelpreis für Physik im Jahr 1922 für seine Arbeit.
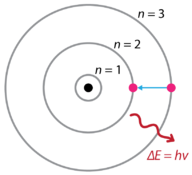
Abbildung 1. Bohrs Atommodell Wasserstoffemissionsspektren.
Bohr erklärte, dass Elektronen mit der Zugabe von Energie in verschiedene Bahnen bewegt werden können. Wenn die Energie entfernt wird, kehren die Elektronen in ihren Grundzustand zurück und emittieren eine entsprechende Energiemenge – ein Lichtquant oder Photon. Dies war die Grundlage für das, was später als Quantentheorie bekannt wurde . Dies ist eine Theorie, die auf dem Prinzip basiert, dass Materie und Energie die Eigenschaften von Teilchen und Wellen haben. Es erklärt eine breite Palette physikalischer Phänomene, einschließlich der Existenz diskreter Energie- und Materiepakete, der Unschärferelation, und das Ausschlussprinzip.
Nach dem Bohr-Modell, das oft als Planetenmodell bezeichnet wird, umkreisen die Elektronen den Kern des Atoms in bestimmten zulässigen Bahnen, die als Umlaufbahnen bezeichnet werden. Wenn sich das Elektron in einer dieser Bahnen befindet, ist seine Energie fixiert. Der Grundzustand des Wasserstoffatoms, in dem seine Energie am niedrigsten ist, ist, wenn sich das Elektron in der Umlaufbahn befindet, die dem Kern am nächsten liegt. Die Umlaufbahnen, die weiter vom Kern entfernt sind, sind alle von sukzessive größerer Energie. Das Elektron darf keinen der Räume zwischen den Bahnen einnehmen. Eine alltägliche Analogie zum Bohr-Modell sind die Sprossen einer Leiter. Wenn Sie sich eine Leiter hinauf oder hinunter bewegen, können Sie nur bestimmte Sprossen belegen und können sich nicht in den Zwischenräumen zwischen den Sprossen befinden. Wenn Sie die Leiter hinaufgehen, erhöht sich Ihre potentielle Energie, während Sie die Leiter hinuntergehen, verringert sich Ihre Energie.
Bohrs Arbeit hatte einen starken Einfluss auf unser modernes Verständnis des Innenlebens des Atoms. Sein Modell funktionierte jedoch gut für eine Erklärung für die Emissionen des Wasserstoffatoms, war jedoch bei Anwendung auf andere Atome stark eingeschränkt. Kurz nachdem Bohr sein Planetenmodell des Atoms veröffentlicht hatte, wurden mehrere neue Entdeckungen gemacht, die wiederum zu einer überarbeiteten Sicht des Atoms führten.
Zusammenfassung
- Das Bohr-Modell postuliert, dass Elektronen den Kern mit festen Energieniveaus umkreisen.
- Weiter vom Kern entfernte Bahnen existieren auf höheren Energieniveaus.
- Wenn Elektronen auf ein niedrigeres Energieniveau zurückkehren, emittieren sie Energie in Form von Licht.
Praxis
Verwenden Sie den folgenden Link, um die folgenden Fragen zu beantworten:
- Wie verändert ein Elektron seine Umlaufbahnen?
- Worauf basierte das Bohr-Modell?
- Was glaubte Bohr über die Umlaufbahnen?
- Funktioniert Bohrs Modell für alle Atome?
Review
- Wann schlug Bohr sein Modell des Atoms vor?
- Was ist ein stationärer Zustand?
- Was ist der Grundzustand?
- Kann das Elektron irgendeinen Raum zwischen den Bahnen einnehmen?
Glossar
- Planetenmodell: Eine Möglichkeit, Bohrs Modell des Atoms zu beschreiben.
- Quantentheorie: Materie und Energie haben die Eigenschaften von Teilchen und Wellen.
- stationärer Zustand: Elektronen kreisen in fester Entfernung vom Kern.