proteinfordøjelse: trin, hormoner
kroppen kræver proteiner, og især de essentielle aminosyrer, der er indeholdt i dem. Det anbefalede daglige indtag for et sundt voksent individ er 0,85 g/kg kropsvægt, så for en person på 70 kg er omkring 60 g, men ofte i den typiske vestlige diæt er indtaget større end 100 g / dag.
ud over fødevareproteiner fordøjer kroppen også 50-100 g endogene proteiner, der udskilles eller tabes i lumen i mave-tarmkanalen, og som skyldes:
- spyt;
- mavesaft;
- pancreasceller og andre sekretioner;
- tarmceller, der flager af;
- proteiner, der passerer ind i tarmlumen fra blodbanen.
denne blanding fordøjes effektivt og absorberes i tolvfingertarmen, den første og den korteste del af tyndtarmen, med et dagligt tab gennem fæces svarende til ca.1,6 g nitrogen svarende til 10 g protein. Det meste af det tabte kvælstof bruges af mikrofloraen i tyktarmen til dets vækst, og det findes således i fæces som en del af bakteriemassen.
INDHOLD
- fordøjelsesenzymer
- Rolle madlavning og tygge mad
- Stadier af protein fordøjelse
- Mave og protein fordøjelse
- Protein fordøjelse og pepsin
- Duodenum og protein fordøjelse
- Aktivering af pancreas zymogens
- i Bugspytkirtlen trypsin inhibitor
- Mave og protein fordøjelse
fordøjelsesenzymer
Protein fordøjelse opstår som et resultat af hydrolyse af peptid-obligationer, der binder de enkelte aminosyrer i polypeptid kæde. Disse reaktioner katalyseres af såkaldte proteaser.
de intestinale proteaser, der er specifikke for aminosyresiden-kæden, er hydrolaser, der kan opdeles i to klasser:
- endopeptidaser, som hydrolyserer peptidbindinger i polypeptidkæden og produceres af maven og den eksokrine bugspytkirtel;
- eksopeptidaser, der kan opdeles i to grupper:
carboksypeptidasen, som fjerner aminosyrer fra C-terminal ende, og som kan opdeles i to grupper: produceres af den eksokrine bugspytkirtel;
aminopeptidasen, som virker på den N-terminale ende og produceres af enterocytterne.

disse ensymer syntetiseres og udskilles i en inaktiv form, kaldet prosymer eller prosymer.
inde i cellen, er de lagret inde i membran-afgrænset granulat kaldet de. Når cellen stimuleres af det specifikke signal, frigives granulatmembranen med plasmamembranen og symogener ved eksocytose.
disse proteaser syntetiseres i en inaktiv form for at undgå, at de, før de udskilles, fordøjer sig selv og/eller vævsproteiner. Det, der sker, er, at det aktive sted er “maskeret”, og først efter aktivering kan proteinet virke på substratet. Aktiveringen er resultatet af spaltningen, katalyseret af et specifikt ferment, af en eller flere specifikke peptidbindinger med frigivelse af et eller flere segmenter af polypeptidkæden. Dette gør det muligt for molekylet at antage en tredimensionel konformation, hvor det aktive sted er frit og korrekt konfigureret.
selv deres ophobning i granulerne er et beskyttelsessystem: det isolerer dem fra de andre molekyler, der er til stede i cellen.
de fleste proteiner i deres native konformation er resistente over for proteasernes virkning. Dette er en konsekvens af deres sekundære og tertiære eller indfødte struktur, der maskerer mange bindinger til virkningen af ensymerne. Disse strukturer stabiliseres af kovalente bindinger, såsom disulfidbroer mellem cysteinrester og ikke-kovalente kræfter, såsom Ioniske interaktioner, hydrogenbindinger og van Der-Vejkræfter.
for en tilstrækkelig proteinfordøjelse er det derfor vigtigt, at peptidbindinger er så tilgængelige som muligt for virkningen af tarmproteaser. Dette opnås uden for kroppen gennem madlavning af mad og i kroppen af det sure miljø i maven.
rolle madlavning og tygning af mad
madlavning af mad, når det ikke er overdreven, Letter proteinfordøjelsen.
På hvilken måde?
som alle molekyler er også proteiner ikke ubevægelige, men vibrerer. Når temperaturen stiger, vibrerer proteinerne med en større amplitude, op til at ødelægge de ikke-kovalente bindinger, der bidrager til opretholdelsen af den native struktur. Derfor forekommer en konformationsændring af proteinet, det vil sige molekylet denatureres. Dette kan gøre interne peptidbindinger mere tilgængelige for virkningen af fordøjelsessymer.
selv tygge og insalivation af fødevarer homogeniserer og befugter de faste komponenter i selve fødevaren, hvilket letter fordøjelsen af mave og tyndtarm.
stadier af proteinfordøjelse
to faser er involveret i fordøjelsen af proteiner: den første forekommer i maven og den anden i i tolvfingertarmen, den første del af tyndtarmen.
mave-og proteinfordøjelse
proteinfordøjelse begynder i maven, og dette er et “forberedelsesstadium” sammenlignet med de hændelser, der opstår i tolvfingertarmen.
tilstedeværelsen af mad i maven stimulerer G-celler i slimhinden i gastrisk antrum og proksimal tolvfingertarm til at producere og frigive hormonet gastrin i blodbanen. Hormonet stimulerer parietalcellerne i de rigtige gastriske kirtler, lokaliseret for det meste i bunden af organet, til at producere og udskille saltsyre i maven (parietalceller producerer også den iboende faktor, et protein, der binder vitamin B12, forhindrer dets ødelæggelse og tillader det at blive absorberet).
i de rigtige gastriske kirtler fandt du også:
- slimhindeceller, der producerer slim;
- hovedceller, der frigiver pepsinogen.
alle disse stoffer er sammen med andre, såsom kaliumioner og gastrisk lipase, til stede i mavesaften, som har en pH, der ligger mellem 1 og 2, 5.
På grund af sin lave pH har mavesaften en antiseptisk virkning, der dræber de fleste bakterier og andre fremmede celler og en denaturerende virkning, da den bryder de ikke-kovalente bindinger, der opretholder den oprindelige struktur af proteiner. Denne denatureringseffekt letter adgangen til intestinal protease til peptidbindinger, som opvarmning under madlavning. Nogle proteiner, der er rige på disulfidbindinger, såsom keratiner, er resistente over for denaturering ved lav pH og er derfor vanskelige at fordøje. Tværtimod hydrolyseres de fleste af de kugleformede proteiner næsten fuldstændigt til bestanddele af aminosyrer.
endelig aktiverer den lave pH i mavesaften pepsinogen, et symogen, til pepsin, det første fsym, der er involveret i proteinfordøjelsen.
proteinfordøjelse og pepsin
der er forskellige isoensymer af pepsinogen, såsom type i, syntetiseret af cellerne i kroppen og fundus i maven og type II, der produceres i alle organets regioner. Alle isoensymer omdannes til det aktive isoensym. Aktiveringen sker via autokatalyse ved pH-værdier under 5 ved en intramolekylær proces, der består i hydrolysen af en specifik peptidbinding og frigivelse af et lille peptid fra den N-terminale ende af proensymet. Dette peptid forbliver bundet til pepsinet og fortsætter med at virke som en hæmmer, indtil pH-værdien falder til under 2, eller indtil den nedbrydes yderligere af pepsin selv. Så når noget pepsin er dannet, aktiverer dette hurtigt andre pepsinogenmolekyler.
Pepsin, en endopeptidase med en optimal pH-aktivitet ved 1,6, hydrolyserer 10-20% af proteinerne i måltidet. Mange fordøjelsessymer er i stand til at virke på en lang række substrater, og pepsin er ingen undtagelse, der katalyserer spaltningen af peptidbindinger ved siden af aminosyrerester, såsom leucin og phenylalanin, tyrosin og tryptophan (aromatiske aminosyrer). En blanding af peptider af stor størrelse og nogle få frie aminosyrer fremstilles.
Pepsinvirkning er vigtig ikke så meget for dets direkte bidrag til proteinfordøjelse, det er beskedent, men for frigivelse af peptider og aminosyrer, som på duodenalt niveau stimulerer udskillelsen af cholecystokinin og derfor duodenal/pancreasfasen af proteinfordøjelse (se nedenfor).
det skal bemærkes, at virkningen af pepsin på kollagen, en familie af proteiner, der ombrydes og holder muskelcellerne sammen, letter adgangen til bugspytkirtelproteasen til måltidsproteiner.
Duodenum og proteinfordøjelse
når maveindholdet passerer ind i tolvfingertarmen, stimulerer dets surhed s-celler, lokaliseret i duodenalslimhinden og i den proksimale del af jejunum (den næste del af tyndtarmen), for at producere og frigive hormonsekretinet i blodbanen. Hormonet forårsager udskillelsen af en alkalisk pancreasjuice, der er rig på bicarbonationer, men fattig i ensymer, der passerer ind i tolvfingertarmen gennem bugspytkirtelkanalen. I tolvfingertarmen neutraliserer det saltsyre produceret af maven og hæver pH til omkring 7 (neutrale niveauer). Secretin stimulerer også galdesekretion og reducerer frigivelse af gastrin.
tilstedeværelsen af aminosyrer i tolvfingertarmen stimulerer, som nævnt ovenfor, endokrine celler i tolvfingertarmen og jejunum til at producere og frigive cholecystokinin (CKK) i blodbanen. Hormonet stimulerer blandt andet eksokrin bugspytkirtel til at udskille en juice, der er rig på:
- trypsinogen, chymotrypsinogen og proelastase, endopeptidaser med en anden substratspecificitet sammenlignet med pepsin, men også blandt dem;
- prokarboksypeptidase A og B, eksopeptidaser, der fjerner aminosyrer fra den C-terminale ende af peptiderne.derfor er der i tolvfingertarmen et neutralt miljø, der er rig på mineraler, der er i stand til at fortsætte, når det er aktiveret, proteinfordøjelse. Da proteaserne desuden har forskellig substratspecificitet, kan hvert peptid produceret af et ferment være substrat for et andet ferment.
i pancreasjuice er amylase, lipase og nuklease også til stede.
aktivering af pancreassymogener
det første og mestertrin i deres aktivering er omdannelsen af trypsinogen til trypsin ved enteropeptidase (også kaldet enterokinase), en endopeptidase produceret af celler i tolvfingertarmen efter cholecystokininstimulering. Enteropeptidase katalyserer spaltningen af en specifik peptidbinding mellem en lysinrest og en isoleucinrest af trypsinogen med frigivelse af et geksapeptid. Dette medfører en konformationel omlejring af proteinet, der aktiverer det, dvs.trypsin dannes.desuden kan det aktivere chymotrypsinogen, proelastase og prokarboksypeptidase A og B, men også andre molekyler af trypsinogen, som pepsin (autokatalyse).
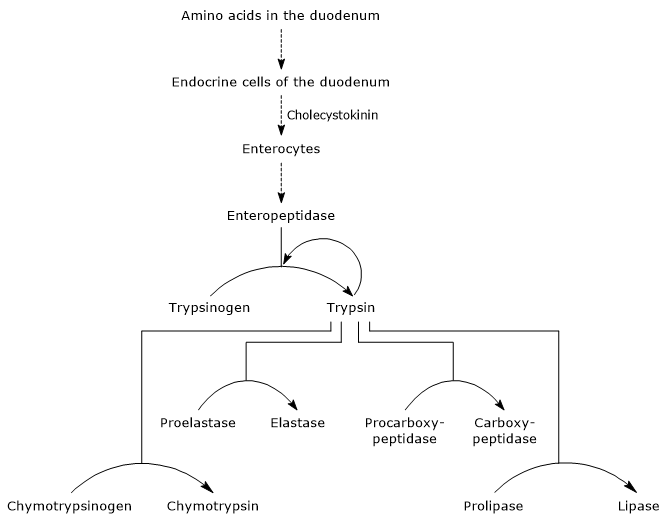
aktivering af Bugspytkirtelsymogener derfor øges duodenumets evne til at fordøje proteiner, når bugspytkirtlen aktiveres, alle udløst af en lille mængde enteropeptidase.
- aktiveringen af chymotrypsinogen til chymotrypsin sker gennem forskellige trin, som trypsin og det aktiverede chymotrypsin selv deltager i.
i det første trin katalyserer trypsin spaltningen af en specifik peptidbinding, og dette forårsager aktiveringen af chymotrypsinogen til krishmotrypsin, som er fuldt aktiv. Derefter katalyserer selve chymotrypsin frigivelsen af to dipeptider med dannelse af chymotrypsin, en mere stabil form af et dipeptid. chymotrypsin gennemgår to konformationsændringer, hvoraf den første fører til dannelsen af chymotrypsin, og den anden af chymotrypsin, den endelige aktive form af fsymet.
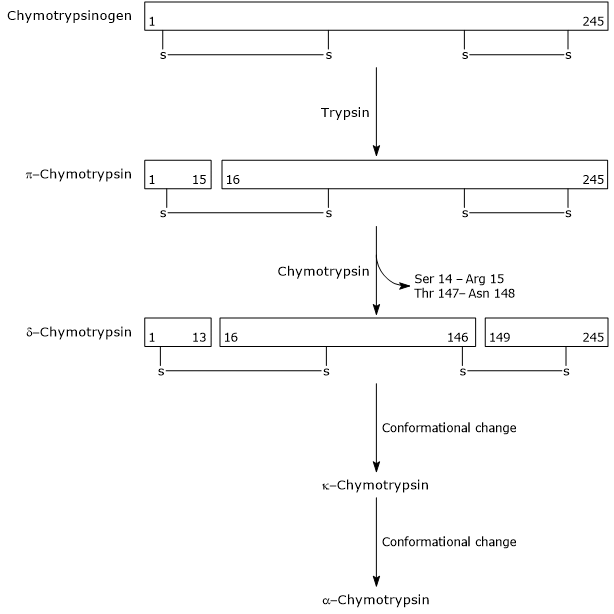
Activation of Chymotrypsinogen Chymotrypsin acts on peptide bonds adjacent to phenylalanine, tryptophan, methionine, tyrosine and leucine residues.
- Proelastase is activated to elastase by the removal of a small peptide from the N-terminal end.
Elastase, som er mindre specifik end de andre fordøjelseshydrolaser, katalyserer spaltningen af peptidbindinger ved siden af aminosyrer, såsom glycin, alanin og serin.prokarboksypeptidase a aktiveres til carboksypeptidase a; proteasen spalter peptidbindinger ved siden af aminosyrer med forgrenede eller aromatiske sidekæder, såsom phenylalanin og valin.
Procarboksypeptidase B aktiveres til carboksypeptidase B, der er specifik for aminosyrer med basiske sidekæder, såsom lysin og arginin.
de ovennævnte proteaser, i modsætning til pepsin, har en optimal pH-virkning i området fra7 til 8, Det vil sige neutral eller svagt alkalisk.
Pancreastrypsininhibitor
der er et “yderligere” beskyttelsessystem mod intrapancreatisk trypsinaktivitet: syntesen af en hæmmer kaldet “pancreastrypsininhibitor”. Molekylet, der er til stede i pancreassymogengranulerne, er i stand til at binde meget tæt det aktive sted for inaktivering af det. På denne måde blokeres aktiviteten af ethvert trypsin som følge af en for tidlig aktivering af trypsinogen, hvilket forhindrer en situation, hvor nogle få aktiverede molekyler aktiverer alle bugspytkirtelsymogener.
i planter er der mange molekyler med lignende aktivitet. Et eksempel er trypsininhibitoren, et protein, der hovedsageligt findes i sojabønner, der danner et meget stabilt kompleks med det aktive sted for trypsin.da de ovennævnte proteaser har en særskilt substratspecificitet, der virker på peptidbindinger ved siden af forskellige aminosyrer, kan hvert peptid genereret af en protease være substrat af en anden. På denne måde hydrolyseres de delvist fordøjede proteiner, der kommer ind i tolvfingertarmen, effektivt til frie aminosyrer og peptider med 2-8 rester. Disse peptider er substrater af aminopeptidaser udskilt fra enterocytter og forbundet med deres mikrovilli.
Dipeptidase er også til stede.
det skal bemærkes, at de samme proteaser endelig fordøjes og slutter processen.
betydningen og effektiviteten af proteolytiske stoffer i tarmens proteinfordøjelse kan forstås ud fra dette eksempel. Hvis du in vitro ønsker at hydrolysere et protein i dets bestanddele aminosyrer, er det nødvendigt at bruge en stærk og koncentreret syre som katalysator og opvarme prøven ved 105 liter C natten over. I tarmen opnås det samme resultat i løbet af få timer, der først opererer i det relativt sure miljø i maven og derefter i de milde alkaliske tilstande i tolvfingertarmen ved 37 liter C.de frigivne aminosyrer, sammen med di – og tri-peptider, absorberes af enterocytter. Di-og tri-peptiderne hydrolyseres normalt til bestanddele aminosyrer inden for enterocytterne, og dette forklarer, hvorfor praktisk talt kun frie aminosyrer er til stede i portalcirkulationen.Bender D. A. Benders’ ordbog over ernæring og fødevareteknologi. 8. udgave. Træhoved Udgivelse. 2006 Bender D. A. Introduktion til ernæring og metabolisme. 3. udgave. Taylor & Francis, 2004
Berg J. M., Tymocko J. L. og Stryer L. Biokemisk. 5. udgave. Freeman and Company, 2002
Bhagavan N. V., Ha C-E. Essentials of medical biochemistry: med kliniske tilfælde. 4. udgave. Akademisk presse, 2015
Dainese E. Biochimica degli alimenti e della Nutrition. Piccin Editore, 2006
Nelson D. L., direktør M. M. Lehninger. Principper for biokemi. 4. udgave. V. H. Freeman and Company, 2004
rå J. D. Biochimica. Neil Patterson Publishers, 1990
Rosenthal M. D., gley R. H. Medicinsk Biokemi: menneskelig metabolisme i sundhed og sygdom. John Viley & Sønner, INC., Publikation, 2009
Stipanuk M. H., Caudill M. A. Biokemiske, fysiologiske og molekylære aspekter af menneskelig ernæring. 3. udgave. Elsevier sundhedsvidenskab, 2013
- aktiveringen af chymotrypsinogen til chymotrypsin sker gennem forskellige trin, som trypsin og det aktiverede chymotrypsin selv deltager i.