Einführungschemie – 1. kanadische Ausgabe
Lernziele
- Puffer definieren.
- Identifizieren Sie die beiden Komponenten eines Puffers korrekt.
Wie in Abschnitt 12.4 „Starke und schwache Säuren und Basen und ihre Salze“ angegeben, sind schwache Säuren relativ häufig, selbst in den Lebensmitteln, die wir essen. Gelegentlich stoßen wir jedoch auf eine starke Säure oder Base wie Magensäure, die einen stark sauren pH-Wert von 1, 7 aufweist. Definitionsgemäß können starke Säuren und Basen eine relativ große Menge an H+ − oder OH-Ionen produzieren und haben folglich ausgeprägte chemische Aktivitäten. Darüber hinaus können sehr kleine Mengen starker Säuren und Basen den pH-Wert einer Lösung sehr schnell ändern. Wenn 1 ml Magensäure in den Blutkreislauf gegeben würde und kein Korrekturmechanismus vorhanden wäre, würde der pH—Wert des Blutes von etwa 7,4 auf etwa 4,7 sinken – ein pH-Wert, der dem weiteren Leben nicht förderlich ist. Glücklicherweise hat der Körper einen Mechanismus, um solche dramatischen pH-Veränderungen zu minimieren.
Der Mechanismus beinhaltet einen Puffer, eine Lösung, die dramatischen pH-Änderungen widersteht. Puffer bestehen dazu aus bestimmten Paaren gelöster Stoffe: entweder einer schwachen Säure plus einem Salz, das von dieser schwachen Säure abgeleitet ist, oder einer schwachen Base plus einem Salz dieser schwachen Base. Beispielsweise kann ein Puffer aus gelöstem HC BESTEHEN2H3O2 (eine schwache Säure) und NaC2H3O2 (das Salz, das von dieser schwachen Säure abgeleitet ist). Ein anderes Beispiel eines Puffers ist eine Lösung, die NH3 (eine schwache Base) und NH4Cl (ein Salz, das von dieser schwachen Base abgeleitet ist) enthält.
Verwenden wir einen HC2H3O2/NaC2H3O2-Puffer, um zu demonstrieren, wie Puffer funktionieren. Wenn der Pufferlösung eine starke Base — eine Quelle von OH− (aq) —Ionen − zugesetzt wird, reagieren diese OH-Ionen mit dem HC2H3O2 in einer Säure−Base−Reaktion:
HC2H3O2(aq) + OH− (aq) → H2O(ℓ) + C2H3O2-(aq)
Anstatt den pH-Wert dramatisch zu ändern, indem die Lösung basisch gemacht wird, reagieren die zugesetzten OH-Ionen zu H2O, so dass sich der pH-Wert nicht wesentlich ändert.
Wenn der Pufferlösung eine starke Säure — eine Quelle von H + —Ionen – zugesetzt wird, reagieren die H+ -Ionen mit dem Anion aus dem Salz. Da HC2H3O2 eine schwache Säure ist, wird es nicht viel ionisiert. Dies bedeutet, dass, wenn viele H + −Ionen und C2H3O2- Ionen in derselben Lösung vorhanden sind, sie zusammenkommen, um HC2H3O2 zu bilden:
H+(aq) + C2H3O2−(aq) → HC2H3O2(aq)
Anstatt den pH-Wert dramatisch zu ändern und die Lösung sauer zu machen, reagieren die zugesetzten H + -Ionen zu Molekülen einer schwachen Säure. Abbildung 12.2 „Die Aktionen von Puffern“ veranschaulicht beide Aktionen eines Puffers.
Abbildung 12.2 Die Wirkung von Puffern
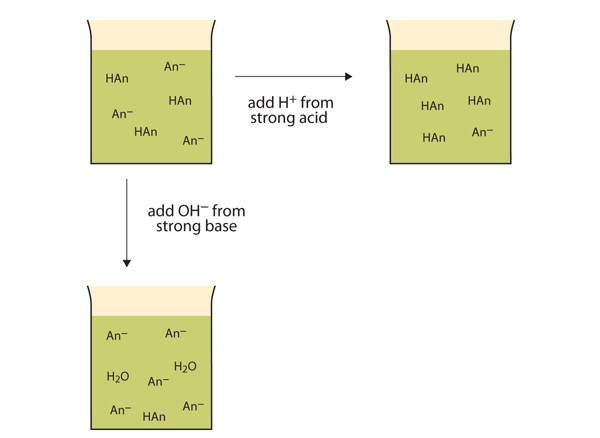
Puffer können sowohl mit starken Säuren (oben) als auch mit starken Basen (seitlich) reagieren, um große Änderungen des pH-Werts zu minimieren.
Puffer aus schwachen Basen und Salze schwacher Basen wirken ähnlich. Beispielsweise können in einem Puffer, der NH3 und NH4Cl enthält, NH3−Moleküle mit überschüssigen H+ −Ionen reagieren, die durch starke Säuren eingeführt werden:
NH3(aq) + H+(aq) → NH4+(aq)
während das NH4 +(aq) -Ion mit beliebigen OH-Ionen reagieren kann, die durch starke Basen eingeführt werden:
NH4+(aq) + OH-(aq) → NH3(aq) + H2O(ℓ)
Beispiel 15
Welche Kombinationen von Verbindungen können eine Pufferlösung ergeben?
- HCHO2 und NaCHO2
- HCl und NaCl
- CH3NH2 und CH3NH3Cl
- NH3 und NaOH
Lösung
- HCHO2 ist Ameisensäure, eine schwache Säure, während NaCHO2 das Salz ist, das aus dem Anion der schwachen Säure (dem Formiat-Ion) hergestellt wird. Die Kombination dieser beiden gelösten Stoffe würde eine Pufferlösung ergeben.
- HCl ist eine starke Säure, keine schwache Säure, daher würde die Kombination dieser beiden gelösten Stoffe keine Pufferlösung ergeben.
- CH3NH2 ist Methylamin, das wie NH3 mit einem seiner H-Atome mit einer CH3-Gruppe substituiert ist. Weil es nicht in Tabelle 12 aufgeführt ist.2 „Starke Säuren und Basen“ können wir davon ausgehen, dass es sich um eine schwache Base handelt. Die Verbindung CH3NH3Cl ist ein Salz, das aus dieser schwachen Base hergestellt wird, so dass die Kombination dieser beiden gelösten Stoffe eine Pufferlösung ergeben würde.
- NH3 ist eine schwache Base, aber NaOH ist eine starke Base. Die Kombination dieser beiden gelösten Stoffe würde keine Pufferlösung ergeben.
Testen Sie sich selbst
Welche Kombinationen von Verbindungen können eine Pufferlösung ergeben?
- NaHCO3 und NaCl
- H3PO4 und NaH2PO4
- NH3 und (NH4)3PO4
- NaOH und NaCl
Antworten
- nein
- ja
- ja
- nein
Puffer funktionieren nur für begrenzte Mengen zugesetzter starker Säure oder Base gut. Sobald einer der gelösten Stoffe vollständig umgesetzt ist, ist die Lösung kein Puffer mehr, und es können schnelle Änderungen des pH-Werts auftreten. Wir sagen, dass ein Puffer eine bestimmte Kapazität hat. Puffer, in denen zunächst mehr gelöster Stoff gelöst ist, haben erwartungsgemäß größere Kapazitäten.
Menschliches Blut hat ein Puffersystem, um extreme pH−Änderungen zu minimieren. Ein Puffer im Blut basiert auf der Anwesenheit von HCO3- und H2CO3 . Mit diesem Puffer wäre die Änderung des pH-Werts des Blutes minimal, selbst wenn etwas Magensäure direkt in den Blutkreislauf gelangen würde. In vielen Körperzellen befindet sich ein Puffersystem, das auf Phosphationen basiert.
Essen und Trinken App: Die Säure, die Schmerzen lindert
Obwohl Medikamente nicht gerade „Essen und Trinken“ sind, nehmen wir sie zu uns, also werfen wir einen Blick auf eine Säure, die wahrscheinlich die häufigste Medizin ist: Acetylsalicylsäure, auch bekannt als Aspirin. Aspirin ist bekannt als Schmerzmittel und Antipyretikum (Fiebersenker).
Die Struktur von Aspirin ist in der beigefügten Abbildung dargestellt. Der saure Teil ist eingekreist; Es ist das H-Atom in diesem Teil, das gespendet werden kann, da Aspirin als Brønsted-Lowry-Säure wirkt. Da es in Tabelle 12.2 „Starke Säuren und Basen“ nicht angegeben ist, ist Acetylsalicylsäure eine schwache Säure. Es ist jedoch immer noch eine Säure, und da einige Menschen täglich relativ große Mengen Aspirin konsumieren, kann seine saure Natur trotz der Abwehrkräfte des Magens gegen seine eigene Magensäure Probleme in der Magenschleimhaut verursachen.
Abbildung 12.3 Die molekulare Struktur von Aspirin
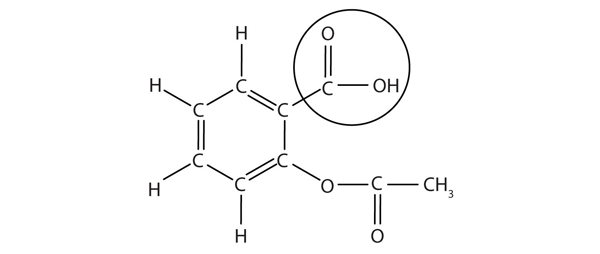
Die eingekreisten Atome sind der saure Teil des Moleküls.Da die Säureeigenschaften von Aspirin problematisch sein können, bieten viele Aspirin-Marken eine „gepufferte Aspirin“ -Form des Arzneimittels an. In diesen Fällen enthält das Aspirin auch ein Puffermittel – normalerweise MgO -, das den Säuregehalt des Aspirin reguliert, um seine sauren Nebenwirkungen zu minimieren.So nützlich und üblich Aspirin ist, wurde es ab 1899 offiziell als Medikament vermarktet. Die US Food and Drug Administration (FDA), die Regierungsbehörde, die mit der Überwachung und Genehmigung von Arzneimitteln in den Vereinigten Staaten beauftragt ist, wurde erst 1906 gegründet. Einige haben argumentiert, dass Aspirin, wenn die FDA vor der Einführung von Aspirin gegründet worden wäre, aufgrund seines Potenzials für Nebenwirkungen — gastrointestinale Blutungen, Klingeln in den Ohren, Reye-Syndrom (ein Leberproblem) und einige allergische Reaktionen – möglicherweise nie eine Zulassung erhalten hätte. In letzter Zeit wurde Aspirin jedoch für seine Wirkung bei der Verringerung von Herzinfarkten und Schlaganfällen angepriesen, so dass es wahrscheinlich ist, dass Aspirin hier bleiben wird.
Wichtige Erkenntnisse
- Ein Puffer ist eine Lösung, die plötzlichen Änderungen des pH-Werts widersteht.
Übungen
-
Puffer definieren. Welche zwei verwandten chemischen Komponenten sind erforderlich, um einen Puffer herzustellen?
-
Kann ein Puffer hergestellt werden, indem eine starke Säure mit einer starken Base kombiniert wird? Warum oder warum nicht?
-
Welche Kombinationen von Verbindungen können einen Puffer bilden? Nehmen wir wässrige Lösungen an.
a) HCl und NaCl
b) HNO2 und NaNO2
c) NH4NO3 und HNO3
d) NH4NO3 und NH3
4. Welche Kombinationen von Verbindungen können einen Puffer bilden? Nehmen wir wässrige Lösungen an.
a) H3PO4 und Na3PO4
b) NaHCO3 und Na2CO3
c) NaNO3 und Ca(NO3)2
d) HN3 und NH3
5. Schreiben Sie für jede Kombination in Übung 3, die ein Puffer ist, die chemischen Gleichungen für die Reaktionen der Pufferkomponenten, wenn eine starke Säure und eine starke Base hinzugefügt werden.
6. Schreiben Sie für jede Kombination in Übung 4, die ein Puffer ist, die chemischen Gleichungen für die Reaktionen der Pufferkomponenten, wenn eine starke Säure und eine starke Base hinzugefügt werden.
7. Das komplette Phosphatpuffersystem basiert auf vier Substanzen: H3PO4, H2PO4-, HPO42- und PO43-. Welche verschiedenen Pufferlösungen können aus diesen Substanzen hergestellt werden?
8. Erklären Sie, warum NaBr weder in einem sauren noch in einem basischen Puffer eine Komponente sein kann.
9. Es werden zwei Lösungen hergestellt, die die gleichen Konzentrationen an gelösten Stoffen enthalten. Eine Lösung besteht aus H3PO4 und Na3PO4, während die andere aus HCN und NaCN besteht. Welche Lösung sollte die größere Kapazität als Puffer haben?
10. Es werden zwei Lösungen hergestellt, die die gleichen Konzentrationen an gelösten Stoffen enthalten. Eine Lösung besteht aus NH3 und NH4NO3, während die andere aus H2SO4 und Na2SO4 besteht. Welche Lösung sollte die größere Kapazität als Puffer haben?
Antworten
Ein Puffer ist die Kombination aus einer schwachen Säure oder Base und einem Salz dieser schwachen Säure oder Base.
a) nein
b) ja
c) nein
d) ja
3b: starke Säure: NO2− + H+ → HNO2; starke Base: HNO2 + OH− → NO2− + H2O; 3d: starke Base: NH4+ + OH− → NH3 + H2O; starke Säure: NH3 + H+ → NH4+7.
Puffer können aus drei Kombinationen hergestellt werden: (1) H3PO4 und H2PO4−, (2) H2PO4− und HPO42− und (3) HPO42− und PO43−. (Technisch gesehen kann ein Puffer aus zwei beliebigen Komponenten hergestellt werden.)
Der Phosphatpuffer sollte die größere Kapazität haben.