Enthalpie und chemische Reaktionen
7.3 Enthalpie und chemische Reaktionen
Lernziele
- Enthalpie definieren.
- Drücken Sie die Enthalpieänderung chemischer Reaktionen richtig aus.
- Erklären Sie, wie Enthalpieänderungen experimentell gemessen werden.
Nachdem wir nun gezeigt haben, wie Energie, Arbeit und Wärme zusammenhängen, sind wir bereit, Energieänderungen in chemischen Reaktionen zu berücksichtigen. Ein grundlegendes Konzept ist, dass jede chemische Reaktion mit einer gleichzeitigen Energieänderung stattfindet. Jetzt müssen wir lernen, diese Energieveränderungen richtig auszudrücken.
Unsere Untersuchung von Gasen in Kapitel 6 „Gase“ und unsere Definition von Arbeit in Abschnitt 7.2 „Arbeit und Wärme“ zeigen, dass Bedingungen wie Druck, Volumen und Temperatur den Energieinhalt eines Systems beeinflussen. Was wir brauchen, ist eine Definition von Energie, die gilt, wenn einige dieser Bedingungen spezifiziert sind (ähnlich unserer Definition von Standardtemperatur und -druck in unserer Untersuchung von Gasen). Wir definieren die Enthalpieänderungdie Wärme eines Prozesses bei konstantem Druck; bezeichnet ΔH. (ΔH) als Wärme eines Prozesses, wenn der Druck konstant gehalten wird:
ΔH≡qat konstanter Druck
Der Buchstabe H steht für „Enthalpie“, eine Art Energie, während das Δ eine Änderung der Menge impliziert. Wir werden immer an der Änderung von H interessiert sein und nicht an dem absoluten Wert von H selbst.
Wenn eine chemische Reaktion auftritt, ändert sich die Enthalpie charakteristisch. Die Enthalpieänderung für eine Reaktion wird typischerweise nach einer ausgewogenen chemischen Gleichung und in derselben Zeile geschrieben. Wenn beispielsweise zwei Mol Wasserstoff mit einem Mol Sauerstoff zu zwei Mol Wasser reagieren, beträgt die charakteristische Enthalpieänderung 570 kJ. Wir schreiben die Gleichung als
2H2(g) + O2(g) → 2H2O(ℓ) ΔH = -570 kJ
Eine chemische Gleichung, die eine Enthalpieänderung enthält, wird als thermochemische Gleichung bezeichneteine chemische Gleichung, die eine Enthalpieänderung enthält.. Es wird angenommen, dass sich eine thermochemische Gleichung auf die Gleichung in molaren Mengen bezieht, was bedeutet, dass sie in Molen interpretiert werden muss, nicht in einzelnen Molekülen.
Beispiel 5
Schreiben Sie die thermochemische Gleichung für die Reaktion von PCl3(g) mit Cl2(g) zu PCl5(g), das eine Enthalpieänderung von -88 kJ aufweist.
Lösung
Die thermochemische Gleichung lautet
PCl3(g) + Cl2(g) → PCl5(g) ΔH = -88 kJ
Testen Sie sich selbst
Schreiben Sie die thermochemische Gleichung für die Reaktion von N2(g) mit O2(g) zu 2NO(g), das eine Enthalpieänderung von 181 kJ aufweist.
Antwort
N2(g) + O2(g) → 2NO(g) ΔH = 181 kJ
Sie haben vielleicht bemerkt, dass das ΔH für eine chemische Reaktion positiv oder negativ sein kann. Die Zahl wird als positiv angenommen, wenn sie kein Vorzeichen hat; Ein + -Zeichen kann explizit hinzugefügt werden, um Verwechslungen zu vermeiden. Eine chemische Reaktion, die ein positives ΔH hat, wird als endotherm bezeichneteine chemische Reaktion, die eine positive Änderung der Enthalpie aufweist., während eine chemische Reaktion, die ein negatives ΔH hat, als exotherm bezeichnet wirdeine chemische Reaktion, die eine negative Änderung der Enthalpie aufweist..
Was bedeutet es, wenn das ΔH eines Prozesses positiv ist? Es bedeutet, dass das System, in dem die chemische Reaktion stattfindet, Energie gewinnt. Betrachtet man die Energie eines Systems als Höhe auf einem vertikalen Energiediagramm, kann die Enthalpieänderung, die mit der Reaktion einhergeht, wie in Teil (a) in Abbildung 7.3 „Reaktionsenergie“ dargestellt werden: Die Energie der Reaktanten hat etwas Energie, und das System erhöht seine Energie, wenn es zu Produkten geht. Die Produkte sind auf der vertikalen Skala höher als die Reaktanten. Endotherm bedeutet also, dass das System Energie gewinnt oder absorbiert.Eine entgegengesetzte Situation besteht für einen exothermen Prozess, wie in Teil (b) in Abbildung 7.3 „Reaktionsenergie“ gezeigt. Wenn die Enthalpieänderung einer Reaktion negativ ist, verliert das System Energie, so dass die Produkte weniger Energie als die Reaktanten haben und die Produkte auf der vertikalen Energieskala niedriger sind als die Reaktanten. Exotherm bedeutet also, dass das System Energie verliert oder abgibt.
Abbildung 7.3 Reaktionsenergie
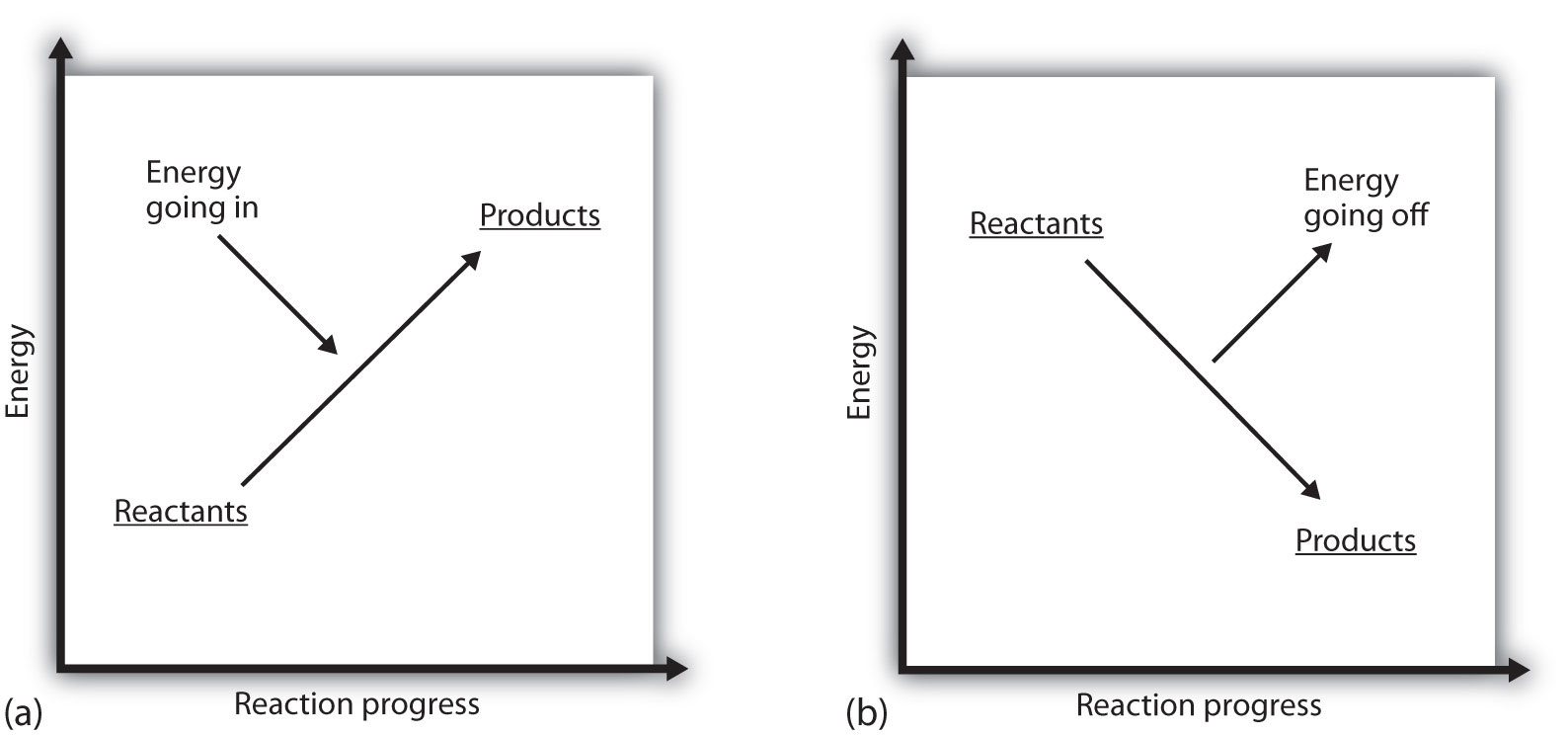
(a) Bei einer endothermen Reaktion nimmt die Energie des Systems zu (d. H. bewegt sich auf der vertikalen Energieskala höher). (b) Bei einer exothermen Reaktion nimmt die Energie des Systems ab (d. H. Bewegt sich auf der vertikalen Energieskala nach unten).
Beispiel 6
Betrachten Sie diese thermochemische Gleichung.
2CO(g) + O2(g) → 2CO2(g) ΔH = -565 kJ
Ist es exotherm oder endotherm? Wie viel Energie wird abgegeben oder absorbiert?
Lösung
Per Definition ist eine chemische Reaktion, die ein negatives ΔH aufweist, exotherm, was bedeutet, dass so viel Energie — in diesem Fall 565 kJ — durch die Reaktion abgegeben wird.
Testen Sie sich selbst
Betrachten Sie diese thermochemische Gleichung.
CO2(g) + H2(g) → CO(g) + H2O(g) ΔH = 42 kJ
Ist es exotherm oder endotherm? Wie viel Energie wird abgegeben oder absorbiert?
Antwort
Endotherm; 42 kJ werden absorbiert.
Wie werden ΔH-Werte experimentell gemessen? Tatsächlich wird ΔH nicht gemessen; q wird gemessen. Die Messungen werden jedoch unter Bedingungen konstanten Drucks durchgeführt, so dass ΔH gleich dem gemessenen q ist.
Experimentell wird q gemessen, indem die Gleichung
q = mcΔT
Wir messen die Masse der Chemikalien in einem System vor. Dann lassen wir die chemische Reaktion ablaufen und messen die Temperaturänderung (ΔT) des Systems. Wenn wir die spezifische Wärme der Materialien im System kennen (normalerweise tun wir das), können wir q berechnen. Dieser Wert von q ist numerisch gleich dem ΔH des Prozesses, den wir auf eine molare Skala skalieren können. Der Behälter, in dem sich das System befindet, ist typischerweise isoliert, so dass jede Energieänderung in eine Änderung der Temperatur des Systems übergeht, anstatt aus dem System ausgetreten zu sein. Der Behälter wird als Kalorimeter bezeichnetein Behälter zur Messung der Wärme einer chemischen Reaktion., und der Prozess der Messung von Änderungen in der Enthalpie wird Kalorimetrie genanntder Prozess der Messung von Enthalpieänderungen für chemische Reaktionen..
Abbildung 7.4 Kalorimeter
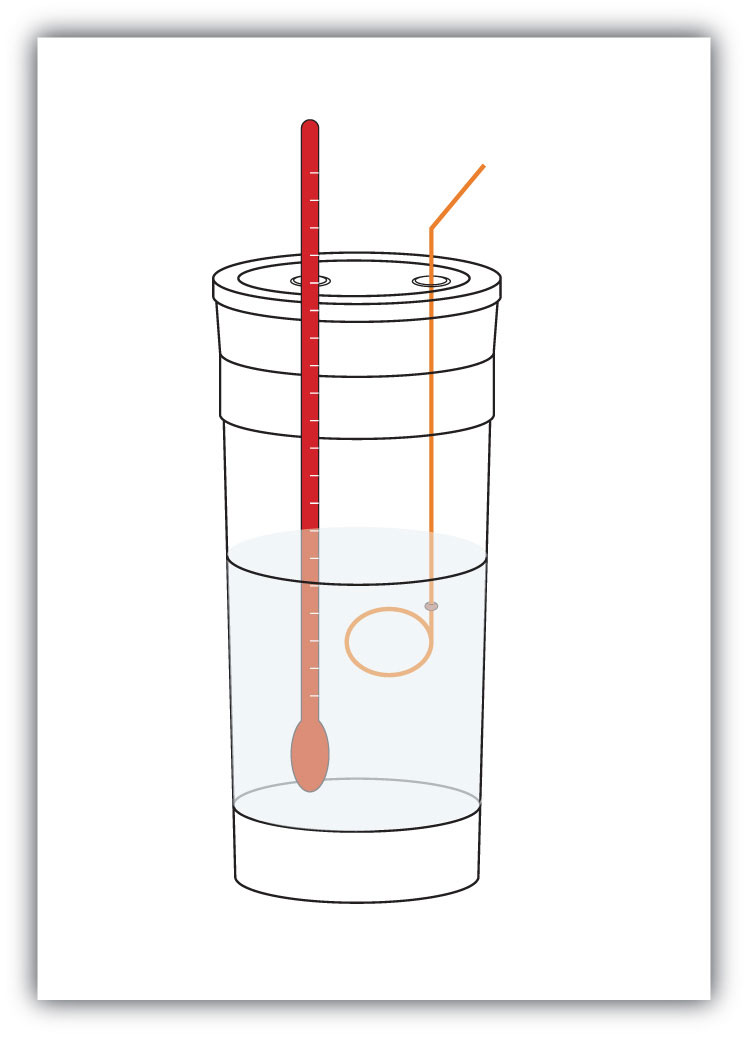
Ein einfaches Kalorimeter kann aus einigen verschachtelten Schaumkaffeetassen, einem Deckel, einem Thermometer und einem Rührer aufgebaut werden.Angenommen, 4,0 g NaOH oder 0,10 mol NaOH werden gelöst, um 100,0 ml wässrige Lösung herzustellen, während 3,65 g HCl oder 0,10 mol HCl gelöst werden, um weitere 100,0 ml wässrige Lösung herzustellen. Die beiden Lösungen werden in einem isolierten Kalorimeter gemischt, ein Thermometer eingesetzt und das Kalorimeter abgedeckt (siehe Abbildung 7.4 „Kalorimeter“ für einen Beispielaufbau). Das Thermometer misst die Temperaturänderung, wenn die folgende chemische Reaktion auftritt:
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ)
Ein Beobachter stellt fest, dass die Temperatur von 22,4 ° C auf 29,1 ° C ansteigt. Die Gesamtmenge an Lösung beträgt 200,0 ml, und bei einer Dichte von 1,00 g / ml haben wir somit 200,0 g Lösung. Unter Verwendung der Gleichung für q ersetzen wir unsere experimentellen Messungen und die spezifische Wärme von Wasser (Tabelle 7.1 „Spezifische Wärme verschiedener Substanzen“):
q=(200,0 g) (4,184 J g⋅° C)(6,7 ° C)
Lösen für q erhalten wir
q=5.600 J≡ΔH für die Reaktion
Die Wärme q ist gleich der ΔH für die Reaktion, da die chemische Reaktion bei konstantem Druck abläuft. Die Reaktion gibt jedoch diese Energiemenge ab, so dass das tatsächliche Vorzeichen auf ΔH negativ ist:
ΔH = -5.600 J für die Reaktion
Somit haben wir die folgende thermochemische Gleichung für die chemische Reaktion, die im Kalorimeter stattgefunden hat:
110 NaOH(aq)+110 HCl(aq)→110 NaCl(aq)+110 H2O(ℓ)ΔH= -5.600 J
Die 1/10-Koeffizienten sind vorhanden, um uns daran zu erinnern, dass wir mit einem Zehntel Mol jedes Reaktanden begonnen haben , also machen wir ein Zehntel eines Mols jedes Produktes. Typischerweise berichten wir jedoch über thermochemische Gleichungen in Molen, nicht in einem Zehntel eines Mols. Um auf molare Größen zu skalieren, müssen wir die Koeffizienten mit 10 multiplizieren. Wenn wir dies jedoch tun, erhalten wir 10-mal so viel Energie. Somit haben wir
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56.000 J
Das ΔH kann in kJ-Einheiten umgewandelt werden, so dass unsere endgültige thermochemische Gleichung lautet
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
Wir haben gerade unsere experimentellen Daten aus der Kalorimetrie entnommen und die enthalpieänderung einer chemischen Reaktion. Ähnliche Messungen an anderen chemischen Reaktionen können die ΔH-Werte jeder chemischen Reaktion bestimmen, die Sie untersuchen möchten.
Beispiel 7
Eine 100 ml Lösung von 0.25 mol Ca2+(aq) wurden mit 0,50 mol F−(aq) −Ionen gemischt und CaF2 ausgefällt:
Ca2+(aq) + 2F-(aq) → CaF2(s)
Die Temperatur der Lösung stieg um 10,5 ° C. Wie war die Enthalpieänderung für die chemische Reaktion? Wie war die Enthalpieänderung für die Herstellung von 1 mol CaF2? Angenommen, die Lösung hat die gleiche Dichte und spezifische Wärme wie Wasser.
Lösung
Da wir ΔT direkt erhalten, können wir die Reaktionswärme bestimmen, die gleich ΔH ist:
q=(100 g)(4,184 J g⋅° C)(10.5 ° C)
Lösen für q erhalten wir
q = 4.400 J
Daher ΔH = -4.400 J.
Entsprechend der Stöchiometrie der Reaktion werden genau 0,25 mol CaF2 gebildet, so dass diese Wärmemenge für 0,25 mol ist. Für 1 mol CaF2 müssen wir die Wärme um den Faktor vier skalieren:
q = 4.400 J × 4 = 17.600 J für 1 mol CaF2
Auf molarer Basis beträgt die Enthalpieänderung
ΔH = -17.600 J = -17,6 kJ
Testen Sie sich selbst
In einem Kalorimeter bei konstantem Druck 0,10 mol CH4 (g) und 0,20 mol O2 g) umgesetzt werden.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ)
Die Reaktion erwärmt 750.0 g H2O bei 28,4°C. Was ist ΔH für die Reaktion im molaren Maßstab?
Antwort
-891 kJ
Wichtige Erkenntnisse
- Jede chemische Reaktion erfolgt mit einer gleichzeitigen Energieänderung.
- Die Änderung der Enthalpie entspricht der Wärme bei konstantem Druck.
- Enthalpieänderungen können mit thermochemischen Gleichungen ausgedrückt werden.
- Enthalpieänderungen werden mittels Kalorimetrie gemessen.
-
Unter welchen Umständen sind q und ΔH gleich?
-
Unter welchen Umständen unterscheiden sich q und ΔH?
-
Wasserstoffgas und Chlorgas reagieren zu Chlorwasserstoffgas mit einer begleitenden Enthalpieänderung von -184 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
-
Propan (C3H8) reagiert mit elementarem Sauerstoffgas zu Kohlendioxid und flüssigem Wasser mit einer begleitenden Enthalpieänderung von -2.220 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
-
Stickstoffgas reagiert mit Sauerstoffgas zu NO(g) und absorbiert dabei 180 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
-
Festes Natrium reagiert mit Chlorgas zu festem Natriumchlorid unter Abgabe von 772 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
-
Wasserstoffgas und Chlorgas reagieren zu Chlorwasserstoffgas mit einer begleitenden Enthalpieänderung von -184 kJ. Ist dieser Prozess endotherm oder exotherm?
-
Propan (C3H8) reagiert mit elementarem Sauerstoffgas zu Kohlendioxid und gibt dabei 2.220 kJ Energie ab. Ist dieser Prozess endotherm oder exotherm?
-
Stickstoffgas reagiert mit Sauerstoffgas zu NO(g) und absorbiert dabei 180 kJ. Ist dieser Prozess exotherm oder endotherm?
-
Natriummetall kann mit Stickstoff zu Natriumazid (NaN3) mit einem ΔH von 21,72 kJ reagieren. Ist dieser Prozess exotherm oder endotherm?
-
Zeichnen Sie ein Energieniveaudiagramm für die chemische Reaktion in Übung 8. (Siehe Abbildung 7.3 „Reaktionsenergie“ für ein Beispiel.)
-
Zeichnen Sie ein Energieniveaudiagramm für die chemische Reaktion in Übung 9. (Siehe Abbildung 7.3 „Reaktionsenergie“ für ein Beispiel.)
-
In einer 250 ml Lösung werden 0,25 mol KOH(aq) und 0,25 mol HNO3(aq) vereinigt. Die Temperatur der Lösung steigt von 22,5 ° C auf 35,9 ° C. Angenommen, die Lösung hat die gleiche Dichte und Wärmekapazität wie Wasser. Was ist die Reaktionswärme und was ist das ΔH der Reaktion auf molarer Basis?
-
In einer 600 ml Lösung, 0.50 mol Ca(OH)2(aq) und 0,50 mol H2SO 4(aq) werden vereinigt. Die Temperatur der Lösung steigt um 22,3 ° C. Wie hoch ist die Reaktionswärme und wie hoch ist das ΔH der Reaktion auf molarer Basis? Angenommen, die Lösung hat die gleiche Dichte und Wärmekapazität wie Wasser.
-
Zum Erwärmen von 400,0 g H2O werden 0,050 mol Ethanol (C2H5OH) verbrannt. Das Wasser erwärmt sich von 24,6 ° C auf 65,6 ° C. Wie hoch ist die Reaktionswärme und wie hoch ist das ΔH der Reaktion auf molarer Basis?
-
Zum Erwärmen von 100,0 g H2O werden 0,066 mol Bienenwachs verbrannt. Das Wasser erwärmt sich von 21,4 ° C auf 25,5 ° C. Wie hoch ist die Reaktionswärme und wie hoch ist das ΔH der Reaktion auf molarer Basis?
Unter welchen Umständen sind q und ΔH gleich?
Unter welchen Umständen unterscheiden sich q und ΔH?
Wasserstoffgas und Chlorgas reagieren zu Chlorwasserstoffgas mit einer begleitenden Enthalpieänderung von -184 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
Propan (C3H8) reagiert mit elementarem Sauerstoffgas zu Kohlendioxid und flüssigem Wasser mit einer begleitenden Enthalpieänderung von -2.220 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
Stickstoffgas reagiert mit Sauerstoffgas zu NO(g) und absorbiert dabei 180 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
Festes Natrium reagiert mit Chlorgas zu festem Natriumchlorid unter Abgabe von 772 kJ. Schreiben Sie eine richtig ausgewogene thermochemische Gleichung für diesen Prozess.
Wasserstoffgas und Chlorgas reagieren zu Chlorwasserstoffgas mit einer begleitenden Enthalpieänderung von -184 kJ. Ist dieser Prozess endotherm oder exotherm?
Propan (C3H8) reagiert mit elementarem Sauerstoffgas zu Kohlendioxid und gibt dabei 2.220 kJ Energie ab. Ist dieser Prozess endotherm oder exotherm?
Stickstoffgas reagiert mit Sauerstoffgas zu NO(g) und absorbiert dabei 180 kJ. Ist dieser Prozess exotherm oder endotherm?
Natriummetall kann mit Stickstoff zu Natriumazid (NaN3) mit einem ΔH von 21,72 kJ reagieren. Ist dieser Prozess exotherm oder endotherm?
Zeichnen Sie ein Energieniveaudiagramm für die chemische Reaktion in Übung 8. (Siehe Abbildung 7.3 „Reaktionsenergie“ für ein Beispiel.)
Zeichnen Sie ein Energieniveaudiagramm für die chemische Reaktion in Übung 9. (Siehe Abbildung 7.3 „Reaktionsenergie“ für ein Beispiel.)
In einer 250 ml Lösung werden 0,25 mol KOH(aq) und 0,25 mol HNO3(aq) vereinigt. Die Temperatur der Lösung steigt von 22,5 ° C auf 35,9 ° C. Angenommen, die Lösung hat die gleiche Dichte und Wärmekapazität wie Wasser. Was ist die Reaktionswärme und was ist das ΔH der Reaktion auf molarer Basis?
In einer 600 ml Lösung, 0.50 mol Ca(OH)2(aq) und 0,50 mol H2SO 4(aq) werden vereinigt. Die Temperatur der Lösung steigt um 22,3 ° C. Wie hoch ist die Reaktionswärme und wie hoch ist das ΔH der Reaktion auf molarer Basis? Angenommen, die Lösung hat die gleiche Dichte und Wärmekapazität wie Wasser.
Zum Erwärmen von 400,0 g H2O werden 0,050 mol Ethanol (C2H5OH) verbrannt. Das Wasser erwärmt sich von 24,6 ° C auf 65,6 ° C. Wie hoch ist die Reaktionswärme und wie hoch ist das ΔH der Reaktion auf molarer Basis?
Zum Erwärmen von 100,0 g H2O werden 0,066 mol Bienenwachs verbrannt. Das Wasser erwärmt sich von 21,4 ° C auf 25,5 ° C. Wie hoch ist die Reaktionswärme und wie hoch ist das ΔH der Reaktion auf molarer Basis?
Antworten
-
bei konstantem Druck
-
H2(g) + Cl2(g) → 2HCl(g) ΔH = -184 kJ
-
N2(g) + O2(g) → 2NO(g) ΔH = 180 kJ
-
exotherm
-
endotherm
-
Reaktionswärme = -14,0 kJ; ΔH = -56,0 kJ/mol Reaktanden
Reaktionswärme = -68,6 kJ; ΔH = -1.370 kJ/mol Ethanol