2.1: Atomiteorian kehitys
atomiteoria yhdeksännentoista vuosisadan jälkeen
jos aine koostui atomeista, mistä atomit koostuivat? Olivatko ne pienimpiä hiukkasia vai oliko jotain pienempää? 1800-luvun lopulla joukko tällaisista kysymyksistä kiinnostuneita tiedemiehiä tutki matalapaineisissa kaasuissa syntyviä sähköpurkauksia, joista merkittävimmän löydön teki englantilainen fyysikko J. J. Thomson katodisädeputkea käyttäen. Tämä laite koostui suljetusta lasiputkesta, josta lähes kaikki ilma oli poistettu; putkessa oli kaksi metallielektrodia. Kun elektrodeihin kohdistettiin korkeajännitettä, niiden väliin ilmestyi katodisädeksi kutsuttu näkyvä säde. Tämä säde taipui kohti positiivista varausta ja pois negatiivisesta varauksesta, ja se tuotettiin samalla tavalla identtisillä ominaisuuksilla, kun elektrodeissa käytettiin eri metalleja. Vastaavissa kokeissa sädettä poikkeutti samanaikaisesti sovellettu magneettikenttä, ja taipuman laajuuden ja magneettikentän voimakkuuden mittausten avulla Thomson pystyi laskemaan katodisädehiukkasten varauksen ja massan suhteen. Mittaustulokset osoittivat, että nämä hiukkaset olivat paljon kevyempiä kuin atomit (Kuva \(\PageIndex{1}\)).
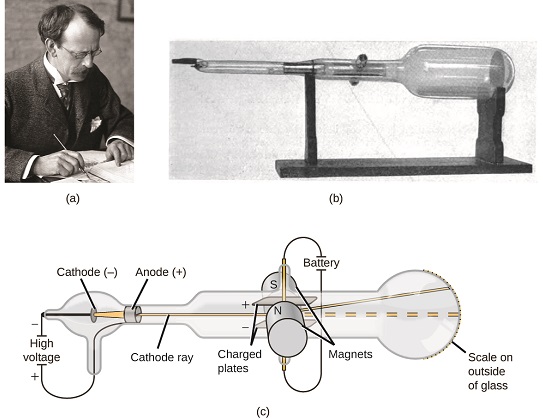
Kuva \(\PageIndex{5}\): a) J. J. Thomson tuotti näkyvän säteen katodisädeputkessa. b) Tämä on varhainen katodisädeputki, jonka Ferdinand Braun keksi vuonna 1897. c) katodisädeessä säde (keltaisena) tulee katodilta ja kiihtyy anodin ohi kohti putken päässä olevaa fluoresoivaa asteikkoa. Samanaikaisesti sovellettujen sähkö-ja magneettikenttien aiheuttamat taipumat antoivat thomsonille mahdollisuuden laskea katodisädin muodostavien hiukkasten massa-varaus-suhde. (luotto a: Nobel-säätiön työn modifiointi; luotto b: Eugen Nesperin työn modifiointi; luotto c: työn modifiointi ”Kurzon”/Wikimedia Commons).
hänen havaintojensa perusteella Thomson esitti seuraavaa ja miksi: hiukkaset vetävät puoleensa positiivisia (+) varauksia ja hylkivät negatiivisia (−) varauksia, joten niiden on oltava negatiivisesti varautuneita (kuten varaukset hylkivät ja toisin kuin varaukset vetävät puoleensa); ne ovat vähemmän massiivisia kuin atomit ja niitä ei voi erottaa toisistaan lähtöaineesta riippumatta, joten niiden on oltava kaikkien atomien perustavia, subatomisia aineosia. Vaikka Thomsonin ajatus oli tuolloin kiistanalainen, se hyväksyttiin vähitellen, ja hänen katodisädehiukkasensa on se, mitä me nyt kutsumme elektroniksi, negatiivisesti varautuneeksi, atomia pienemmäksi hiukkaseksi, jonka massa on yli tuhat kertaa pienempi kuin atomin. Termin ” electron ”keksi vuonna 1891 irlantilainen fyysikko George Stoney kirjasta” electric ion.”
vuonna 1909 yhdysvaltalaisen fyysikon Robert A. Millikan ”öljypisara” – kokeillaan löysi elektronista lisätietoja. Millikan loi mikroskooppisia öljypisaroita, joita voitiin sähköisesti ladata kitkan avulla niiden muodostuessa tai röntgensäteiden avulla. Nämä pisarat putosivat aluksi painovoiman vaikutuksesta, mutta niiden etenemistä alaspäin pystyi hidastamaan tai jopa kumoamaan laitteen alempana oleva sähkökenttä. Säätämällä Sähkökentän voimakkuutta ja tekemällä tarkkoja mittauksia ja asianmukaisia laskelmia Millikan pystyi määrittämään varauksen yksittäisissä pudotuksissa (Kuva \(\PageIndex{2}\)).
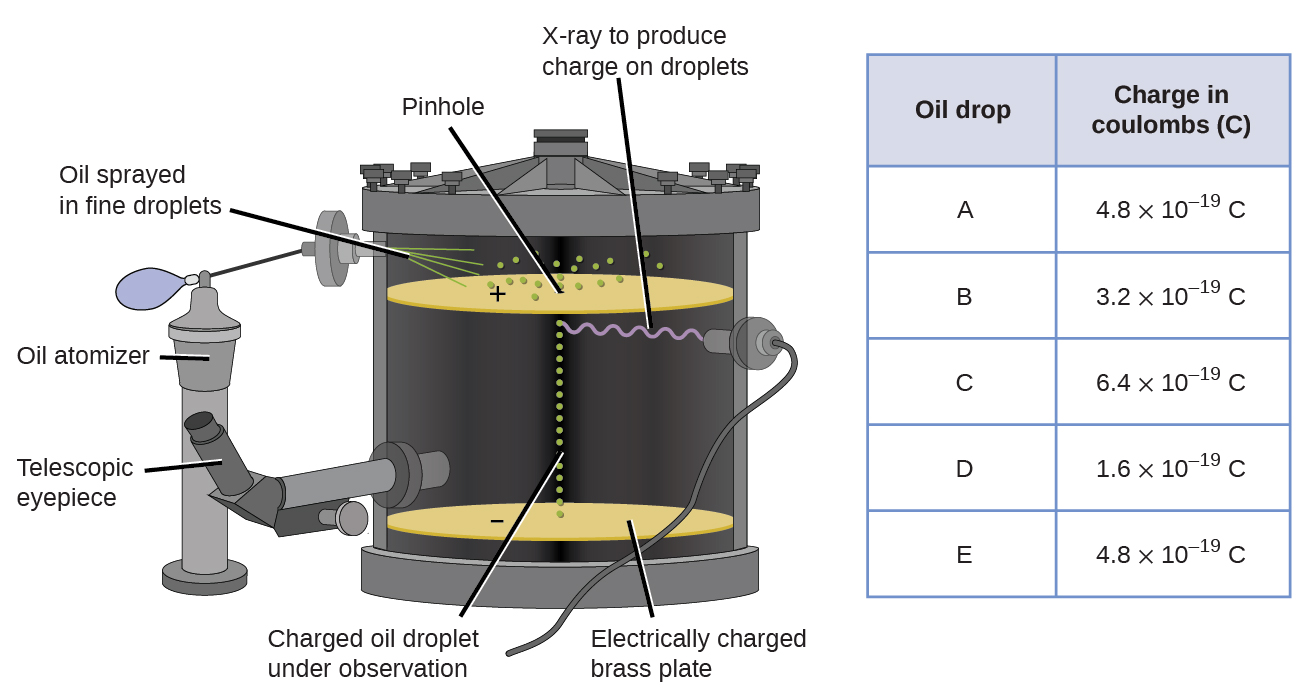
Kuva \(\PageIndex{6}\): Millikanin kokeessa mitattiin yksittäisten öljypisaroiden varaus. Taulukoidut tiedot ovat esimerkkejä muutamista mahdollisista arvoista.
Millikanin keräämää varaustietoa tarkastellessa on saattanut huomata, että öljypisaran varaus on aina tietyn varauksen kerrannainen, 1,6 \(\times\) 10-19 C. Millikan päätteli, että tämän arvon täytyy siis olla perusvaraus—yhden elektronin varaus—hänen mitatuilla varauksillaan, jotka johtuvat yhden elektronin ylimäärästä (1 kertaa 1.6 \(\times\) 10-19 C), kaksi elektronia (2 kertaa 1,6 \(\times\) 10-19 C), kolme elektronia (3 kertaa 1,6 \(\times\) 10-19 C) ja niin edelleen, tietyllä öljypisaralla. Koska elektronin varaus tunnettiin nyt Millikanin tutkimuksen ansiosta ja varauksen suhde massaan oli jo tunnettu Thomsonin tutkimuksen ansiosta (1,759 \(\times\) 1011 C/kg), tarvittiin vain yksinkertainen laskutoimitus elektronin massan määrittämiseksi.
\
tutkijat olivat nyt todenneet, että atomi ei ollut jakamaton, kuten Dalton oli uskonut, ja Thomsonin, Millikanin ja muiden työn ansiosta negatiivisten, subatomisten hiukkasten—elektronien—varaus ja massa tunnettiin. Atomin positiivisesti varautunutta osaa ei kuitenkaan vielä ymmärretty hyvin. Vuonna 1904 Thomson ehdotti atomeille ”luumuvanukas” – mallia, jossa kuvattiin positiivisesti varautunut massa, jossa on yhtä paljon negatiivista varausta siihen upotettuina elektroneina, koska kaikki atomit ovat sähköisesti neutraaleja. Kilpailevaa mallia oli ehdottanut vuonna 1903 Hantaro Nagaoka, joka esitti Saturnuksen kaltaisen atomin, joka koostui positiivisesti varautuneesta pallosta, jota ympäröi elektronien halo (Kuva \(\PageIndex{3}\)).
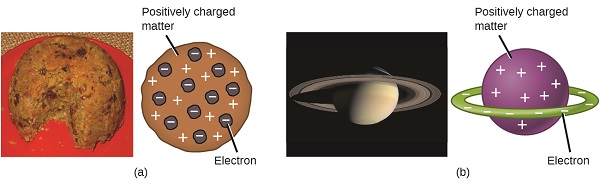
Kuva \(\PageIndex{7}\): A) Thomson esitti, että atomit muistuttivat luumuvanukasta, englantilaista jälkiruokaa, joka koostui kosteasta kakusta, johon oli upotettu rusinoita (”luumuja”). B) Nagaoka esitti, että atomit muistuttivat Saturnus-planeettaa, jonka elektronirengas ympäröi positiivista ”planeettaa.”(credit a: modification of work by ”Man vyi”/Wikimedia Commons; credit b: modification of work by ”NASA”/Wikimedia Commons).
seuraava merkittävä käänne atomin ymmärtämisessä tuli uusiseelantilaiselta fyysikolta Ernest Rutherfordilta, joka vietti tieteellisen uransa pääosin Kanadassa ja Englannissa. Hän suoritti sarjan kokeita käyttäen säde nopea, positiivisesti varautunut alfa hiukkasia (α hiukkasia), jotka on tuotettu radioaktiivinen hajoaminen radium; α hiukkaset koostuvat kaksi protonia ja kaksi neutronia (opit lisää radioaktiivista hajoamista luvussa ydinkemian). Rutherford ja hänen kollegansa Hans Geiger (myöhemmin kuuluisa Geiger laskuri) ja Ernest Marsden suunnattu säde α hiukkasia, lähde, joka oli upotettu lyijy lohko absorboivat suurimman osan säteilystä, on hyvin ohut pala kultaa folio ja tutkitaan tuloksena sironta α hiukkasia käyttäen luminescent näyttö, joka hehkui lyhyesti, jos osui α hiukkanen.
mitä he löysivät? Useimmat hiukkaset kulkivat suoraan folion läpi taipumatta lainkaan. Joitakin kuitenkin ohjattiin hieman, ja hyvin pieni määrä ohjautui lähes suoraan takaisin lähdettä kohti (Kuva \(\PageIndex{4}\)). Rutherford kuvaili näiden tulosten löytämistä: ”se oli aivan uskomattomin tapahtuma, mitä minulle on koskaan elämässäni tapahtunut. Se oli melkein yhtä uskomatonta kuin jos ampuisi 15-tuumaisella kuorella pehmopaperia ja se tulisi takaisin ja osuisi”1 (s. 68).
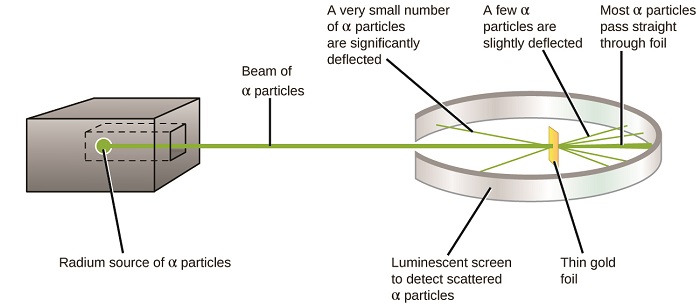
Kuva \(\PageIndex{8}\): Geiger ja Rutherford ampuivat α-hiukkasia kultafoliota kohti ja havaitsivat, mihin nämä hiukkaset menivät, kuten heidän kokeensa kaavio osoittaa. Suurin osa hiukkasista kulki suoraan folion läpi,mutta muutama taipui hieman ja hyvin pieni määrä taipui merkittävästi.
Rutherford päätteli näin: koska suurin osa nopealiikkeisistä α-hiukkasista kulki kultaatomien läpi havaitsematta, niiden on täytynyt kulkea käytännössä tyhjän tilan läpi atomin sisällä. Alfahiukkaset ovat positiivisesti varautuneita, joten taipumat syntyivät, kun ne kohtasivat toisen positiivisen varauksen (kuten varaukset hylkivät toisiaan). Koska samankaltaiset varaukset hylkivät toisiaan, niiden harvojen positiivisesti varautuneiden α-hiukkasten, jotka muuttivat kulkureittejä äkillisesti, on täytynyt osua toiseen kappaleeseen tai lähennellä sitä, jossa oli myös erittäin keskittynyt positiivinen varaus. Koska taipumat tapahtuivat vain murto-osa ajasta, tämä varaus vain miehitetty pieni määrä tilaa kultafoliossa. Analysoidessaan tällaisten kokeiden sarjaa yksityiskohtaisesti Rutherford teki kaksi johtopäätöstä:
- atomin käyttämän tilavuuden tulee koostua suuresta määrästä tyhjää tilaa.
- pienen, suhteellisen raskaan, positiivisesti varautuneen kappaleen, ytimen, täytyy olla jokaisen atomin keskellä.
tämä analyysi sai Rutherfordin ehdottamaan mallia, jossa atomi koostuu hyvin pienestä, positiivisesti varautuneesta ytimestä, jossa suurin osa atomin massasta on keskittynyt negatiivisesti varautuneiden elektronien ympäröimänä niin, että atomi on sähköisesti neutraali (Kuva \(\PageIndex{5}\)).
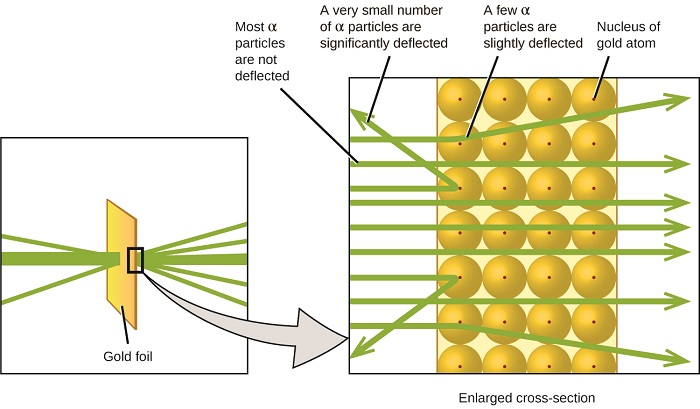
Kuva \(\PageIndex{9}\): α-hiukkaset taipuvat vain, kun ne törmäävät paljon raskaampaan, positiivisesti varautuneeseen kultaytimeen tai kulkevat sen lähellä. Koska ydin on hyvin pieni verrattuna atomin kokoon, hyvin harvat α-hiukkaset taipuvat. Useimmat läpäisevät suhteellisen suuren alueen, jolla on elektroneja, jotka ovat liian kevyitä, jotta nopeasti liikkuvat hiukkaset eivät taipuisi.
monien muiden kokeiden jälkeen Rutherford havaitsi myös, että muiden alkuaineiden ytimet sisältävät vetyytimen ”rakennusosana”, ja hän nimesi tämän perustavanlaatuisemman hiukkasen protoniksi, positiivisesti varautuneeksi, atomiseksi hiukkaseksi, joka löytyy ytimestä. Yhdellä lisäyksellä, jonka saatte seuraavaksi tietää, tätä yli sata vuotta sitten ehdotettua atomin ydinmallia käytetään vielä nykyäänkin.
toinen tärkeä löytö oli isotooppien löytyminen. 1900-luvun alussa tutkijat tunnistivat useita uusilta alkuaineilta vaikuttaneita aineita eristäen niitä radioaktiivisista malmeista. Esimerkiksi toriumin radioaktiivisessa hajoamisessa syntyneelle” uudelle alkuaineelle ” annettiin aluksi nimi mesothorium. Tarkempi analyysi kuitenkin osoitti, että mesothorium oli kemiallisesti identtinen radiumin (toisen hajoamistuotteen) kanssa, vaikka sen atomimassa oli erilainen. Tämä tulos yhdessä muiden alkuaineiden samankaltaisten löydösten kanssa sai englantilaisen kemistin Frederick Soddyn tajuamaan, että alkuaineessa voi olla erilaisia atomeja, joiden massat eivät kemiallisesti erotu toisistaan. Näitä eri tyyppejä kutsutaan isotoopeiksi—saman alkuaineen atomeiksi, jotka eroavat massaltaan. Soddy sai löydöstä Nobelin kemianpalkinnon vuonna 1921.
jäljelle jäi yksi arvoitus: ytimen tiedettiin sisältävän lähes koko atomin massan, protonien lukumäärän muodostaessa vain puolet tai vähemmän tuosta massasta. Erilaisia ehdotuksia tehtiin selittämään, mikä muodosti jäljelle jääneen massan, mukaan lukien neutraalien hiukkasten olemassaolo tumassa. Kuten arvata saattaa, varaamattomien hiukkasten havaitseminen on hyvin haastavaa, ja vasta vuonna 1932 James Chadwick löysi todisteita neutroneista, varaamattomista, atomia pienemmistä hiukkasista, joiden massa on suunnilleen sama kuin protonien. Neutronien olemassaolo selitti myös isotoopit: ne eroavat massaltaan, koska niillä on eri määrä neutroneja, mutta ne ovat kemiallisesti identtisiä, koska niillä on sama määrä protoneja. Tämä selitetään tarkemmin myöhemmin tässä yksikössä.