Entalpia ja kemialliset reaktiot
7.3 entalpia ja kemialliset reaktiot
oppimistavoitteet
- määrittelevät entalpian.
- ilmaisee oikein kemiallisten reaktioiden entalpian muutoksen.
- selitä, miten entalpian muutoksia mitataan kokeellisesti.
nyt kun olemme osoittaneet, miten energia, työ ja lämpö liittyvät toisiinsa, olemme valmiita pohtimaan energiamuutoksia kemiallisissa reaktioissa. Peruskäsite on, että Jokainen kemiallinen reaktio tapahtuu samanaikaisesti energian muutoksen kanssa. Nyt meidän on opittava ilmaisemaan nämä energiamuutokset oikein.
Tutkimuksemme kaasuista luvussa 6 ”kaasut” ja työn määritelmämme kohdassa 7.2 ”työ ja lämpö” osoittavat, että paineen, tilavuuden ja lämpötilan kaltaiset olosuhteet vaikuttavat systeemin energiasisältöön. Tarvitsemme energian määritelmän, joka pätee, kun jotkin näistä olosuhteista on määritelty (hieman samanlainen kuin standardilämpötilan ja-paineen määritelmä kaasujen tutkimuksessa). Määrittelemme entalpia muuttaalämpö prosessin vakiopaineessa; merkitään ΔH. (ΔH) prosessin lämpönä paineen pysyessä vakiona:
ΔH≡qat vakiopaine
kirjain H tarkoittaa ”entalpiaa”, eräänlaista energiaa, kun taas Δ merkitsee suureen muutosta. Olemme aina kiinnostuneita H: n muutoksesta eikä itse h: n itseisarvosta.
kemiallisen reaktion tapahtuessa entalpiassa tapahtuu tunnusomainen muutos. Reaktion entalpiamuutos kirjoitetaan tyypillisesti tasapainotetun kemiallisen yhtälön jälkeen ja samalla viivalla. Esimerkiksi kun kaksi moolia vetyä reagoi yhden moolin kanssa happea muodostaen kaksi moolia vettä, tyypillinen entalpian muutos on 570 kJ. Yhtälö kirjoitetaan
2H2(g) + O2(g) → 2H2O(ℓ) ΔH = -570 kJ
kemiallista yhtälöä, joka sisältää entalpian muutoksen, kutsutaan termokemialliseksi yhtälöksi, joka sisältää entalpian muutoksen.. Termokemiallisen yhtälön oletetaan viittaavan yhtälöön moolisuureina, eli se on tulkittava moolien, ei yksittäisten molekyylien suhteen.
esimerkki 5
Kirjoita termokemiallinen yhtälö PCL3(g): n ja Cl2(g): n reaktiolle, jolloin saadaan PCl5(g), jonka entalpiamuutos on -88 kJ.
liuos
lämpökemiallinen yhtälö on
PCl3(g) + Cl2(G) → PCL5(g) ΔH = -88 kJ
Testaa itse
Kirjoita lämpökemiallinen yhtälö N2(g): n ja O2(g): n reaktiolle, jolloin saadaan 2NO(g), jonka entalpian muutos on 181 kJ.
vastaus
N2(g) + O2(g) → 2NO(g) ΔH = 181 kJ
olet saattanut huomata, että kemiallisen reaktion ΔH voi olla positiivinen tai negatiivinen. Numeron oletetaan olevan positiivinen, jos siinä ei ole merkkiä; a + – merkki voidaan lisätä yksiselitteisesti sekaannusten välttämiseksi. Kemiallista reaktiota, jolla on positiivinen ΔH, sanotaan endotermica-kemialliseksi reaktioksi, jolla on positiivinen muutos entalpiassa., kun taas kemiallinen reaktio, jolla on negatiivinen ΔH, sanotaan olevan eksotermica-kemiallinen reaktio, jolla on negatiivinen entalpian muutos..
Mitä se tarkoittaa, jos prosessin ΔH on positiivinen? Se tarkoittaa, että järjestelmä, jossa kemiallinen reaktio tapahtuu, saa energiaa. Jos ajatellaan, että systeemin energia on esitetty korkeutena pystysuorassa energiakaaviossa, reaktioon liittyvä entalpian muutos voidaan diagrammata kuten osassa (A) Kuvassa 7.3 ”Reaktioenergia”: reaktanttien energialla on jonkin verran energiaa, ja systeemi lisää energiaansa sitä mukaa kuin se menee tuotteisiin. Tuotteet ovat korkeampia pystyasteikolla kuin reagantit. Endoterminen tarkoittaa siis sitä, että systeemi saa eli absorboi energiaa.
eksotermiselle prosessille on päinvastainen tilanne, kuten kuvan 7.3 ”Reaktioenergia”B osassa esitetään. Jos reaktion entalpiamuutos on negatiivinen, systeemi menettää energiaa, joten tuotteilla on vähemmän energiaa kuin reaktanteilla, ja tuotteet ovat pystysuuntaisella energia-asteikolla alhaisempia kuin reaktanteilla. Eksoterminen tarkoittaa siis sitä, että systeemi menettää eli luovuttaa energiaa.
kuva 7.3 Reaktioenergia
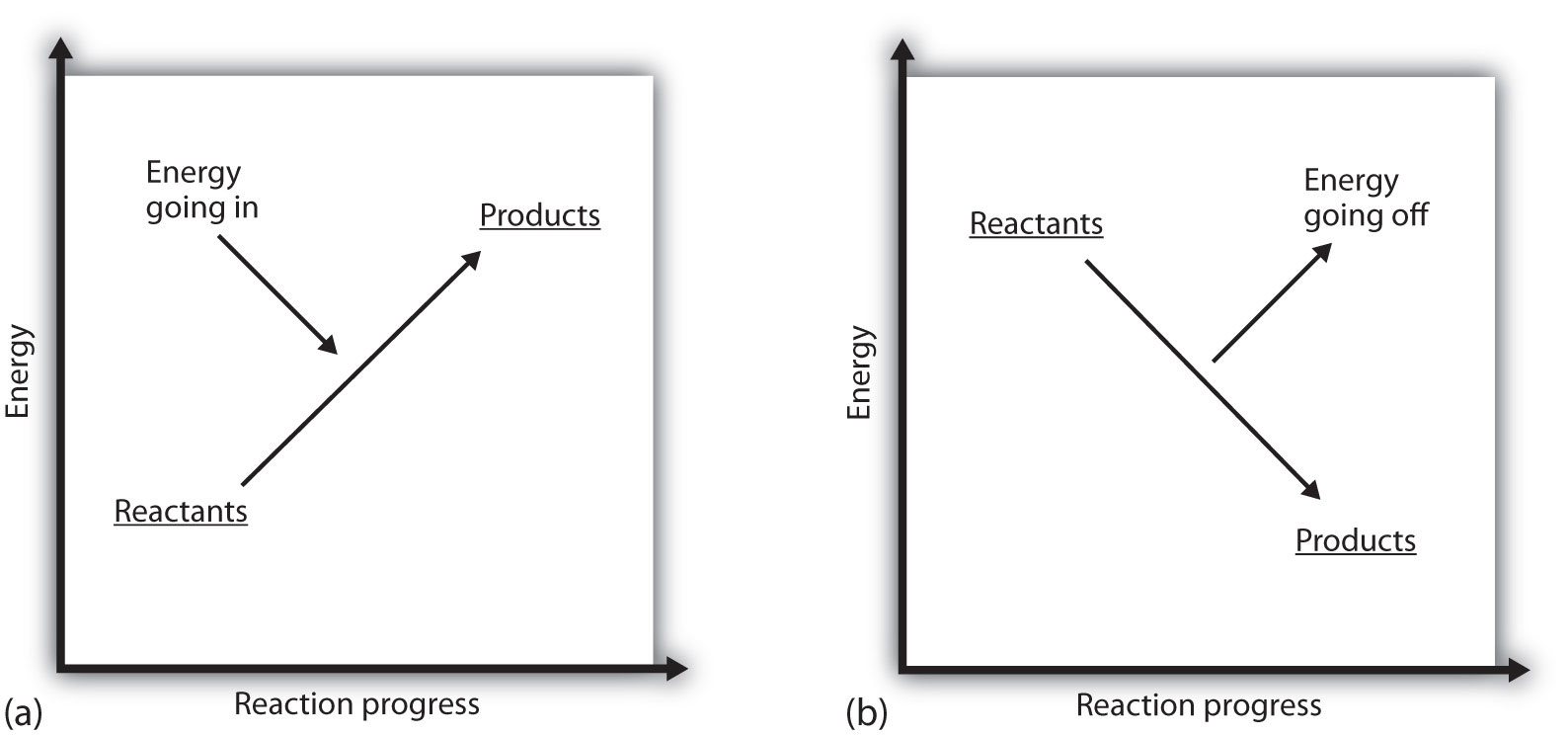
(a) endotermisessä reaktiossa systeemin energia kasvaa (eli liikkuu korkeampana energian pystysuuntaisella asteikolla). B) eksotermisessä reaktiossa systeemin energia pienenee (eli siirtyy alemmaksi energian pystysuuntaisella asteikolla).
esimerkki 6
tarkastellaan tätä lämpökemiallista yhtälöä.
2CO(g) + O2(g) → 2co2(G) ΔH = -565 kJ
Onko se eksoterminen vai endoterminen? Kuinka paljon energiaa luovutetaan tai absorboidaan?
liuos
määritelmän mukaan kemiallinen reaktio, jolla on negatiivinen ΔH, on eksoterminen, eli tämän verran energiaa—tässä tapauksessa 565 kJ—vapautuu reaktiosta.
Testaa itsesi
harkitse tätä lämpökemiallista yhtälöä.
CO2(g) + H2(g) → CO(g) + H2O(G) ΔH = 42 kJ
Onko se eksoterminen vai endoterminen? Kuinka paljon energiaa luovutetaan tai absorboidaan?
vastaus
Endotermiset; absorboituvat 42 kJ.
miten ΔH-arvot mitataan kokeellisesti? Todellisuudessa ΔH: ta ei mitata, vaan q mitataan. Mutta mittaukset suoritetaan vakiopaineessa, joten ΔH on yhtä suuri kuin mitattu q.
kokeellisesti q mitataan hyödyntämällä yhtälöä
q = mcΔT
mittaamme ennalta systeemin kemikaalien massan. Sitten annamme kemiallisen reaktion tapahtua ja mittaamme systeemin lämpötilan muutoksen (ΔT). Jos tiedämme systeemin materiaalien ominaislämmön (tyypillisesti tiedämme), voimme laskea q: n.tämä Q: n arvo on numeerisesti yhtä suuri kuin prosessin ΔH, jonka voimme skaalata mooliasteikkoon asti. Säiliö, jossa järjestelmä asuu, on tyypillisesti eristetty, joten kaikki energiamuutokset menevät järjestelmän lämpötilan muuttamiseen sen sijaan, että ne vuotaisivat järjestelmästä. Säiliöstä käytetään nimitystä kalorimetera-säiliö, jota käytetään kemiallisen reaktion lämmön mittaamiseen., ja entalpian muutosten mittausprosessia kutsutaan kalorimetriksi, jolla mitataan entalpian muutoksia kemiallisiin reaktioihin..
kuva 7,4 Kalorimetriä
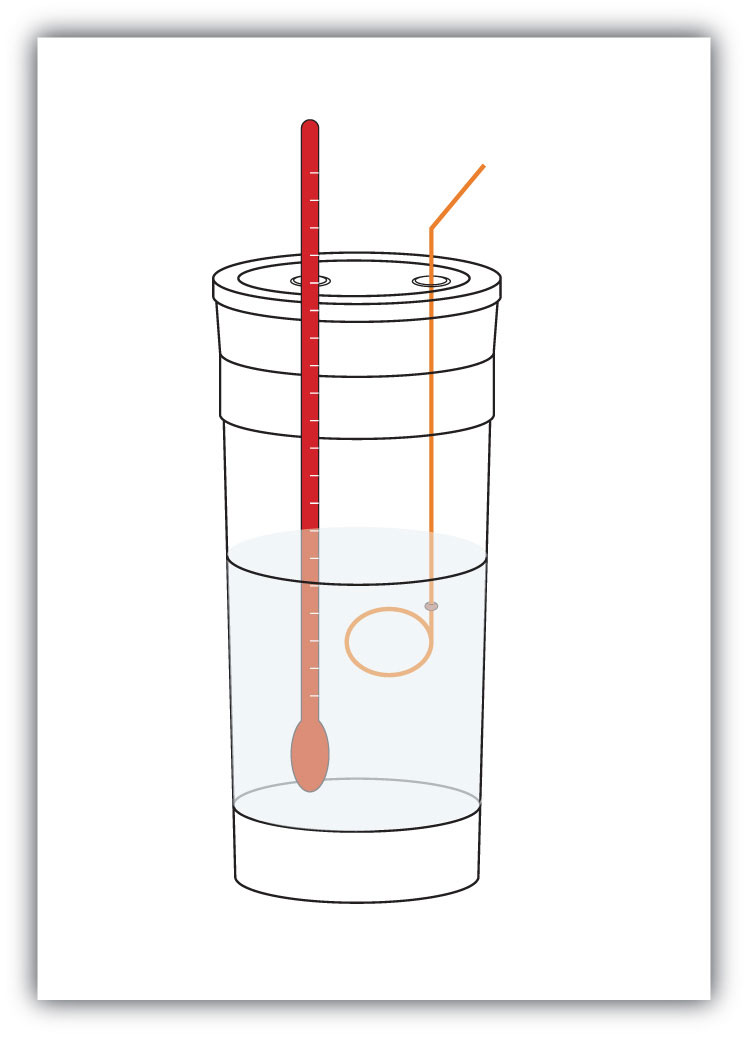
yksinkertainen kalorimetri voidaan rakentaa joistakin sisäkkäisistä vaahtokahvikupeista, kannesta, lämpömittarista ja sekoittimesta.
esimerkiksi oletetaan, että 4, 0 g NaOH: ta eli 0, 10 mol NaOH: ta liuotetaan 100, 0 mL: ksi vesiliuosta, kun taas 3, 65 g HCl: ää eli 0, 10 mol HCl: ää liuotetaan toisen 100, 0 mL: n vesiliuokseksi. Nämä kaksi liuosta sekoitetaan eristettyyn kalorimetriin, lisätään lämpömittari ja peitetään kalorimetri (KS.Kuva 7.4 ”Kalorimetrit” esimerkkitapausta varten). Lämpömittari mittaa lämpötilan muutosta seuraavan kemiallisen reaktion tapahtuessa:
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ)
tarkkailija toteaa, että lämpötila nousee 22,4°C: sta 29,1°C: seen.olettaen, että liuosten lämpökapasiteetit ja tiheydet ovat samat kuin puhtaan veden, meillä on nyt tarvittavat tiedot kemiallisen reaktion entalpian muutoksen määrittämiseksi. Liuoksen kokonaismäärä on 200,0 mL ja tiheys 1,00 g/mL, joten meillä on 200,0 g liuosta. Yhtälöllä q korvataan kokeelliset mittauksemme ja veden ominaislämpö (taulukko 7.1 ”eri aineiden ominaislämpö”):
q=(200.0 g) (4.184 J G⋅°C) (6.7°C)
ratkaiseminen Q: lle, saadaan
q=5,600 J δ ΔH reaktiolle
lämpö q on yhtä suuri kuin ΔH reaktiolle, koska kemiallinen reaktio tapahtuu vakiopaineessa. Reaktiossa kuitenkin vapautuu tämä energiamäärä, joten todellinen merkki ΔH: lle on negatiivinen:
ΔH = -5,600 J reaktiolle
näin ollen meillä on seuraava lämpökemiallinen yhtälö kalorimetrissä tapahtuneelle kemialliselle reaktiolle:
110 NaOH(aq)+110 HCl(aq)→110 NaCl(aq)+110 H2O(ℓ)ΔH=-5,600 J
1/10-kertoimet muistuttavat meitä siitä, että aloitimme moolin kymmenesosalla kutakin reaktanttia eli teemme kymmenesosan moolista jokaisesta tuotteesta. Tyypillisesti raportoimme kuitenkin lämpökemialliset yhtälöt moolien suhteen, emme kymmenesosaa moolista. Jotta voimme skaalata jopa moolisuureita, meidän on kerrottava kertoimet 10: llä. Kun teemme näin, saamme kuitenkin 10 kertaa enemmän energiaa. Näin ollen meillä on
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56,000 j
ΔH voidaan muuntaa kJ-yksiköiksi, joten lopullinen lämpökemiallinen yhtälömme on
NaOH (aq) + HCl(aq) → NaCl(aq) + H2O(ℓ) ΔH = -56 kJ
olemme juuri ottaneet koetietomme kalorimetriasta ja määrittäneet entalpian muutoksen kemiallisen reaktion. Vastaavilla mittauksilla muista kemiallisista reaktioista voidaan määrittää minkä tahansa tutkittavan kemiallisen reaktion ΔH-arvot.
esimerkki 7
100 mL liuosta, jossa 0.25 mol Ca2+(aq) sekoittui 0,50 mol F−(aq) ionien kanssa ja CaF2 saostui:
Ca2+(aq) + 2F−(aq) → CaF2 (S)
liuoksen lämpötila nousi 10,5°C. Mikä oli entalpian muutos kemiallisessa reaktiossa? Mikä oli entalpian muutos 1 mol: n CaF2: n tuotannossa? Oletetaan, että liuoksella on sama tiheys ja ominaislämpö kuin vedellä.
liuos
koska meille annetaan ΔT suoraan, voimme määrittää reaktion lämmön, joka on yhtä suuri kuin ΔH:
q=(100 g)(4.184 J g⋅°c)(10.5°c)
ratkaiseminen Q: lle, saamme
q = 4,400 j
siksi ΔH = -4,400 J.
reaktion stoikiometrian mukaan muodostuu tasan 0,25 mol CaF2: ta, joten tämä lämpömäärä on 0,25 mol. 1 mol: n CaF2: n lämpöä on skaalattava kertoimella neljä:
q = 4,400 J × 4 = 17,600 J 1 mol: n CaF2: lle
moolipohjaisesti, entalpian muutos on
ΔH = -17,600 J = -17,6 kJ
Testaa itsesi
kalorimetrissä vakiopaineessa, 0,10 mol: n CH4(g) ja 0,20 O2(g): n mol reagoi.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ)
reaktio lämmittää 750.0 g H2O: ta 28,4°C: ssa. mikä on ΔH mooliasteikolla tapahtuvalle reaktiolle?
vastaus
-891 kJ
Key Takeaways
- Jokainen kemiallinen reaktio tapahtuu samanaikaisesti energian muutoksen kanssa.
- entalpian muutos vastaa lämpöä vakiopaineessa.
- entalpian muutokset voidaan ilmaista lämpökemiallisten yhtälöiden avulla.
- entalpian muutokset mitataan kalorimetrian avulla.
harjoitukset
-
missä olosuhteissa q ja ΔH ovat samat?
-
missä olosuhteissa Q ja ΔH eroavat toisistaan?
-
vetykaasu ja kloorikaasu reagoivat muodostaen vetykloridikaasua, johon liittyy entalpian muutos -184 kJ. Kirjoita oikein tasapainoinen lämpökemiallinen yhtälö tälle prosessille.
-
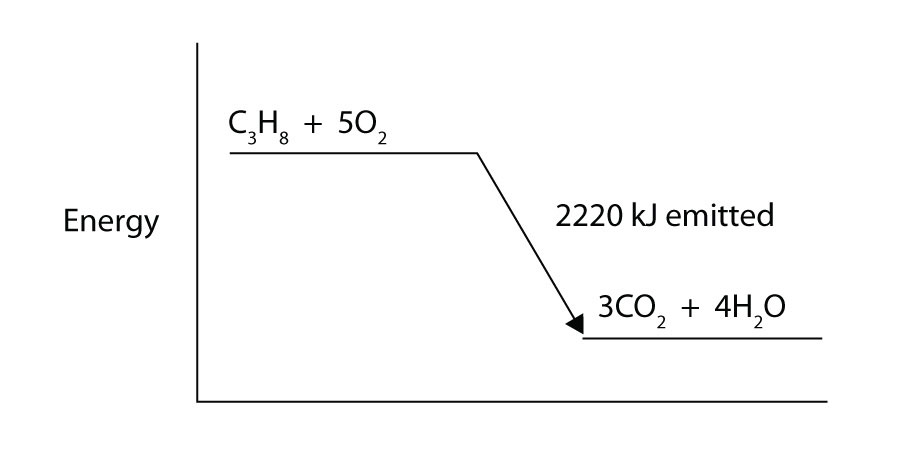
propaani (C3H8) reagoi alkuainekaasun kanssa muodostaen hiilidioksidia ja nestemäistä vettä, johon liittyy -2,220 kJ: n entalpiamuutos. Kirjoita oikein tasapainoinen lämpökemiallinen yhtälö tälle prosessille.
-
typpikaasu reagoi happikaasun kanssa muodostaen NO(g) absorboiden samalla 180 kJ. Kirjoita oikein tasapainoinen lämpökemiallinen yhtälö tälle prosessille.
-
kiinteä natrium reagoi kloorikaasun kanssa muodostaen kiinteää natriumkloridia, jolloin siitä irtoaa 772 kJ. Kirjoita oikein tasapainoinen lämpökemiallinen yhtälö tälle prosessille.
-
vetykaasu ja kloorikaasu reagoivat muodostaen vetykloridikaasua, johon liittyy entalpian muutos -184 kJ. Onko tämä prosessi endoterminen vai eksoterminen?
-
propaani (C3H8) reagoi alkuainekaasun kanssa muodostaen hiilidioksidia luovuttaen samalla 2 220 kJ energiaa. Onko tämä prosessi endoterminen vai eksoterminen?
-
typpikaasu reagoi happikaasun kanssa muodostaen NO(g) absorboiden samalla 180 kJ. Onko tämä prosessi eksoterminen vai endoterminen?
-
Natriummetalli voi reagoida typen kanssa muodostaen natriumatsidia (NaN3), jonka ΔH on 21,72 kJ. Onko tämä prosessi eksoterminen vai endoterminen?
-
Piirrä kemialliselle reaktiolle Energiatasokaavio harjoituksessa 8. (KS.Kuva 7.3″ Reaktioenergia ” esimerkki.)
-
Piirrä kemialliselle reaktiolle Energiatasokaavio harjoituksessa 9. (KS.Kuva 7.3″ Reaktioenergia ” esimerkki.)
-
250 mL: n liuoksessa 0, 25 mol KOH(aq) ja 0, 25 mol HNO3(aq) yhdistetään. Liuoksen lämpötila nousee 22,5°C: sta 35,9°C: seen.Oletetaan, että liuoksella on sama veden tiheys ja lämpökapasiteetti. Mikä on reaktion lämpö ja mikä on reaktion ΔH mooliperusteisesti?
-
600 mL: n liuoksessa 0.50 mol Ca(OH)2(aq) ja 0,50 mol H2SO4(aq) on yhdistetty. Liuoksen lämpötila nousee 22,3°C. Mikä on reaktion lämpö ja mikä on mooliperusteisesti reaktion ΔH? Oletetaan, että liuoksella on sama veden tiheys ja lämpökapasiteetti.
-
lämmitetään 400,0 g H2O: ta, 0,050 mol etanolia (C2H5OH) poltetaan. Vesi lämpenee 24,6°C: sta 65,6°C: seen. mikä on reaktion lämpö ja mikä on moolipohjaisesti reaktion ΔH?
-
lämmitetään 100,0 g H2O: ta, 0,066 mol mehiläisvahaa poltetaan. Vesi lämpenee 21,4°C: sta 25,5°C: seen. mikä on reaktion lämpö ja mikä on reaktion ΔH mooliperusteisesti?
vastauksia
-
vakiopaineessa
-
N2(g) + O2(g) → 2NO(g) δh = 180 kj
-
heat of reaction = -14.0 kj; ΔH = -56,0 kJ/mol reaktanttien
-
reaktion heat = -68,6 kJ; ΔH = -1,370 kJ/mooli etanolia
p> h2(g) + Cl2(G) → 2hcl(g) ΔH = -184 kJ
eksoterminen
endoterminen