Introduction Chemistry-1st Canadian Edition
Learning Objectives
- Define the vapour pressure of liquids.
- selittää sekä pintajännityksen että kapillaarivaikutuksen alkuperän.
on joitakin ominaisuuksia, joita kaikilla nesteillä on. Neste, jonka tunnemme parhaiten, on luultavasti vesi, ja sillä on nämä ominaisuudet. Muissakin nesteissä on niitä, mikä kannattaa pitää mielessä.
kaikissa nesteissä on tietty osa hiukkasistaan, joilla on tarpeeksi energiaa kaasufaasiin pääsemiseksi, ja jos nämä hiukkaset ovat nesteen pinnalla, ne tekevät niin (kuva 10.6 ”höyrystyminen”). Kaasun muodostumista nesteestä kiehumispisteen alapuolella olevassa lämpötilassa kutsutaan höyrystymiseksi. Näissä lämpötiloissa kaasufaasin materiaalia kutsutaan kaasun sijaan höyryksi; termi kaasu on varattu, kun kaasufaasi on stabiili faasi.
kuva 10.6 haihdutus

joillakin nesteen hiukkasilla on niin paljon energiaa, että ne karkaavat nestefaasista höyryksi.
Jos käytettävissä oleva tilavuus on riittävän suuri, lopulta kaikki neste muuttuu höyryksi. Mutta jos käytettävissä oleva tilavuus ei riitä, lopulta osa höyryhiukkasista palaa nestefaasiin (Kuva 10.7 ”tasapaino”). Jossain vaiheessa höyryfaasiin tulevien hiukkasten määrä vastaa höyryfaasista lähtevien hiukkasten määrää, joten höyryn määrässä ei ole nettomuutosta systeemissä. Sanomme, että järjestelmä on tasapainossa. Höyryn osapainetta tasapainotilassa kutsutaan nesteen höyrynpaineeksi.
kuva 10.7 tasapainotila

jossain vaiheessa höyryfaasiin saapuvien hiukkasten määrää tasapainottaa nesteeseen palaavien hiukkasten määrä. Tätä kohtaa kutsutaan tasapainoksi.
ymmärrä, että nesteen haihtuminen ei ole loppunut. Käänteinen prosessi-tiivistyminen-tapahtuu yhtä nopeasti kuin höyrystyminen, joten höyryn määrässä ei tapahdu nettomuutosta systeemissä. Termi dynaaminen tasapaino tarkoittaa tilannetta, jossa prosessi vielä tapahtuu, mutta myös päinvastainen prosessi tapahtuu samalla nopeudella niin, ettei systeemissä tapahdu nettomuutosta.
aineen höyrynpaine riippuu aineen lämpötilasta; lämpötilan kasvaessa myös höyrynpaine. Kuva 10.8 ”tontteja Höyrynpaine vs. lämpötila Useita nesteitä” on kuvaaja höyrynpaine vs. lämpötila useita nesteitä. Kun höyrynpaine on määritelty, voimme myös määritellä uudelleen nesteen kiehumispisteen: lämpötilan, jossa nesteen höyrynpaine on sama kuin ympäröivä ympäristöpaine. Normaali höyrynpaine on siis lämpötila, jossa höyrynpaine on 760 torr eli tasan 1 atm. Kiehumispisteet vaihtelevat siten ympäröivän paineen mukaan, mikä voi vaikuttaa suuresti ruoan kypsentämiseen normaalia alemmissa tai korkeammissa nousuissa. Ilmanpaine vaihtelee huomattavasti korkeuden mukaan.
kuva 10.8 käyrät höyrynpaineesta ja lämpötilasta useiden nesteiden osalta
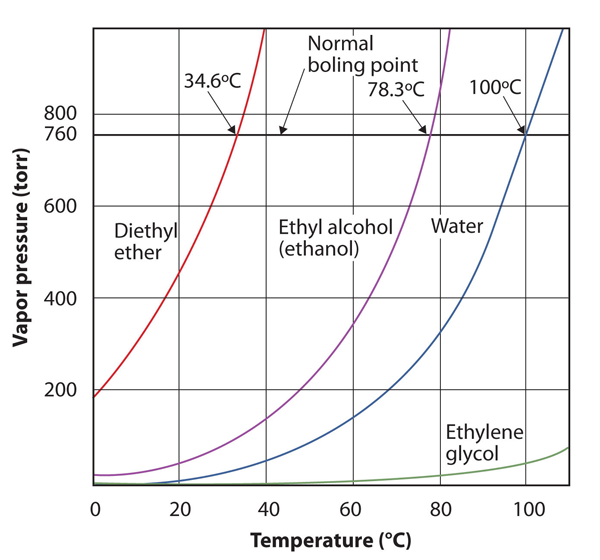
nesteen höyrynpaine riippuu nesteen identiteetistä ja lämpötilasta, kuten Tämä kuvaaja osoittaa.
esimerkki 4
Käytä kuvaa 10.8 ”tontteja höyrynpaineesta ja lämpötilasta useille nesteille” arvioidaksesi veden kiehumispisteen 500 torrissa, joka on likimääräinen Ilmanpaine Mount Everestin huipulla.
ratkaisu
katso oheinen kuva. Viisisataa torr on välillä 400 ja 600, joten me laajentaa linja, että kohta, y-akselin poikki käyrä vettä ja sitten pudota se alas x-akselin lukea liittyvä lämpötila. Näyttää siltä, että vesihöyrynpainekäyrän piste vastaa noin 90°C: n lämpötilaa, joten voimme päätellä, että veden kiehumispiste 500 torrissa on 90°C.
kuva 10.9 käyttäen kuvaa 10.8 ”tontteja höyrynpaineesta vs. lämpötila useille nesteille”vastataksesi esimerkkiin 4
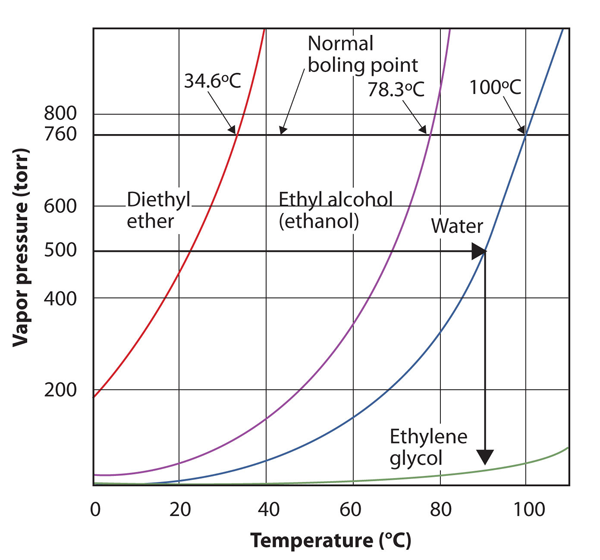
lukemalla kuvaajaa oikein voit arvioida nesteen kiehumispisteen eri lämpötiloissa.
Testaa itse
käytä kuviota 10.8 ”tontteja höyrynpaineesta ja lämpötilasta useille nesteille” arvioidaksesi etanolin kiehumispisteen 400 torriksi.
vastaus
noin 65°C
veden höyrynpainekäyrä ei ole sulamispisteessä tarkalleen nolla-0°C. jäälläkin on höyrynpaine; siksi se sublimoituu ajan myötä. Kiinteiden aineiden höyrynpaine on kuitenkin tyypillisesti paljon pienempi kuin nesteiden. Lämpötilassa -1°C jään höyrynpaine on 4,2 torr. Pakastuslämpötilassa 0 ° F (-17°C) jään höyrynpaine on vain 1,0 torr; niin kutsutut syväpakastimet voivat laskea -23°C: seen, jossa jään höyrynpaine on vain 0,6 torr.
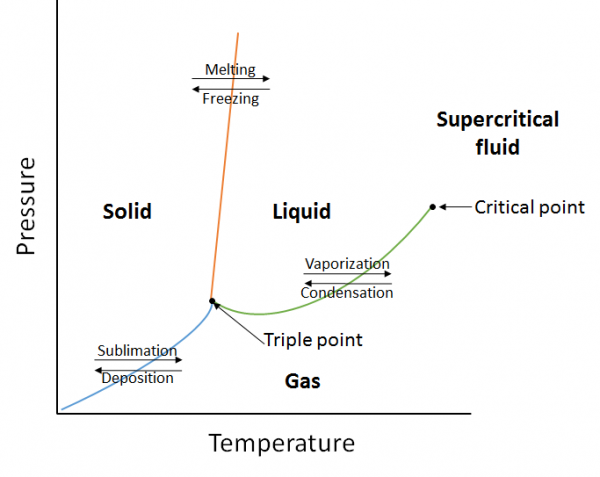
Faasikaaviot
faasikaavio on graafinen esitys tasapainosuhteista, joita esiintyy aineen faasien välillä määrätyissä paineissa ja lämpötiloissa (Kuva 10.10). Faasidiagrammi on kolmen käyrän yhdistelmä: höyrynpainekäyrä, sulamiskäyrä ja sublimaatiokäyrä. Olemme aiemmin nähneet, että höyrynpainekäyrät edustavat neste-ja kaasufaasin välistä tasapainoa, ja piste, jossa paine on yhtä kuin 1 atm, on normaali kiehumispiste. Yksi tämän käyrän lisäominaisuus faasidiagrammissa (vihreä) on, että se päättyy kriittiseen pisteeseen. Kriittinen piste on korkeimman lämpötilan ja paineen piste, jossa nesteet ja kaasut pysyvät erotettavissa. Tämän pisteen ulkopuolisissa lämpötiloissa ja paineessa aine esiintyy faasissa, jonka ominaisuudet sekä nesteille että kaasuille tunnetaan ylikriittisenä nesteenä.
sulamiskäyrä (oranssi) kuvaa kiinteän ja nesteen välistä tasapainoa, ja piste, jossa paine on 1 atm, on normaali sulamispiste. Sublimaatiokäyrä (sininen) kuvaa kiinteän ja kaasun välistä tasapainoa. Lopuksi piste, jossa kaikki kolme käyrää kohtaavat, tunnetaan kolmoispisteenä. Tässä vaiheessa kolme faasia (kiinteä, neste ja kaasu) ovat kaikki tasapainossa.
esimerkki:
seuraavan faasidiagrammin avulla määritetään, mitä tapahtuisi, jos:
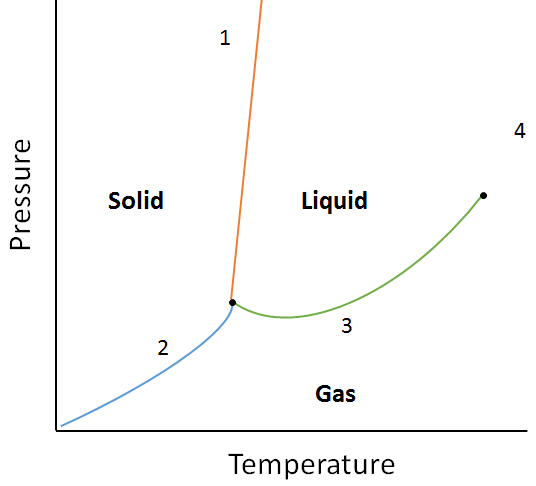
a. lämpötila nostetaan aineelle pisteessä 1.
b. aineen paine kasvaa kohdassa 3.
liuos:
A. aines kohdassa 1 sulaa (muuttuva faasi kiinteästä nesteeksi), jos lämpötilaa nostetaan.
b. Aines kohdassa 3 tiivistyy (vaihtaa faasin kaasusta nesteeksi), jos lämpötilaa nostetaan.
pintajännitys ja Kapillaaritoiminta
kaikilla nesteillä on myös joitakin muita ominaisuuksia. Pintajännitys on nesteen pinnalla oleviin atomeihin kohdistuvien voimien epätasapainon aiheuttama vaikutus, kuten kuvassa 10.11″pintajännitys” on esitetty. Nesteen suurimman osan sininen hiukkanen kokee eri puolilta tulevia molekyylien välisiä voimia, kuten nuolet osoittavat. Pinnalla oleva keltainen hiukkanen ei kuitenkaan koe yläpuolellaan olevia voimia, koska sen yläpuolella ei ole hiukkasia. Tämä johtaa voimien epätasapainoon, jota kutsumme pintajännitykseksi.
kuva 10.11 pintajännitys

pintajännitys johtuu siitä, että nesteen pinnalla olevat hiukkaset eivät koe vuorovaikutuksia kaikista suunnista, mikä johtaa voimien epätasapainoon pinnalla.
kuva 10.12 pintajännityksen vaikutukset

lähde: Cristian rubertin” wet apple ” on lisensoitu Creative Commons Attribution-NonCommercial-ShareAlike 2.0 Generic-lisenssillä.