Introduction Chemistry-1st Canadian Edition
Learning Objectives
- Define buffer.
- tunnistaa puskurin kaksi komponenttia oikein.
kuten kohdassa 12.4 ”vahvat ja heikot hapot ja emäkset ja niiden suolat” todetaan, heikot hapot ovat suhteellisen yleisiä myös syömistämme elintarvikkeista. Mutta silloin tällöin törmäämme voimakkaaseen happoon tai emäkseen, kuten vatsahappoon, jonka pH on vahvasti hapan 1,7. Määritelmän mukaan vahvat hapot ja emäkset voivat tuottaa suhteellisen suuren määrän H+− tai OH-ioneja, minkä vuoksi niillä on huomattava kemiallinen aktiivisuus. Lisäksi hyvin pienet määrät vahvoja happoja ja emäksiä voivat muuttaa liuoksen pH: ta hyvin nopeasti. Jos verenkiertoon lisättäisiin 1 mL mahahappoa eikä korjausmekanismia olisi, veren pH laskisi noin 7,4: stä noin 4,7: ään—pH, joka ei edistä elämän jatkumista. Onneksi elimistöllä on mekanismi tällaisten dramaattisten pH-muutosten minimoimiseksi.
mekanismiin kuuluu puskuriliuos, liuos, joka kestää dramaattisia pH: n muutoksia. Puskurit tekevät sen siten, että ne koostuvat tietyistä liuotinpareista: joko heikosta haposta ja siitä peräisin olevasta suolasta tai heikosta emäksestä ja heikosta emäksestä. Puskuri voi koostua esimerkiksi liuenneesta HC2H3O2: sta (heikko happo) ja nac2h3o2: sta (kyseisestä heikosta haposta johdettu suola). Toinen esimerkki puskurista on liuos, jossa on NH3 (heikko emäs) ja NH4Cl (suola, joka on johdettu tästä heikosta emäsestä).
käyttäkäämme HC2H3O2 / NaC2H3O2-puskuria osoittaaksemme, miten Puskurit toimivat. Jos puskuriliuokseen lisätään vahva emäs eli Oh−(aq)—ionien lähde, nämä OH− ionit reagoivat hc2h3o2: n kanssa happo-emäsreaktiossa:
HC2H3O2(aq) + OH−(aq) → H2o(ℓ) + c2h3o2−(aq)
sen sijaan, että muuttaisivat pH: ta dramaattisesti tekemällä liuoksesta emäksisen, lisättävät OH− ionit reagoivat muodostaen H2O: ta, joten pH ei muutu paljon.
Jos puskuriliuokseen lisätään vahva happo eli H+—ionien lähde, h+—ionit reagoivat suolasta tulevan anionin kanssa. Koska HC2H3O2 on heikko happo, se ei ionisoidu juurikaan. Tämä tarkoittaa, että jos samassa liuoksessa on paljon H+− ioneja ja C2H3O2−ioneja, ne yhtyvät muodostaen HC2H3O2:
H+(aq) + c2h3o2 – (aq) → HC2H3O2(aq)
sen sijaan, että muuttaisivat pH: ta dramaattisesti ja tekisivät liuoksesta happaman, lisättävät H+ – ionit reagoivat muodostaen molekyylejä heikosta haposta. Kuva 12.2″ puskurien toimet ” kuvaa puskurin molempia toimia.
kuva 12.2 puskureiden vaikutus
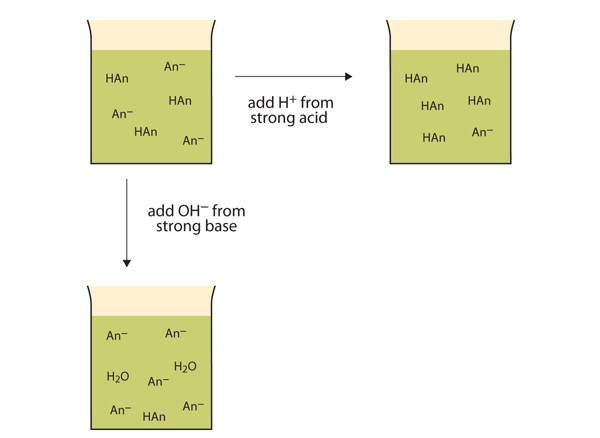
Puskurit voivat reagoida sekä vahvojen happojen (ylhäällä) että vahvojen emästen (puolella) kanssa minimoidakseen suuret pH-muutokset.
heikoista emäksistä valmistetut Puskurit ja heikkojen emästen suolat toimivat samalla tavalla. Esimerkiksi puskurissa, joka sisältää NH3: A ja NH4Cl: ää, NH3− molekyylit voivat reagoida minkä tahansa voimakkaiden happojen tuoman h+−ionin kanssa:
NH3(aq) + h+(aq) → NH4+(aq)
kun taas NH4+(aq) – ioni voi reagoida minkä tahansa vahvojen emästen tuoman OH-ionin kanssa:
NH4+(aq) + OH – (aq) → NH3(aq) + H2O(ℓ)
esimerkki 15
mitkä yhdisteiden yhdistelmät voivat tehdä puskuriliuoksen?
- HCHO2 ja nacho2
- HCl ja NaCl
- CH3NH2 ja Ch3nh3cl
- NH3 ja NaOH
liuos
- HCHO2 on muurahaishappo, heikko happo, kun taas nacho2 on heikon hapon anionista (formiaatti-ioni) valmistettu suola. Näiden kahden solutin yhdistelmä tekisi puskuriratkaisun.
- HCl on vahva happo, ei heikko happo, joten näiden kahden liuottimen yhdistelmä ei muodostaisi puskuriliuosta.
- CH3NH2 on metyyliamiini, joka on NH3: n tavoin yksi sen H-atomeista korvautunut CH3-ryhmällä. Koska sitä ei ole lueteltu taulukossa 12.2 ”Vahvat hapot ja emäkset”, voimme olettaa, että se on heikko emäs. Yhdiste CH3NH3Cl on suola, joka on valmistettu tästä heikosta emäksestä, joten näiden kahden liuottimen yhdistelmä muodostaisi puskuriliuoksen.
- NH3 on heikko emäs, mutta NaOH on vahva emäs. Näiden kahden solutin yhdistelmä ei muodostaisi puskuriratkaisua.
Testaa itse
mitkä yhdisteiden yhdistelmät voivat tehdä puskuriliuoksen?
- aHCO3 ja NaCl
- H3po4 ja NaH2PO4
- NH3 ja (NH4)3PO4
- NaOH ja NaCl
vastauksia
ei Kylläp> Puskurit toimivat hyvin vain rajoitetun määrän lisättyä vahvaa happoa tai emästä. Kun jompikumpi liuotin on täysin reagoinut, liuos ei ole enää puskuri, ja pH: ssa voi tapahtua nopeita muutoksia. Sanomme, että puskurilla on tietty kapasiteetti. Puskurit, jotka ovat enemmän liuotettu niihin aluksi on suurempi kapasiteetti, kuten voidaan odottaa.
ihmisen veressä on puskurointijärjestelmä, jolla minimoidaan äärimmäiset pH− muutokset. yksi puskuri veressä perustuu HCO3-ja H2CO3-pitoisuuksiin . Tämän puskurin ollessa läsnä, vaikka jokin mahahappo pääsisikin suoraan verenkiertoon, veren pH: n muutos olisi vähäinen. Monissa elimistön soluissa on fosfaatti-ioneihin perustuva puskurointijärjestelmä.
Ruoka – ja Juomasovellus: Kipua lievittävä happo
vaikka lääkkeet eivät varsinaisesti ole ”ruokaa ja juomaa”, nielemme niitä, joten katsokaamme happoa, joka lienee yleisin lääke: asetyylisalisyylihappoa, joka tunnetaan myös aspiriinina. Aspiriini tunnetaan hyvin kipulääkkeenä ja antipyreettinä (kuumeen vähentäjänä).
aspiriinin rakenne on esitetty oheisessa kuvassa. Happo-osa on ympyröity; siinä oleva H-atomi voidaan luovuttaa aspiriinin toimiessa Brønsted-Lowry-happona. Koska sitä ei ole taulukossa 12.2 ”Vahvat hapot ja emäkset”, asetyylisalisyylihappo on heikko happo. Se on kuitenkin edelleen happo, ja koska jotkut ihmiset kuluttavat suhteellisen suuria määriä aspiriinia päivittäin, sen hapan luonne voi aiheuttaa ongelmia mahalaukun limakalvossa huolimatta siitä, että vatsa on puolustautunut omaa vatsahappoaan vastaan.
kuva 12.3 aspiriinin molekyylirakenne

ympyröidyt atomit ovat molekyylin hapan osa.
koska aspiriinin happo-ominaisuudet voivat olla ongelmallisia, monet aspiriinimerkit tarjoavat lääkkeestä ”puskuroitua aspiriinia”. Näissä tapauksissa aspiriini sisältää myös puskuroivaa ainetta-yleensä MgO: ta-joka säätelee aspiriinin happamuutta sen happamien sivuvaikutusten minimoimiseksi.
niin hyödyllinen ja yleinen kuin aspiriini onkin, sitä alettiin virallisesti markkinoida lääkkeenä vuodesta 1899 alkaen. US Food and Drug Administration (FDA), valtion virasto, jonka tehtävänä on valvoa ja hyväksyä huumeita Yhdysvalloissa, perustettiin vasta vuonna 1906. Jotkut ovat väittäneet, että jos FDA olisi perustettu ennen aspiriinin käyttöönottoa, aspiriini ei ehkä olisi koskaan saanut hyväksyntää, koska sillä voi olla haittavaikutuksia: ruoansulatuskanavan verenvuotoa, korvien soimista, Reyen oireyhtymää (maksaongelma) ja joitakin allergisia reaktioita. Aspiriinia on kuitenkin viime aikoina mainostettu sen vaikutusten vuoksi, jotka vähentävät sydänkohtauksia ja aivohalvauksia, joten on todennäköistä, että aspiriini on tullut jäädäkseen.
Key Takeaways
- puskuri on liuos, joka kestää äkillisiä pH-arvon muutoksia.
harjoitukset
-
Määrittele puskuri. Mitä kahta toisiinsa liittyvää kemiallista komponenttia tarvitaan puskurin tekemiseen?
-
voidaanko puskuria tehdä yhdistämällä vahva happo ja vahva emäs? Miksi tai miksi ei?
-
mitkä yhdisteiden yhdistelmät voivat muodostaa puskurin? Oletetaan vesiliuokset.
a) HCl ja NaCl
b) HNO2 ja NaNO2
c) NH4NO3 ja HNO3
d) NH4NO3 ja NH3
4. Mitkä yhdistelmät voivat tehdä puskurin? Oletetaan vesiliuokset.
a) H3po4 ja Na3PO4
b) NaHCO3 ja Na2CO3
c) NaNO3 ja Ca(NO3)2
d) HN3 ja NH3
5. Jokaiselle harjoituksessa 3 olevalle yhdistelmälle, joka on puskuri, Kirjoita kemialliset yhtälöt puskurikomponenttien reaktioille, kun vahva happo ja vahva emäs lisätään.
6. Kullekin yhdistelmälle harjoituksessa 4, joka on puskuri, Kirjoita kemialliset yhtälöt puskurikomponenttien reaktioille, kun vahva happo ja vahva emäs lisätään.
7. Täydellinen fosfaattipuskurijärjestelmä perustuu neljään aineeseen: H3PO4, H2PO4 -, HPO42 – ja PO43 -. Mitä erilaisia puskuriliuoksia näistä aineista voidaan valmistaa?
8. Selittäkää, miksi NaBr ei voi olla komponentti happamassa tai emäksisessä puskurissa.
9. Valmistetaan kaksi liuosta, jotka sisältävät samoja pitoisuuksia liuoksia. Yksi ratkaisu koostuu H3PO4: stä ja Na3PO4: stä, kun taas toinen koostuu HCN: stä ja NaCN: stä. Millä ratkaisulla pitäisi olla suurempi kapasiteetti puskurina?
10. Valmistetaan kaksi liuosta, jotka sisältävät samoja pitoisuuksia liuoksia. Yksi ratkaisu koostuu NH3: sta ja NH4NO3: sta, kun taas toinen koostuu H2SO4: stä ja Na2SO4: stä. Millä ratkaisulla pitäisi olla suurempi kapasiteetti puskurina?
vastaa
puskuri on heikon hapon tai emäksen ja tämän heikon hapon tai emäksen suolan yhdistelmä.
a) Ei
b) Kyllä
c) ei
d) Kyllä
3b: vahva happo: NO2− + H+ → HNO2; vahva emäs: HNO2 + OH− → NO2− + H2O; 3d: vahva emäs: NH4+ + OH− → NH3 + H2O; vahva happo: NH3 + H+ → NH4+7.
puskureita voidaan valmistaa kolmesta yhdistelmästä: (1) H3PO4 ja H2PO4−, (2) H2PO4-ja HPO42 -, ja (3) HPO42− ja PO43−. (Teknisesti puskuri voidaan tehdä mistä tahansa kahdesta osasta.)
fosfaattipuskurin kapasiteetin tulisi olla suurempi.