Mupirocin Cream
yleisnimi: mupirocin calcium
annosmuoto: cream
Drugs.com. viimeksi päivitetty Jan 1, 2021.
- yleiskatsaus
- haittavaikutukset
- lisää
annostus ammatillinen raskaus
käyttöaiheet ja käyttö Mupirosiinivoiteessa
Mupirosiinivoide USP, 2% on tarkoitettu toissijaisesti infektoituneiden traumaattisten iholeesioiden (enintään 10 cm: n pituisten tai 100 cm2: n pituisten) hoitoon, jotka johtuvat herkästä isolaatit Staphylococcus aureus (S. aureus) ja Streptococcus pyogenes (S. pyogenes).
Mupirosiinivoide Annostus ja anto
- vain paikalliseen käyttöön.
- Levitä pieni määrä Mupirosiinivoidetta pumpulipuikolla tai harsotyynyllä hoidettavalle alueelle 3 kertaa päivässä 10 päivän ajan.
- peitä käsitelty alue halutessasi harsosidoksella.
- arvioi uudelleen potilaat, joilla ei ilmennyt kliinistä vastetta 3-5 päivän kuluessa.
- Mupirosiinivoide ei ole tarkoitettu intranasaaliseen, oftalmiseen tai muuhun limakalvokäyttöön .
- Älä käytä Mupirosiinivoidetta samanaikaisesti muiden voiteiden, voiteiden tai voiteiden kanssa .
annosmuodot ja vahvuudet
Mupirosiinivoide USP, 2% on valkoinen voide, joka sisältää 20 mg (2% w / w) mupirosiinia grammaa kohti öljy – ja vesipohjaisessa emulsiossa, joka toimitetaan 15 gramman ja 30 gramman putkissa.
vasta-aiheet
Mupirosiinivoide on vasta-aiheinen potilailla, joiden tiedetään olevan yliherkkiä mupirosiinille tai Mupirosiinivoiteen jollekin apuaineelle.
Varoitukset ja varotoimet
vakavia allergisia reaktioita
systeemisiä allergisia reaktioita, mukaan lukien anafylaksia, urtikaria, angioedeema ja yleistynyt ihottuma, on raportoitu potilailla, joita on hoidettu mupirosiiniformulaatioilla, mukaanlukien Mupirosiinivoide .
silmä-ärsytys
vältä kosketusta silmiin. Jos valmistetta joutuu vahingossa iholle, huuhtele hyvin vedellä.
paikallinen ärsytys
Jos Mupirosiinivoide herkistyy tai aiheuttaa vakavan paikallisen ärsytyksen, tulee käyttö lopettaa ja aloittaa sopiva vaihtoehtoinen hoito infektiolle.
Clostridium difficileen liittyvää ripulia
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu lähes kaikkien antibakteeristen aineiden käytön yhteydessä, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan koliittiin. Hoito antibakteerisia aineita muuttaa normaalia kasvistoa paksusuolen johtaa umpeenkasvua C. vaikea.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD: n kehittymistä. Hypertoksiinia tuottavat C-kannat. difficile aiheuttaa lisääntynyt sairastuvuus ja kuolleisuus, koska nämä infektiot voivat olla tulenkestäviä mikrobilääkkeiden hoito ja voi vaatia colectomy. CDAD on otettava huomioon kaikilla potilailla, joilla esiintyy ripulia jälkeen antibakteerinen huumeiden käyttö. Huolellinen lääketieteellinen tausta on tarpeen, koska CDAD: n on raportoitu ilmaantuvan yli 2 kuukauden kuluttua antibakteeristen lääkevalmisteiden antamisesta.
Jos CDAD: tä epäillään tai se on vahvistettu, jatkuva bakteerilääkkeiden käyttö, joka ei ole suunnattu C. difficile-bakteeria vastaan, voidaan joutua lopettamaan. Asianmukainen nesteen ja elektrolyytin hallinta, proteiini lisäravinteen, antibakteerinen hoito C. difficile, ja kirurginen arviointi olisi aloitettava kliinisesti osoitettu.
mikrobien liikakasvun mahdollisuus
kuten mupirosiinivoiteen pitkäaikainen käyttö voi johtaa ei-rasvaisten mikro-organismien, myös sienten, liikakasvuun .
Limakalvokäyttöön liittyvä riski
Mupirosiinivoidetta ei ole tarkoitettu käytettäväksi limakalvopinnoilla. Erillinen formulaatio, mupirocin calcium nasal voide, on saatavilla intranasaaliseen käyttöön.
haittavaikutukset
seuraavia haittavaikutuksia on käsitelty yksityiskohtaisemmin pakkausmerkintöjen muissa kohdissa:
- vakavat allergiset reaktiot
- silmä-ärsytys
- paikallinen ärsytys
- Clostridium difficile-liittyvä ripuli
kliiniset kokeet
koska kliinisiä tutkimuksia tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määriä ei voida suoraan verrattuna toisen lääkkeen kliinisiin tutkimuksiin, eivätkä ne välttämättä heijasta käytännössä havaittuja määriä.
kahdessa satunnaistetussa kaksoissokkotutkimuksessa 339 koehenkilöä hoidettiin paikallisella Mupirosiinivoiteella ja oraalisella lumelääkkeellä. Haittavaikutuksia esiintyi 28: lla (8, 3%) tutkimushenkilöllä. Seuraavia haittavaikutuksia raportoitiin kliinisissä tutkimuksissa vähintään 1%: lla koehenkilöistä Mupirosiinivoiteen käytön yhteydessä: päänsärky (1, 7%), ihottuma (1, 1%) ja pahoinvointi (1, 1%).
muita haittavaikutuksia, joita esiintyi alle 1%: lla koehenkilöistä, olivat vatsakipu, polttelu kiinnityskohdassa, selluliitti, ihotulehdus, huimaus, kutina, sekundaarinen haavainfektio ja haavainen suutulehdus.
toissijaisesti infektoituneen ekseeman tukitutkimuksessa 82 koehenkilöä hoidettiin Mupirosiinivoiteella. Haittavaikutusten ilmaantuvuus oli seuraava: pahoinvointi (4, 9%), päänsärky ja kirvely kiinnityskohdassa (3, 6% kummassakin), kutina (2, 4%) ja 1 raportoivat jokaisesta vatsakivusta, ekseeman aiheuttamasta verenvuodosta, ekseeman aiheuttamasta kivusta, nokkosihottumasta, kuivasta ihosta ja ihottumasta.
markkinoille tulon jälkeen
kliinisistä tutkimuksista raportoitujen haittavaikutusten lisäksi markkinoille tulon jälkeen on havaittu seuraavia haittavaikutuksia Mupirosiinivoiteen käytön aikana. Koska ne ilmoitetaan vapaaehtoisesti populaatiosta, jonka koko on tuntematon, yleisyysarvioita ei voida tehdä. Nämä reaktiot on valittu sisällytettäviksi, koska niiden vakavuus, raportointitiheys tai mahdollinen syy-yhteys Mupirosiinivoiteeseen on yhdistetty.
immuunijärjestelmän häiriöt
systeemiset allergiset reaktiot, kuten anafylaksia, urtikaria, angioedeema ja yleistynyt ihottuma .
käyttö erityisryhmillä
raskaus
Riskikooste
ihmisillä ei ole riittävästi tietoa sen määrittämiseksi, liittyykö Mupirosiinivoiteeseen riski raskaana oleville naisille. Mupirosiinin systeeminen imeytyminen ehjän ihmisen ihon läpi on vähäistä paikallisen Mupirosiinivoiteen antamisen jälkeen . Rotilla ei havaittu kehitystoksisuutta, kun mupirosiinia annettiin ihon alle organogeneesin aikana annoksilla 160 mg / kg / vrk tai 40 mg / kg / vrk (22-kertainen annos ihmisen paikalliseen annokseen verrattuna perustuen laskuihin annoksesta jaettuna koko kehon pinta-alalla).
arvioitua vakavien synnynnäisten epämuodostumien ja keskenmenojen riskiä ei tiedetä ilmoitetussa potilasryhmässä. Arvioitu taustariski Yhdysvaltain yleisväestössä on 2-4 prosenttia ja keskenmenon riski 15-20 prosenttia kliinisesti tunnistetuista raskauksista.
tiedot
Eläintiedot: Rotille ja kaniineille ihon alle annetun mupirosiinin kehitystoksisuustutkimuksia on tehty organogeneesin aikana enintään 160 mg / kg: n vuorokausiannoksilla. Tämä annos on 22-kertainen ja 43-kertainen ihmisen paikalliseen annokseen (noin 60 mg mupirosiinia vuorokaudessa) verrattuna, kun annos on laskettu jaettuna koko kehon pinta-alalla. Molemmilla eläinlajeilla havaittiin emotoksisuutta (painon lasku/painonnousun hidastuminen ja ruokinnan väheneminen), mutta rotilla ei havaittu merkkejä kehitystoksisuudesta. Kaniineilla sikiövaikutusten arviointi estyi suuren annoksen yhteydessä ilmenneen liiallisen emotoksisuuden vuoksi. Kaniineilla ei havaittu kehitystoksisuutta annoksella 40 mg / kg / vrk, joka on 11-kertainen ihmisen paikalliseen annokseen verrattuna.
mupirosiini, joka annettiin ihon alle rotille pre – ja postnataalisessa kehitystutkimuksessa (annettiin tiineyden loppupuolella imetyksen aikana), liittyi 106 annoksen kohdalla poikasten elinkyvyn heikkenemiseen varhaisessa postnataalisessa vaiheessa.7 mg / kg pistoskohdan ärsytyksen ja/tai ihonalaisen verenvuodon yhteydessä. Tämä annos on 14-kertainen ihmisen paikalliseen annokseen verrattuna, jaettuna koko kehon pinta-alalla. Tässä tutkimuksessa Haittavaikutukseton annos oli 44, 2 mg / kg päivässä, mikä on 6 kertaa ihmisen paikallinen annos.
imetys
Riskikoostumus
ei tiedetä, erittyykö mupirosiini äidinmaitoon, vaikuttaako se rintaruokinnassa olevaan lapseen tai vaikuttaako se maidontuotantoon. Imetyksen ei kuitenkaan odoteta johtavan lapsen altistumiseen lääkkeelle, koska mupirosiinin systeeminen imeytyminen ihmisellä on vähäistä mupirosiinivoiteen paikallisen annostelun jälkeen . Imetyksen kehitys-ja terveyshyödyt on otettava huomioon yhdessä äidin kliinisen tarpeen kanssa Mupirosiinivoiteesta ja mahdollisista haittavaikutuksista imetettävälle lapselle tai taustalla olevasta äidin sairaudesta.
kliiniset näkökohdat
lapsille suun kautta annetun lääkealtistuksen minimoimiseksi mupirosiinivoiteella hoidettu rinta ja / tai nänni tulee pestä huolellisesti ennen imetystä.
lapsipotilailla
Mupirosiinivoiteen turvallisuus ja tehokkuus on osoitettu 3 kk-16 vuoden ikäisillä. Mupirosiinivoiteen käyttöä näissä ikäryhmissä Tukee Näyttö riittävistä ja hyvin kontrolloiduista Mupirosiinivoiteella tehdyistä aikuispotilailla tehdyistä tutkimuksista sekä lisätietoa 93 lapsipotilaalta, joita tutkittiin osana aikuisilla tehtyjä avaintutkimuksia .
geriatrinen käyttö
kahdessa riittävässä ja hyvin kontrolloidussa tutkimuksessa 30 yli 65-vuotiasta koehenkilöä hoidettiin Mupirosiinivoiteella. Tässä potilasryhmässä ei havaittu yleistä eroa Mupirosiinivoiteen tehossa tai turvallisuudessa verrattuna nuorempiin potilaisiin.
Mupirosiinivoide kuvaus
Mupirosiinivoide USP, 2% sisältää RNA-syntetaasin estäjän antibakteerista dihydraattia, kiteistä kalsiumhemisuolaa, mupirosiinia. Kemiallisesti se on (aE,2s,3R,4r,5s)-5-tetrahydro-3,4-dihydroksi-ß-metyyli-2H-pyraani-2-krotonihappo, esteri 9-hydroksinonaanihapon kanssa, kalsiumsuola (2:1), dihydraatti.
mupirosiinikalsiumin molekyylikaava on (C26H43O9 )2C∙2H2O ja molekyylipaino on 1075,3. Mupirosiinivapaan hapon molekyylipaino on 500,6. Mupirosiinikalsiumin rakennekaava on:
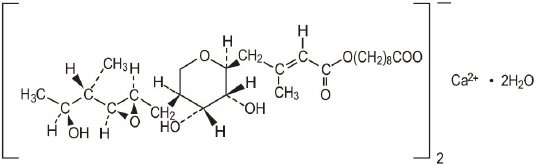
jokainen gramma Mupirosiinivoidetta sisältää 20 mg (2% w/w) mupirosiinia vastaten 21, 5 mg (2, 15% w/w) mupirosiinikalsiumia. The inactive ingredients are benzyl alcohol, cetomacrogol 1000, cetyl alcohol, mineral oil, phenoxyethanol, purified water, stearyl alcohol, and xanthan gum.
Mupirocin Cream – Clinical Pharmacology
Mechanism of Action
Mupirocin is an RNA synthetase inhibitor antibacterial .
Pharmacokinetics
Absorption
Systemic absorption of mupirocin through intact human skin is minimal. Mupirosiinin systeemistä imeytymistä tutkittiin, kun Mupirosiinivoidetta annettiin 3 kertaa päivässä 5 päivän ajan erilaisiin yli 10 cm: n pituisiin tai 100 cm2: n pituisiin iholeesioihin 16 aikuisella (29-60-vuotiaat) ja 10 lapsella (3-12-vuotiaat). Jonkin verran systeemistä imeytymistä havaittiin, kuten metaboliitin, monihapon, toteaminen virtsasta osoitti. Tämän tutkimuksen tiedot osoittivat, että ihonalainen imeytyminen oli yleisempää lapsilla (90% tutkimushenkilöistä) kuin aikuisilla (44% tutkimushenkilöistä); kuitenkin havaitut virtsapitoisuudet lapsilla (0, 07-1.3 mikrog / mL ) ovat aikuispopulaatiossa havaitulla vaihteluvälillä (0, 08-10, 03 mikrog / mL). Toistuvan annostelun jälkeen ihonalainen imeytyminen näyttää yleensä olevan vähäistä aikuisilla ja lapsilla.
Mupirosiinivoiteen samanaikaisen käytön vaikutusta muihin paikallisiin valmisteisiin ei ole tutkittu .
eliminaatio
tutkimuksessa, johon osallistui 7 tervettä aikuista mieshenkilöä, mupirosiinin eliminaation puoliintumisaika laskimonsisäisen annostelun jälkeen oli 20-40 minuuttia mupirosiinilla ja 30-80 minuuttia monihapolla.
metabolia: Laskimoon tai suun kautta annettu mupirosiini metaboloituu nopeasti. Päämetaboliitilla, monihapolla, ei ole antibakteerista vaikutusta.
erittyminen: Monihappo eliminoituu pääasiassa erittymällä munuaisten kautta.
mikrobiologia
mupirosiini on RNA-syntetaasi-inhibiittori antibakteerinen, jota tuotetaan fermentoimalla Pseudomonas fluoresens-organismin avulla.
vaikutusmekanismi
mupirosiini estää bakteerien proteiinisynteesiä sitoutumalla reversiibelisti ja spesifisesti bakteerien isoleusyylinsiirto-RNA (tRNA) – syntetaasiin.
mupirosiini on bakterisidinen pitoisuuksina, jotka saavutetaan paikallisesti annettuna. Mupirosiini sitoutuu voimakkaasti proteiineihin (yli 97%), eikä haavan eritteen vaikutusta mupirosiinin pienimpiin inhibitorisiin pitoisuuksiin (Mic) ole määritetty.
resistenssi
kun mupirosiiniresistenssi syntyy, se johtuu modifioidun isoleusyyli-tRNA-syntetaasin tuotannosta tai uuden isoleusyyli-tRNA-syntetaasin välittävän plasmidin hankinnasta geneettisellä siirrolla. Korkean tason plasmidivälitteistä resistenssiä (MIC ≥512 mcg/mL) on raportoitu lisääntyvässä määrin S. aureus-isolaattien määrässä ja useammin koagulaasinegatiivisissa stafylokokeissa. Mupirosiiniresistenssiä esiintyy useammin metisilliiniresistenteillä kuin metisilliinille herkillä stafylokokeilla.
ristiresistenssi
vaikutustapansa vuoksi mupirosiini ei osoita ristiresistenssiä muiden mikrobilääkkeiden luokkien kanssa.
antimikrobinen vaikutus
Mupirosiinin on osoitettu tehoavan S. aureuksen ja S. pyogenes, sekä in vitro että kliinisissä tutkimuksissa . Seuraavat in vitro-tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Mupirosiini tehoaa useimpiin Staphylococcus epidermidis-isolaatteihin.
Herkkyystestimenetelmät
korkean tason mupirosiiniresistenssi (≥512 mcg / mL) voidaan määrittää standardoiduilla levydiffuusiotesteillä tai liemen mikrodiluutiotesteillä.1, 2 koska mupirosiiniresistenssi ilmenee metisilliiniresistentissä S: ssä. aureus (MRSA), on aiheellista testata MRSA-populaatiot mupirosiiniherkkyyden varalta ennen mupirosiinin käyttöä standardoidulla menetelmällä.3,4,5
ei-kliininen toksikologia
karsinogeneesi, mutageneesi, Fertiliteetin heikkeneminen
mupirosiinikalsiumin karsinogeenisuutta arvioivia pitkäaikaisia eläinkokeita ei ole tehty.
seuraavien mupirosiinikalsiumilla tai mupirosiininatriumilla in vitro ja in vivo tehtyjen tutkimusten tulokset eivät viitanneet genotoksisuuden mahdollisuuteen: rotan primaarinen hepatosyytti unscheduled DNA synthesis, sedimenttianalyysi DNA strand breaks, Salmonella reversion test (Ames), Escherichia coli-mutaatiotesti, ihmisen lymfosyyttien metafaasianalyysi, hiiren lymfoomakoe ja luuytimen mikrotumatesti hiirillä.
hedelmällisyys – / lisääntymiskykyä koskeneessa tutkimuksessa (annostelu imetyksen kautta) uros-ja naarasrotille ihon alle annettuna enintään 100 mg / kg / vrk, mikä on 14-kertainen ihmisen paikalliseen annokseen verrattuna (noin 60 mg mupirosiinia / vrk), kun annos on jaettu koko kehon pinta-alaan, ei aiheutunut mupirosiinista johtuvaa hedelmällisyyden tai lisääntymiskyvyn heikkenemistä.
kliiniset tutkimukset
paikallisen Mupirosiinivoiteen teho toissijaisesti infektoituneiden traumaattisten iholeesioiden hoidossa (esim., haavoja, ommeltuja haavoja ja hiertymiä, joiden pituus on enintään 10 cm tai kokonaispinta-ala 100 cm2) verrattiin suun kautta otettuun kefaleksiiniin kahdessa satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa. Kliinistä tehoa seurannassa per protocol-ryhmissä (aikuiset ja lapsipotilaat mukaan luettuina) oli 96, 1% Mupirosiinivoiteella (n = 231) ja 93, 1% suun kautta otettavalla kefaleksiinilla (N = 219). Per protocol-populaatioissa tehdyssä seurannassa taudinaiheuttajan hävittämisprosentit olivat 100% sekä Mupirosiinivoiteen että suun kautta otettavan kefaleksiinin osalta.
Pediatrics
toissijaisesti infektoituneisiin iholeesiotutkimuksiin osallistui 93 2 viikon-16 vuoden ikäistä lapsipotilasta tutkimussuunnitelmaa kohti, vaikka vain 3 oli alle 2-vuotiaita Mupirosiinivoiteella hoidetuista potilaista. Koehenkilöt satunnaistettiin saamaan joko 10 päivää paikallista Mupirosiinivoidetta 3 kertaa vuorokaudessa tai 10 päivää kefaleksiinia suun kautta (250 mg 4 kertaa vuorokaudessa yli 40 kg painaville koehenkilöille tai 25 mg / kg oraalisuspensiota 4 jaettuna 40 kg painaville koehenkilöille). Kliininen teho seurannassa (7-12 päivää hoidon jälkeen) per-protocol-potilasryhmässä oli 97, 7% (43 / 44) Mupirosiinivoiteella ja 93, 9% (46 / 49) kefaleksiinilla.
- Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility Testing kahdeskymmeneskuudes Kattava Täydentää. Clsi: n asiakirja M100-S26. Clinical and Laboratory Standards Institute, 950 West Valley Rd., Suite 2500, Wayne, PA 19087, USA, 2016.
- Patel J, Gorwitz RJ, et al. Mupirosiiniresistenssi. Kliiniset Tartuntataudit. 2009; 49(6):935-41.
- Clinical and Laboratory Standards Institute (CLSI). Methods for Diluution Antimicrobial Herkkyystests for Bacterium that Grow Aerobically; Approved Standard-Tenth Edition. CLSI: n asiakirja M07-A10. Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
- Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Disk Diffusion Susceptibility Tests; Approved Standard-kahdestoista Painos. CLSI-asiakirja M02-A12. Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
- Finlay JE, Miller LA, Poupard JA. Tulkitsevat kriteerit stafylokokkien herkkyyden testaamiseksi mupirosiinille. Antimicrob Agents Chemother 1997;41(5): 1137-1139.
miten/varastointi ja käsittely
Mupirosiinivoide on valkoinen voide, joka sisältää 20 mg (2% w / w) mupirosiinia grammassa öljy – vesipohjaisessa emulsiossa.
Mupirosiinivoide USP, 2% toimitetaan 15 gramman (NDC 16714-055-01) ja 30 gramman (NDC 16714-055-02) putkissa.
säilytä 20° C-25°C (68° – 77°F) . Ei saa jäätyä.
Potilasneuvonnan tiedot
neuvoo potilasta lukemaan FDA: n hyväksymät potilasmerkinnät (potilastiedot).
neuvo potilasta antamaan Mupirosiinivoidetta seuraavasti:
- käytä Mupirosiinivoidetta vain terveydenhuollon tarjoajan ohjeiden mukaan. Se on tarkoitettu vain ulkoiseen käyttöön. Vältä Mupirosiinivoiteen joutumista silmiin. Jos Mupirosiinivoidetta pääsee silmiin, huuhtele huolellisesti vedellä.
- älä käytä Mupirosiinivoidetta nenään.
- Pese kädet ennen Mupirosiinivoiteen levittämistä ja sen jälkeen.
- Levitä pieni määrä mupirosiinivoidetta hoidettavalle alueelle sideharsotyynyllä tai pumpulipuikolla. Käsitellyn alueen voi halutessaan peittää harsositeellä.
- ilmoita terveydenhuollon tarjoajalle kaikista paikallisista haittavaikutuksista. Mupirocin Cream on lopetettava ja terveydenhuollon tarjoaja yhteyttä, jos ärsytystä, voimakasta kutinaa tai ihottumaa esiintyy.
- ilmoita lääkärillesi tai mene lähimpään ensiapuun, jos ilmenee vakavia allergisia reaktioita, kuten huulten, kasvojen tai kielen turvotusta tai hengityksen vinkumista .
- Jos paranemista ei havaita 3-5 päivässä, ota yhteyttä terveydenhuollon tarjoajaan.
valmistettu: Northstar RxLLC
Memphis, TN 38141.
Valmistaja: Taro Pharmaceuticals Inc.
Brampton, Ontario, Kanada L6T 1C1.
myönnetty: marraskuussa 2020
5214500
54
| nämä potilastiedot on hyväksynyt Yhdysvaltain elintarvike-ja lääkevirasto. myönnetty: November 2020 5214500 54 |
||
| potilastiedot Mupirocin (mue pir ’ Oh sin) voide, jota käytetään paikallisesti |
||
| mitä mupirocin cream on? Mupirosiinivoide on reseptilääke, jota käytetään iholla (paikallisesti) tiettyjen Staphylococcus aureus-ja Streptococcus pyogenes-bakteerien aiheuttamien ihoinfektioiden hoitoon. Ei tiedetä, onko Mupirosiinivoide turvallinen ja tehokas alle 3 kuukauden ikäisillä lapsilla. |
||
| kenen ei pitäisi käyttää Mupirosiinivoidetta? Älä käytä Mupirosiinivoidetta, jos:
|
||
| mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen Mupirosiinivoiteen käyttöä? ennen kuin käytät Mupirocin-emulsiovoidetta, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, myös jos:
kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja käsikauppalääkkeet, vitamiinit ja rohdosvalmisteet. Älä sekoita Mupirosiinivoidetta muiden voiteiden, voiteiden tai voiteiden kanssa. |
||
Miten minun pitäisi käyttää Mupirosiinivoidetta?
|
||
| mitkä ovat Mupirosiinivoiteen mahdolliset haittavaikutukset? Mupirosiinivoide voi aiheuttaa vakavia haittavaikutuksia, mm.:
|
||
kasvojen, huulten, suun tai kielen turvotus koko kehon ylittävä ihottuma |
|
|
Mupirosiinivoiteen yleisimpiä haittavaikutuksia ovat:
Kysy lääkäriltäsi neuvoa sivuvaikutuksista. Haittavaikutuksista voi ilmoittaa FDA: lle 1-800-FDA-1088: ssa. |
||
Miten minun pitäisi säilyttää Mupirosiinivoidetta?
|
||
| yleistä tietoa Mupirosiinivoiteen turvallisesta ja tehokkaasta käytöstä. lääkkeitä määrätään joskus muihin kuin Potilastietoselosteessa mainittuihin tarkoituksiin. Älä käytä Mupirocin-voidetta tilaan, johon sitä ei ole määrätty. Älä anna Mupirocin-voidetta muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi aiheuttaa Voit kysyä apteekista tai terveydenhuollon tarjoaja tietoa Mupirocin kerma, joka on kirjoitettu terveydenhuollon ammattilaisille. |
||
| mitkä ovat mupirosiinivoiteen ainesosat? vaikuttava aine: mupirosiinikalsium inaktiiviset aineet: bentsyylialkoholi, setomakrogoli 1000, setyylialkoholi, mineraaliöljy, fenoksietanoli, puhdistettu vesi, stearyylialkoholi ja ksantaanikumi valmistettu: Northstar RxLLC, Memphis, TN 38141. Manufactured by: Taro Pharmaceuticals Inc., Brampton, Ontario, Canada L6T 1C1. For more information, call 1-800-206-7821. |
||
PRINCIPAL DISPLAY PANEL – 30 g Tube Carton
NDC 16714-055-02
Rx only
Mupirocin Cream USP
2%
FOR DERMATOLOGIC USE ONLY.
NORTHSTARx®
30 g

| MUPIROCIN mupirocin calcium cream |
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
|
||||||||||||||||||||
Labeler-NORTHSTAR RX LLC (830546433)
Frequently asked questions
- Voinko käyttää mupirosiinivoidetta vaippaihottumaan?
- voiko mupirosiini parantaa tai auttaa ekseemaan?
- Voiko mupirosiinia käyttää urheilijoiden jalkaan?
- Voiko mupirosiinivoidetta käyttää makuuhaavoihin?
lisää mupirosiinin ajankohtaisuudesta
- haittavaikutukset
- annostustiedot
- tukiryhmä
- 38 arvostelua
- huumeluokka: ajankohtaiset antibiootit
raskauden tai imetyksen aikana
ertaa vaihtoehtoja
innoittelu & KupongitEspanja
Consumer resources
- potilastiedot
- Mupirocin Nasal (Advanced Reading)
- Mupirocin Topical (Advanced Reading)
Professional resources
- Lääkemääräystiedot
- Mupirocin (Professional Patient Advice)
- Mupirocin (FDA)
muut merkit Bactroban, Bactroban nasal, Centany, Centany at, pirnuo
aiheeseen liittyvät hoito-ohjeet
- Staphylococcus aureuksen Nenäkuljetukset
- ihon ja rakenteen infektio
- sekundaariset ihon bakteeri-infektiot
- märkärupi
- Paronychia
lääketieteellinen Vastuuvapauslauseke